初中化学酸碱盐知识点总结
初中化学酸碱盐知识点总结
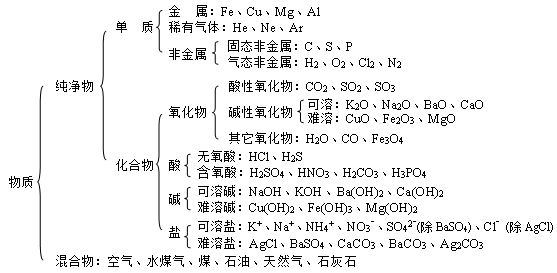
 一、物质的分类:
一、物质的分类:
二、各类物质的主要化学性质:
1.单质:
 1)金属:
1)金属:
 2)非金属 + 氧气 → 氧化物
2)非金属 + 氧气 → 氧化物
2.氧化物:
 1)酸性氧化物:
1)酸性氧化物:
 2)碱性氧化物:
2)碱性氧化物:
 3)水:
3)水:
 3.酸:
3.酸:
 4.碱:
4.碱:
5.盐:

三、化学反应的基本类型:
1)化合反应:(有单质时化合价改变)
⑴单质+单质→化合物 Mg + O2 = P + O2 =
⑵单质+化合物→化合物 C + CO2 =
⑶化合物+化合物→化合物 CaO + H2O = CuSO4 + H2O =
2)分解反应:(有单质时化合价改变)
⑴氧化物分解 H2O = HgO =
⑵酸分解 H2CO3 =
⑶盐分解 KMnO4 = KClO3 =
CaCO3 = CuSO4·5H2O =
3)置换反应:(化合价一定改变)
⑴金属+酸→盐+氢气(①H前面的金属;②不能是浓硫酸和硝酸)
Fe + HCl = Al + H2SO4 =
⑵金属+盐→盐+金属(①排在前面的金属;②可溶性盐)
Fe + CuSO4 = Cu + AgNO3 =
⑶金属氧化物+H2(或C)→金属+水(或CO2)
CuO + H2 = C + Fe2O3 =
4)复分解反应:(化合价一定不变)
⑴碱性氧化物+酸→盐+水
Fe2O3 + HCl = CuO + H2SO4 =
⑵酸+碱→盐+水
NaOH + H2SO4 = Fe(OH)3 + HCl =
⑶酸+盐→盐+酸(可溶反应物能生成↓、↑、H2O;难溶反应物能生成↑、H2O)
H2SO4 + BaCl2 = HCl + CaCO3 =
⑷碱+盐→碱+盐(反应物必须可溶且生成物之一必须是不溶物)
Ca(OH)2 + Na2CO3 = NaOH + FeCl3 =
⑸盐+盐→盐+盐(反应物必须可溶且生成物之一必须是不溶物)
CaCl2 + K2CO3 = Ba(NO3)2 + Na2SO4 =
※不属于四种基本类型的反应:
⑴金属氧化物+CO→金属+CO2 Fe2O3 + CO =
⑵碱+酸性氧化物→盐+水(可溶性碱) NaOH + CO2 =
⑶有机物+O2→H2O+CO2 C2H5OH + O2 =
☆氧化还原反应:
得到氧的物质被氧化,发生氧化反应,是还原剂;
失去氧的物质被还原,发生还原反应,是氧化剂。
如:在2Mg+CO2 点燃 2MgO+C中, 是氧化剂, 是还原剂, 被氧化, 被还原。
 ☆常见的原子团及其化合价:
☆常见的原子团及其化合价:
四、金属活动性顺序和复分解反应发生的条件:
1.金属活动性顺序:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
———————————————————————→
金属活动性由强逐渐减弱
1、金属位置越靠前,金属活动性就越强;
2、位于氢前面的金属能置换出酸中的氢;
3、前面的金属能把后面的金属从它们的盐溶液中置换出来。
⑴判断金属与酸反应时:金属必须排在(H)前面;酸不可用硝酸。
⑵判断金属与盐反应时:必须同时满足①排在前面的金属;②可溶性盐。
2.复分解反应发生的条件:
⑴可溶的反应物,能生成↓、或H2O、或↑(CO2或NH3)
⑵难溶的反应物,能生成↑、或H2O
 ☆复分解反应生成的沉淀:
☆复分解反应生成的沉淀:
五、物质的鉴别、鉴定(检验)、提纯(除杂)、分离:
☆检验物质的试剂:

六、气体的干燥:

注意:酸性干燥剂不能用于干燥碱性气体;碱性干燥剂不能用于干燥酸性气体。
七、其他:
1.物质的学名、俗名及化学式:
⑴水银、汞、Hg
⑵金刚石、石墨、C;硫磺、S;红磷、白磷、P
⑶干冰、固体 CO2
⑷生石灰、氧化钙、CaO;氨气、NH3(碱性气体)
⑸盐酸、氢氯酸、HCl;氢硫酸、H2S;亚硫酸、H2SO3
⑹熟石灰、消石灰、Ca(OH)2;苛性钠、烧碱、火碱、NaOH;氨水、NH3·H2O(碱)
⑺纯碱、Na2CO3;碳酸钠晶体、纯碱晶体、Na2CO3·10H2O;碳酸氢钠、小苏打、NaHCO3;亚硝酸钠、NaNO2(工业用盐);胆矾、蓝矾、硫酸铜晶体、CuSO4·5H2O;铜绿、Cu2(OH)2CO3
⑻甲烷、CH4;甲醇、CH3OH;酒精、乙醇、C2H5OH;醋酸、乙酸、(冰醋酸)CH3COOH
2.常见混合物的主要成分:
煤:C; 石油:C、H、O元素 天然气:CH4
水煤气:H2、CO 石灰石、大理石:CaCO3 石灰水、石灰乳、石灰浆:Ca(OH)2
3.常见物质的颜色:
△ 白色固体:MgO、P2O5、CaO、NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4
△ 银白色:镁、铝、锌、铁、汞(液态)
△ 黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O4
△ 红色固体:Cu、Fe2O3 、HgO、红磷
△ 蓝色晶体:CuSO4·5H2O
△ KMnO4为紫黑色
△ 硫:淡黄色
△ Cu2(OH)2CO3为绿色
4.溶液的颜色:
△含Cu2+的溶液呈蓝色(CuCl2溶液为蓝绿色);
△ 含Fe2+的溶液呈浅绿色;
△ 含Fe3+的溶液呈黄色;
△ 其余溶液一般为无色。(高锰酸钾溶液为紫红色)
5.溶于水放热的物质:CaO、NaOH固体、浓H2SO4
6.刺激性气味的气体:NH3、SO2、HCl(均无色)
▲刺激性气味的液体:盐酸、硝酸、醋酸
▲酒精为有特殊气体的液体
7.有毒的物质:CO、CH3OH、NaNO2、Cu2+(如CuSO4)、Ba2+(如BaCl2)
初中化学知识点总结-----酸碱盐
提要:酸碱盐是初中化学的重点和难点,本文力求把相关内容按知识呈现的规律,让你掌握这些知识后就能对酸碱盐的复习有所突破。
一、溶液的导电性
1、有些化合物的水溶液能够导电的原因是什么?------原因是溶液中有自由移动的离子。
2、哪些物质的水溶液能够导电?---------------------------酸、碱、盐的水溶液能够导电。
二、酸、碱、盐的概念
1、什么是酸?
电离时生成的阳离子全部是氢离子(H+)的化合物叫做酸。
可表示为:酸---→氢离子(阳离子)+酸根离子(阴离子)
如:硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3)、碳酸(H2CO3)
2、什么是碱?
电离时生成的阴离子全部是氢氧根离子(OH-)的化合物叫做碱。
可表示为:碱---→金属离子(阳离子)+氢氧根离子(阴离子)
如:氢氧化钠(NaOH)、氢氧化钙[Ca(OH)2]、氨水(NH3·H2O)
3、什么是盐?
由金属离子和酸根离子组成的化合物叫做盐。
可表示为:盐---→金属离子(阳离子)+酸根离子(阴离子)
如:氯化钠NaCl 、碳酸钠(Na 2CO3)、硝酸银(AgNO3)碳酸氢钠(NaHCO3)
三、常见的酸及酸的通性
1、浓盐酸、浓硫酸的物理性质、特性、用途

2、酸的通性(具有通性的原因:酸溶液中都有氢离子)
(1)与酸碱指示剂的反应: 酸溶液能使紫色石蕊试液变红色,不能使无色酚酞试液变色。
(2)金属 + 酸 → 盐 + 氢气(置换反应)
条件:(1)金属:在金属活动性顺序中排在氢前面的金属;
(2) 酸:无氧化性酸。如盐酸、稀硫酸(除外:浓硫酸、硝酸有氧化性与金属反应不生成氢气)。
[注意]铁与酸发生置换反应时生成亚铁盐(Fe为+2价)
(3)金属氧化物 + 酸 → 盐 + 水(复分解反应)
(4)碱 + 酸 → 盐 + 水(复分解反应)
(5)盐 + 酸 → 另一种盐 + 另一种酸(复分解反应)
条件:生成物中沉淀、气体或水。
练习:利用酸的通性写出四个生成氯化镁的化学方程式
3、三种离子的检验

三、常见的碱的物理性质、俗名、制法及用途
1、氢氧化钠、氢氧化钙的物理性质、用途

2、碱的通性(具有通性的原因:碱溶液中都有氢氧根离子)
(1)与酸碱指示剂的反应: 碱溶液使紫色石蕊试液变蓝色,使无色酚酞试液变红色
(难溶于水的碱不能使指示剂变色)
(2)非金属氧化物+碱 → 盐+水(不是复分解反应)
(3)酸+碱 → 盐+水
(4)盐+碱 → 另一种盐+另一种碱
条件:反应物均可溶,生成物中有沉淀、气体或水。
注:常见沉淀:白色----AgCl↓、BaSO4↓、Mg(OH)2↓、BaCO3↓、CaCO3↓
蓝色---Cu(OH)2↓
红褐色----F e(OH)3↓
四、复分解反应
1、定义:由两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应。
2、符号表示:AB+CD=AD+CB
3、本质:是溶液中的离子结合成难电离的物质(如水)、难溶的物质或气体,而使复分解反应趋于完成。(可简记为:碱--盐、盐--盐水中溶,沉淀、气体、水生成。)
4、反应发生的条件:

注:在复分解反应中,所有元素的化合价在反应前后都不变。
五、中和反应 溶液酸碱度的表示法——pH
1、中和反应的定义:酸与碱作用生成盐和水的反应叫中和反应。中和反应属于复分解反应。
2、中和反应的应用:
(1)改变土壤的酸碱性
(2)处理工厂的废水
(3)用于医药
3、溶液酸碱度的表示法——pH
(1)pH与溶液酸碱性的关系 (记忆:小7酸,大7碱,是7中性显)
0 7 14
酸性增强 中性 碱性增强
(2)pH的测定:最简单的方法是使用pH试纸
用玻璃棒(或滴管)蘸取待测试液少许,滴在pH试纸上,显色后与标准比色卡对照,读出溶液的pH(读数为整数)
(3)酸雨:正常雨水的pH约为5.6(因为溶有CO2)
pH<5.6的雨水为酸雨
第二篇:人教初中化学酸碱盐知识点总结
20##年初中化学酸碱盐知识点总结
 一、物质的分类:
一、物质的分类:
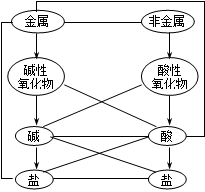
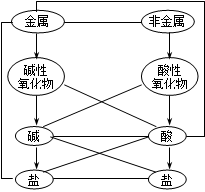
二、各类物质的主要化学性质:(见下图。短线表示相互间能反应,箭号表示相互间能转化)
1.单质:
 1)金属:
1)金属:
 2)非金属 + 氧气 → 氧化物
2)非金属 + 氧气 → 氧化物
2.氧化物:
 1)酸性氧化物:
1)酸性氧化物:
 2)碱性氧化物:
2)碱性氧化物:
 3)水:
3)水:
 3.酸:
3.酸:
 4.碱:
4.碱:
5.盐:

三、化学反应的基本类型:
1)化合反应:(有单质时化合价改变)
⑴单质+单质→化合物 Mg + O2 —— P + O2 ——
⑵单质+化合物→化合物 C + CO2 ——
⑶化合物+化合物→化合物 CaO + H2O —— CuSO4 + H2O ——
2)分解反应:(有单质时化合价改变)
⑴氧化物分解 H2O —— HgO ——
⑵酸分解 H2CO3 ——
⑶盐分解 KMnO4 —— KClO3 ——
CaCO3 —— CuSO4·5H2O ——
Cu2(OH)2CO3 ——
3)置换反应:(化合价一定改变)
⑴金属+酸→盐+氢气(①H前面的金属;②不能是浓硫酸和硝酸)
Fe + HCl — Al + H2SO4 —
⑵金属+盐→盐+金属(①排在前面的金属;②可溶性盐)
Fe + CuSO4 — Cu + AgNO3 —
⑶金属氧化物+H2(或C)→金属+水(或CO2)
CuO + H2 — C + Fe2O3 ——
4)复分解反应:(化合价一定不变)
⑴碱性氧化物+酸→盐+水
Fe2O3 + HCl — CuO + H2SO4 —
⑵酸+碱→盐+水
NaOH + H2SO4 — Fe(OH)3 + HCl —
⑶酸+盐→盐+酸(可溶反应物能生成↓、↑、H2O;难溶反应物能生成↑、H2O)
H2SO4 + BaCl2 — HCl + CaCO3 —
⑷碱+盐→碱+盐(反应物必须可溶且生成物之一必须是不溶物)
Ca(OH)2 + Na2CO3 — NaOH + FeCl3 —
⑸盐+盐→盐+盐(反应物必须可溶且生成物之一必须是不溶物)
CaCl2 + K2CO3 — Ba(NO3)2 + Na2SO4 —
※不属于四种基本类型的反应:
⑴金属氧化物+CO→金属+CO2 Fe2O3 + CO ——
⑵碱+酸性氧化物→盐+水(可溶性碱) NaOH + CO2 —
⑶有机物+O2→H2O+CO2 C2H5OH + O2 ——
☆氧化还原反应:
得到氧的物质被氧化,发生氧化反应,是还原剂;
失去氧的物质被还原,发生还原反应,是氧化剂。
如:在2Mg+CO2 点燃 2MgO+C中, 是氧化剂, 是还原剂, 被氧化,
被还原。
 ☆常见的原子团及其化合价:
☆常见的原子团及其化合价:
四、金属活动性顺序和复分解反应发生的条件:
1.金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
⑴判断金属与酸反应时:金属必须排在(H)前面;酸不可用硝酸。
⑵判断金属与盐反应时:必须同时满足①排在前面的金属;②可溶性盐。
2.复分解反应发生的条件:
⑴可溶的反应物,能生成↓、或H2O、或↑(CO2或NH3)
⑵难溶的反应物,能生成↑、或H2O
 ☆复分解反应生成的沉淀:
☆复分解反应生成的沉淀:
五、物质的鉴别、鉴定(检验)、提纯(除杂)、分离:
☆检验物质的试剂:

⑴鉴别:鉴别是将不同的物质按其物理性质或化学性质的不同而加以辨别的过程。
写出鉴别下列各组物质所需的试剂或方法:
①鉴别Na2CO3和CaCO3: ②鉴别Na2SO4和NaCl:
③鉴别H2和CH4: 、 ④鉴别Na2CO3和NaCl:
⑵鉴定(检验):检验是用一定的化学方法或物理方法将某种物质确定出来的过程。
写出检验下列各物质所需的试剂或方法:
①盐酸: 、 ②Fe2(SO4)3: 、
 ⑶除杂:除杂是用物理或化学方法除去混合物中的杂质的过程。
⑶除杂:除杂是用物理或化学方法除去混合物中的杂质的过程。
写出除去下列各物质中的杂质所需的试剂或方法:
①除去MnO2中的KCl: ②除去NaOH中的Na2CO3:
⑷提纯:提纯是用物理或化学方法除去混合物中的杂质除去并得到某纯净物的过程。
写出提纯下列各物质的实验步骤及所需的试剂或方法:
①从KCl与MnO2的混合物中提纯KCl: 、 、
②从MgCl2与CaCl2的混合物中提纯MgCl2: 、 、 、
⑸分离:分离将混合物中的各成分用物理或化学方法分开从而得到各纯净物的过程。
写出分离下列各物质的实验步骤及所需的试剂或方法:
①分离KCl与MnO2的混合物; ②分离BaCl2与NaCl的混合物。
六、气体的干燥:

注意:酸性干燥剂不能用于干燥碱性气体;碱性干燥剂不能用于干燥酸性气体。
七、其他:
1.物质的学名、俗名及化学式:
⑴水银、汞、Hg
⑵金刚石、石墨、C;硫磺、S;红磷、白磷、P
⑶干冰、固体CO2
⑷生石灰、氧化钙、CaO;氨气、NH3(碱性气体)
⑸盐酸、氢氯酸、HCl;氢硫酸、H2S;亚硫酸、H2SO3
⑹熟石灰、消石灰、Ca(OH)2;苛性钠、烧碱、火碱、NaOH;氨水、NH3·H2O(碱)
⑺纯碱、Na2CO3;碳酸钠晶体、纯碱晶体、Na2CO3·10H2O;碳酸氢钠、小苏打、NaHCO3;亚硝酸钠、NaNO2(工业用盐);胆矾、蓝矾、硫酸铜晶体、CuSO4·5H2O;铜绿、Cu2(OH)2CO3
⑻甲烷、CH4;甲醇、CH3OH;酒精、乙醇、C2H5OH;醋酸、乙酸、(冰醋酸)CH3COOH
2.常见混合物的主要成分:
煤:C; 石油:C、H、O元素 天然气:CH4
水煤气:H2、CO 石灰石、大理石:CaCO3 石灰水、石灰乳、石灰浆:Ca(OH)2
3.常见物质的颜色:
△ 白色固体:MgO、P2O5、CaO、NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4
△ 银白色:镁、铝、锌、铁、汞(液态)
△ 黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O4
△ 红色固体:Cu、Fe2O3 、HgO、红磷
△ 蓝色晶体:CuSO4·5H2O
△ KMnO4为紫黑色
△ 硫:淡黄色
△ Cu2(OH)2CO3为绿色
4.溶液的颜色:
△含Cu2+的溶液呈蓝色(CuCl2溶液为蓝绿色);
△ 含Fe2+的溶液呈浅绿色;
△ 含Fe3+的溶液呈黄色;
△ 其余溶液一般为无色。(高锰酸钾溶液为紫红色)
5溶于水放热的物质:CaO、NaOH固体、浓H2SO4
6刺激性气味的气体:NH3、SO2、HCl(均无色)
▲刺激性气味的液体:盐酸、硝酸、醋酸
▲酒精为有特殊气体的液体
7有毒的物质:CO、CH3OH、NaNO2、Cu2+(如CuSO4)、Ba2+(如BaCl2)
8氮肥的含氮量:
NH4HCO3 17.7%;(NH4)2SO4 21.2%;NH4Cl 26.2%;NH4NO3 35%;尿素CO(NH2)2 46.7%
-
初三化学酸碱盐知识点总结
初三化学酸碱盐金属知识点总结一酸碱盐的组成酸是由氢元素和酸根组成的化合物如硫酸H2SO4盐酸HCl硝酸HNO3碱是由金属元素和氢氧…
-
初中化学酸碱盐知识归纳
一概念1酸的组成氢离子酸根离子2碱的组成金属离子氢氧根离子3盐的组成金属离子酸根离子4复分解反应由两种化合物互相交换成分生成另外两…
-
初中化学酸碱盐知识点总结
龙文教育您值得信赖的专业化个性化辅导学校初中化学酸碱盐知识点总结一物质的分类金属FeCuMgAl单质稀有气体HeNeAr固态非金属…
-
20xx.4.14初三化学酸碱盐知识点总结
初三化学酸碱盐知识点总结一酸碱盐的组成酸是由氢元素和酸根组成的化合物如硫酸H2SO4盐酸HCl硝酸HNO3碱是由金属元素和氢氧根组…
-
初三化学酸碱盐知识点汇编
初三化学《酸-碱-盐》知识点总结一、酸、碱、盐的组成酸是由氢元素和酸根组成的化合物如:硫酸(H2SO4)、盐酸(HCl)、硝酸(H…
-
初三化学酸碱盐知识点总结
初三化学《酸-碱-盐》知识点总结一、酸、碱、盐的组成酸是由氢元素和酸根组成的化合物如:硫酸(H2SO4)、盐酸(HCl)、硝酸(H…
-
九年级化学酸碱盐知识点总结
九年级化学知识点总结—酸、碱、盐一.酸碱盐的组成与性质酸、碱、盐的组成:酸是由氢元素和酸根组成的化合物如:硫酸(H2SO4)、盐酸…
-
九年级化学酸碱盐知识点总结
初三化学知识点总结—酸、碱、盐一.酸碱盐的组成与性质酸、碱、盐的组成:酸是由氢元素和酸根组成的化合物如:硫酸(H2SO4)、盐酸(…
-
初三化学酸碱盐知识点汇编
初三化学《酸-碱-盐》知识点总结一、酸、碱、盐的组成酸是由氢元素和酸根组成的化合物如:硫酸(H2SO4)、盐酸(HCl)、硝酸(H…
-
中考化学酸碱盐知识点
中考化学酸碱盐知识点一、熟记常见元素和原子团的化合价口诀:(正价)一氢钾钠银,二钙镁钡锌,三铝、四硅、五氮磷。(负价)负一价:氟、…
-
初三化学酸碱盐知识点总结.
初三化学《酸-碱-盐》知识点总结2、碱的通性(具有通性的原因:离解时所生成的阴离子全部是OH)一、酸、碱、盐的组成酸是由氢元素和酸…