大学物理热学部分总结
专业:通信工程 班级:09级四班 姓名:蒋双福
学号:0906020423 教师:朱卫华 时间:2010.10

1
大学物理热学部分总结
热力学基础 (一)热力学的基本概念
1)热力学系统:由大量分子、原子组成的宏观物质,简称系统
2)孤立系统:与外界不发生任何的物质与能量交换的热力学系统。
3)封闭系统:与外界只有能量交换而无物质交换的系统
4)开放系统:与外界同时发生能量交换与物质交换的系统。
5)状态参量:描述热力学系统状态的物理量。
6)热运动:大量分子无序的运动。
7)宏观量:从整体上描述系统的状态量,一般可以直接测量,包括广延量和强 度量。
广延量(可以累加):M(摩尔质量) V(体积) E(动能)
强度量(不可以累加):P(压强) T(温度)
8)微观量: 描述系统内微观粒子的物理量。
如分子的m(质量)、 d(直径) 、v(速度) 、p(动量) 、?(能量)
51atm?1.01325*10Pa?760mmH g
9)热力学第零定律表述:如果两个热力学系统中的每一个都与第三个热力学系
统处于平衡状态,则这两个 系统彼此也处于平衡状态。
10)温度;处在同一热平衡状态的所有热力学系统都具有一个共同的宏观特性,
这一特性可由这些系统的状态参量来描述,这个状态参量被定义为温度。
温度是表征系统热平衡时宏观状态的物理量。
11)温标:定量描述温度的数值表示方法。
2
摄氏温标 单位为摄氏度(0C) 热力学温标(开尔文温标) 单位开(K) 热力学温标与摄氏温标的换算关系:
T/K?273.150C?t (1)
12)平衡态:一定量的气体,在不受外界的影响下, 经过一定的时间,系统达到一个稳定的,宏观性质不随时间变化的状态称为平衡态 。(特点,温度相等)
13)准静态过程:在热力学过程中的每个中间状态都无限接近于平衡态。如活塞缓慢移动的汽缸的过程,可在p?V图表示。
14)非静态过程:中间状态为非平衡态的过程,不可在p?V图表示。
15)p?V图上的一个点,表示一个平衡态,p?V图上一条曲线,表示一个准静态过程。
16)当质量一定的气体处于平衡态时,其三个参量P V T 并不互相独立,而是存在一定的关系,其表达式称为气体的状态方程,一般可表示为:
f(p,V,T)?0 (2)
17)理想气体的状态参量P,V,T三者之间关系的状态方程:
p1V1p2V2 (3) ?T1T2
18)阿伏伽德罗定律:当一定质量的理想气体在相同温度和压强下,具有相同的体积,而当温度为273.15K,压强为标准大气压1.013*105Pa时,1mol任何理想气体的体积为V?22.4*10?3m3。
19)气体处T0?273.15K,P0?1.013?105Pa时的状态称为标准状态。设置质量为m,摩尔质量为M的理想气体从状态(p,V,T)经一系列变化过程到达标准状态(p0,V0,T0),根据(3)有
3
PVP0V0mP0VmPV 令R?0m,则有 ??
0TT0MT0
mRT (4) M PV?
R?8.31J.mol?1.K?1,称为摩尔气体常量,(3)式被称为理想气体的状态方程。
20)一定理想气体的疯子质量为m0,分子数为N,并以Na表示阿伏伽德罗常数(Na?6.022?1023mol?1),则气体质量为m?Nm0,气体的摩尔质量为M?Nam0,代入(4)得
p?
令k?Nm0RTNRmRT??T MVNAm0VVNAN为单位体积内的分VNA?1.38?10?23J?K?1,称为波尔兹曼常数,令n?
子数,并称n为分子数密度,有
p?nkT (5)
洛施密特常量:标准状态下理想气体的分子数密度为2.69?1025m?3
(二)热力学第一定律
1)系统内分子热运动的动能和分子之间相互作用势能之和称为系统的内能。分子之间的相互作用势能与分子间距有关,也应该与系统的体积有关。分子无序运动动能的平均效果与系统的温度有关。所以气体的内能是温度T和体积V的函数。
2)理想气体内能只与温度有关,E理?E理(T)?iRT。 3)热力学第一定律,做功和热传递
Q??E?W (6)
4
对于非静态微小过程而言,可以将热力学第一定律的表达式写成微分形式: dQ?dE?dW (7)
4)准静态过程中的功
?.F为气体作用在活塞上的压力,p为气体压强,S为活塞面积,活塞移动了dl距离,从而气体的体积增加了dV,对外所做的元功为
lpdV dW?F?dl?pSd? (8)
?.若气体体积从V1变化到V2,则系统对外做功为
W??pdV (9) V1V2
V2?V1时,气体膨胀,系统对外做功,W?0
V2?V1时,气体被压缩,外界对系统做功,W?0
5)准静态过程中的热量
?.在热量传递的某个微过程中,热力学系统吸收热量dQ,温度升高了dT,则定
C?dQ
dT (10) 义为
单位质量的热容为称为比热容,记作c,其单位为J?K?1?kg?1,设系统的质量为m,则有 C?cm
?.一个质量为m,摩尔质量M的系统,在某一微过程中吸收的热量为 dQ?mmcMdT?CmdT (11a) MM
当温度从T1升高至T2时,其吸收的热量为
Q??T2
T1mmdT (11b) M
5
为系统物质的量,Cm?cM称为摩尔热容,摩尔热容的定义式:
MdQ() (12) mdT Cm?
微小过程,热量的计算公式为
dQ?mCmdT (13) M
?.理想气体在状态变化过程中体积保持不变时,其摩尔热容为
CV,m?MdQi()V?R (14) mdT2
CV,m称为定体摩尔热容,R为摩尔气体常量,i是气体分子自由度
i的取值表

理想气体在状态变化过程中压强保持不变时,其摩尔热容为
Cp,m?MdQi()P?(?1)R (15) mdT2
CP,m为定压摩尔热容
6)准静态过程中的内能变化
?.以理想气体在状态变化过程中体积的过程为例,由于这一过程中,系统做功为零(dW?pdV?0),根据热力学第一定律,内能的增量等于过程中系统从外界吸收的热量,由11式,可得内能增量的微分表达式
dE?mCV,mdT (16a) M
?.对质量为m,摩尔质量为M,定体摩尔热容CV,m恒定的理想气体,系统内能的增量为
E2?E1??
T2T1mmV,mdT?CV,m(T2?T1) (16b) MM6
上两式又可以表示为
miRdT (17a) M2
miR(T2?T1) (17b) E2?E1?M2 dE?
(三)热力学第一定律的应用
1)等体过程
?.系统体积保持不变的过程称为等体过程。等体过程的特征方程为: pmR??恒量 TMV
此方程在p?V图上可以表示为一条垂直于V轴的直线,这条直线称为等体线。 ?.在等体过程中,由于dV?0,因此dW?pdV?0,即系统对外不做功,根据热力学第一定律,系统在等体过程中吸收的热量为QV,它等于内能的增量,即 QV?E2?E1?mCV,m(T2?T1) M
iR代入上式,并考2式中物理量的脚标V表示相应的过程为等体过程,将CV,m?
虑到理想气体的状态方程式(4),可得等体过程中热量和内能增量的关系式:QV??E?imiR(T2?T1)=(p2?p1)V (18) 2M2
2)等压过程
?.系统在压强保持不变的过程称为等压过程,由理想气体状态方程可以得到等压过程的特征方程为
VmR??恒量 TMp
此方程在p?V图上可以表示为一条平行于V轴的直线,这条直线称为等压线。 ?.在等压过程中系统对外界做功为
7
V2 W??pdV?p(V2?V1) (19a) V1
有理想气体状态方程,上式有可以表示为
W?mR(T2?T1) (19b) M
系统内能变化与过程无关,因此等压过程中内能的增量也可以表示为(17)的形式 ?E?miR(T2?T1) M2
?.根据热力学第一定律,设系统在等压过程中吸收的热量为
Qp?(E2?E1)?W
m
M
m?M?imR(T2?T1)?R(T2?T1)2M (20a) i(?1)R(T2?T1)2
i或Qp?(?1)p(V2?V1) (20b) 2
式中物理量的脚标p表示相应的过程为等压过程。
由(11)也可以表示为:Qp?mCP,M(T2?T1) (21) M
由式(20)和式(21)可以得到定压摩尔热容的计算(15)
在等压过程中,理想气体吸收的热量,一部分转换成系统内能,另一部分转换为系统对外界所做的功。
3)定体摩尔热容与定压摩尔热容的关系
由(14)式和(15)式得:Cp,m?CV,m?R (22)
摩尔气体常量R在数值上等于1mol理想气体在等压过程中温度升高1K时对外做的功。
Cp,m与CV,m的比值称为比热容比
8
??Cp,m
CV,m?i?2 (23) i
理想气体的?、Cp,m、CV,m理论值
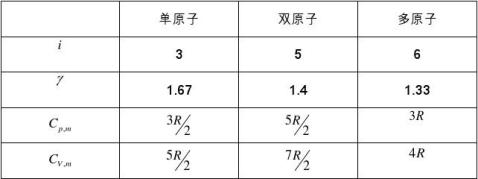
4)等温过程 ?.系统温度保持不变的过程称为等温过程,有理想气体状态方程可以得到等温过程特征方程:
pV?mRT?常量 M
此方程在p?V图上可表示为在第一象限内的一条双曲线,由上式可知,温度越高,式中的恒量值越大,曲线离两坐标轴越远。
?.在等温过程中,由于温度保持不变(?T?0),因而内能也保持不变(?E?0),因此系统吸收的热量完全用来对外做功,根据热力学第一定律有W?QT。由功德一般计算式(9)和理想气体的状态方程式(4),可计算出等温过程的功为
W??pdV??V1V2V2V1m1RTdVMV
(24) ?VmRTln2
MV1
pmRTln1
Mp2?
?.设等温过程中系统吸收的热量为
9
QT?W?VpmmRTln2?RTln1 (25) MV1Mp2
对于等温过程,由关系式(11)可得
QT?mCT,m?T M
式中的CT,m称为等温摩尔热容,当?T?0时,QT却不为零,因此必有 CT,m?MdQ()T?? (26) mdT
理想气体等温过程中系统吸收的热量全部用来对外界做功。
5)绝热过程
?.在状态变化过程中,系统与外界没有热量交换,这样的过程称为绝热过程。绝热过程在p?V图上是一条曲线,因为在绝热过程中dQ?0,所以有?E?W?0,亦即?E??W或??E?W
绝热过程中系统所做的功可以表示为
WQ???E??miR(T2?T1) (27) M2
?.根据热力学第一定律,理想气体进行绝热膨胀的微过程可表示为
pdV??mCV,mdT M
又对理想气体状态方程式(4)两边求微分得
pdV?Vdp?mRdT M
将上式两边中的dT消去,并整理后可得
(CV,m?R)pdV ??CV,mVdp
因为Cp,m?CV,m?R,Cp,m??,所以上式可改为 V,m
dpdV???0 pV10
对上式积分可得
pV??C1 (28a)
由(4)式和上式联立,可得
TV??C2 (28b)
p??1
??C3 (28c) T
(四)循环过程
1)循环过程:指系统经历了一系列状态变化以后,又回到原来状态的过程。 正循环:循环过程沿顺时针方向,系统对外所做净功为正--------------如热机。 逆循环:循环过程沿逆时针方向,系统对外所做净功为负------------如制冷机。 Q1?Q2?W (29)
(Q1为系统吸收的热量,Q2为系统放出热量,W为对外做的净功,?E?0)
2)热机效率:??1?QW?1?2 (30) Q1Q1
3)制冷系数:e?Q2Q2 (31) ?WQ1?Q2
(注意,Q1为在高温热源放出的热量,Q2为从低温热源吸收的热量)
4)卡诺循环:整个循环过程是由两个等温过程与两个绝热过程构成的。 ?.卡诺循环效率公式:??1?Q2T?1?2 (32) Q1T1
(由低温热源T2与高温热源T1决定)
?.卡诺循环的制冷系数e?T2 (33) T1?T2
(T2为低温热源,T1为高温热源)
11
(五)热力学第二定律 熵和热力学第二定律
1)可逆过程:使系统逆向重复原过程的每一状态回复到原来的状态,并同时消除了原过程对外界引起的一切影响的过程。
2)不可逆过程:如果系统不能重复原过程的每一状态恢复到初态,或虽然可复原,但不能消除原过程对外界产生的影响的过程。
非平衡态到平衡态的过程是 不可逆的,如气体的自由膨胀。
3)热力学第二定律的两种表述:
?.开尔文表述:不可能制成这样的一种热机,它只从单一的热源吸取热量,并将其完全转变为有用的功而不产生其他影响。
?.克劳修斯表述:不可能把热从低温物体传到高温物体而不产生其他影响。
4)卡诺定理:
?.定理1——在相同的高温热源和相同的低温热源之间工作的一切可逆热机效率都相等,工作物质无关。
??1?
Q2T?1?2Q1T1 (34)
?.定理2——在相同的高温热源和相同的低温热源之间工作的一切不可逆热机,其效率都小于可逆热机的效率,于是有
??1?
T2T1 (35)
5)微观态数目?:设总分子数为N,A室中有n个分子,则??Nn!?N?n?!(n?
N时,?最大) 2
12
6)热力学第二定律的统计意义:自然进行的过程是由热力学概率小的宏观状态向热力学概率大的宏观状态进行的。


一切不可逆过程都是从有序状态向无序状态的方向进行的。
7)熵(S):
?.定义:热力学概率,单位J?K?1
?.是组成系统的微观粒子无序性的量度。
?.波尔兹曼关系式:S?klnΩ
④.孤立系统处于平衡态时熵最大
⑤.熵是个状态量,可以叠加,S
8)克劳修斯熵公式:
?.等温过程 ?kln??kln?1?kln?2?S1?S2 (36) S?kNln?CV? (37)
V2m?S?RlnMV1 (38)
Q?S?T 称为热温比
?.任一热力过程:
dS?
dQT (39)
BBdQ?S??dS??AAT (40)
即热力学系统从A态变化到B态,在任意可逆的过程中,其熵等于该过程中热
dQdQ
温比T的积分;而在任意一个不可逆过程中,其熵大于热温比T的积分。
9)熵增加原理:
13
孤立系统中的熵永不减少:对于可逆过程,其熵不变;对于不可逆过程,其熵要增加 .
?S??21dQ?0T (41)
熵增加原理成立的条件: 孤立系统或绝热过程。
气体动理论 (一)气体动理论的基本概念
1)分子动理论的基本观点(很熟了,可忽略):
?.宏观物体都是由大量不停息地运动着的、彼此有相互作用的分子或原子组成 。
?.分子之间存在着一定的距离。
?.分子间存在相互作用力(引力与斥力)。
2)统计规律:大量偶然事件在整体上所呈现的规律(某个分子的运动具有偶然性,大量分子的运动具有规律性)。
3)可以对微观量求统计平均的方法来得到宏观物理量。
4)理想气体的微观模型:
?.分子可视为质点。
?.除碰撞瞬间, 分子间无相互作用力,因此分子在两次碰撞之间做匀速直线运动。
?.弹性质点(碰撞均为完全弹性碰撞)。
④.分子的运动遵从经典力学的规律。
14
(二)气体状态方程的微观解释
1)理想气体压强的统计意义:
2mn0x?.p=( m0为分子质量,n为总分子数密度)
各方向运动概率均等:
x?y?z?0
2
x2y2z (42) 12v?v?v?v3 (43)
?.压强公式: v2?vx2?v2y?vz2 (44)
2p?nk3 (45) 12k?m02(,为气体分子的平均平动动能)
?.道尔顿分压定律:平衡态下混合气体的压强等于各种分子组分压强的总和。
2P?nkT?nk?n1kT?n2kT??nikT????Pi3 (46)
2)温度的微观意义:
?.是气体分子的平均平动动能大小的度量,k?T
?.

k?13mv2?p?nkT 22?.温度是大量分子的集体表现,个别分子无意义,温度一样,气体平均平动动能大小的度量一样。
15
(三)能量按自由度均分原理
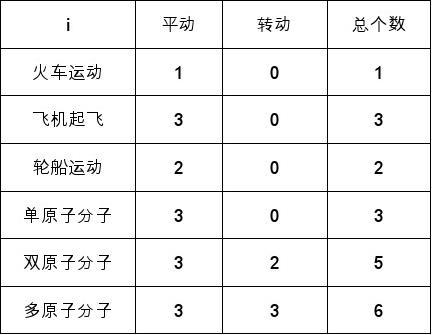
1)自由度:物体在空间的位置所必需的独立坐标数目. 实例:
2)能量均分原理:在温度为T的平衡态下,物质分子的每个自由度都具有相同
1kT
的平均动能,其值为2。
i个自由度分子的平均动能为
?k
.3)理想气体的内能计算公式:
i
?kT2 (47)
miE?RT
M2
(48)
16
mi?E?R?TM2 (49)
(四)麦克斯韦速率分布
1)麦克维斯速率分布函数:
f(v)?lim
?.?N1dN??v?0N?vNdv,物理意义为表示在温度为的平衡状态下,速率在附近单位速率区间的分子数占总数的百分比 .
?.速率位于 区间的分子数为:v1?v2?N??Nf(v)dvv1v2 (50)
1 2?.速率位于 区间的分子数占总数的百分比为: v?v
v2?N(v1?v2)?S???f(v)dvv1N
? ④.N0dN???f(v)dv?1N0 曲线下包围的总面积表示整个速率区域内的
mv2
?2kT分子出现的概率应为1.
⑤.麦克斯韦速率分布函数:m2f(v)?4π()e2πkTv2
(51)
(气体确定,只与T有关),物理意义为速率在v附近单位速率区间内的分子出现的概率。
2)三个统计速率:
17
?.平均速率:
?v??0vdN
N???
0vf(v)dv (52a)
8kT8kTRT??1.60 v? ?m0?MM
(52b)
?.方均根速率:
?.最概然速率: 3kT3RTRTv???1.m0MM2 (53)
2kT2RTRTvp???1.m0MM (54)
(与分布函数f(v)的极大值相对应的速率)
④.三者的大小比较
v2?v?vp (55)
(五)气体分子的平均自由程碰撞频率
1)分子的平均碰撞速率:单位时间内一个分子与其他分子发生碰撞的平均速率,用Z表示。
2)单位时间的平均碰撞次数:
?πd2vn (理想情况) (56)
18
2?2πdn (实际上) (57)
3)平均自由程:分子与其他分子连续两次碰撞的之间自由通过的路程的平均值,用?表示。

?v?t?v
(58) Z
?v
Z?1
2?d2n
??kT
2?d2p (59) (60)
19
-
大学物理热学部分小结
大学物理热学部分小结通信工程4班胡素奎0706020xx5个人学习总结大学物理的热学部分还是相对不是太难的因为与高中的物理关联很大…
-
大学物理热学总结
大学物理热学总结热力学基础1体积压强和温度是描述气体宏观性质的三个状态参量温度表征系统热平衡时宏观状态的物理量摄氏温标t表示单位摄…
-
大学物理热学部分总结
专业通信工程班级09级四班姓名蒋双福学号0906020xx3教师朱卫华时间20xx101大学物理热学部分总结热力学基础一热力学的基…
-
大学物理热学读书心得
读《关于直接利用地球大气层中的热和冷的设想》有感作为工业革命标志的蒸汽机的发明将热的应用提到了一个新的高度。其中,热的获取的来源为…
-
大学物理热学第一章重点知识
第一章核心知识1热是一种状态是宏观物质的一种属性本质上热现象是物质中大量分子无规则运动的集体表现大量分子的无规则运动称为热运动它的…
-
大学物理课程总结
在大二上学期,我们学习了大学物理这门课程,物理学是一切自然科学的基础,处于诸多自然科学学科的核心地位,物理学研究的粒子和原子构成了…
-
大学物理热学题库
练习四热学一、填空题1.质量为M,摩尔质量为Mmol,分子数密度为n的理想气体,处于平衡态时,状态方程为___pV?M状态方程的另…
-
大学物理热学试题
热学(四)循环过程热二律专业班级学号姓名一、选择题1、一定量的某种理想气体起始温度为T,体积为V,该气体在下面循环过程中经过三个平…
-
大学物理热学读书心得
读《关于直接利用地球大气层中的热和冷的设想》有感作为工业革命标志的蒸汽机的发明将热的应用提到了一个新的高度。其中,热的获取的来源为…
-
0zxmqk大学物理热力学论文
-+懒惰是很奇怪的东西,它使你以为那是安逸,是休息,是福气;但实际上它所给你的是无聊,是倦怠,是消沉;它剥夺你对前途的希望,割断你…