生物化学实验报告
生物化学实验报告
供检验护理专业使用
班级
姓名
郑 州 大 学 护 理 学 院
实验一 血清蛋白质醋酸纤维薄膜电泳
[目的]
[原理]
[仪器组成]
[操作与结果]
[结果粘贴]
实验二 酶的特异性
[目的]
[原理]
[操作与结果]
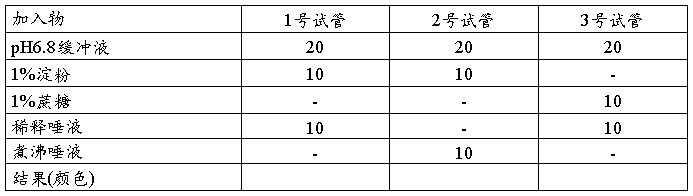
将以上1、2、3号试管置于37℃水浴箱保温10分钟。然后向各管中加班氏试剂20滴,沸水中煮沸10分钟,取出勿振摇试管,观察结果并记录。
[分析]三管结果及原因。
实验三 温度、pH、激活剂、抑制剂
对酶反应的影响
[目的]
[原理]
[操作与结果]
(一)温度对酶反应的影响

[分析各管的颜色变化原因]
(二)pH对酶反应的影响
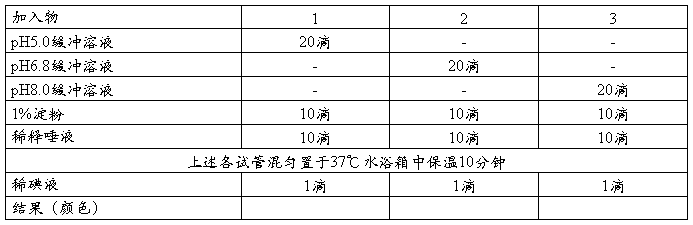
[分析各管的颜色变化原因]
(三)激活剂、抑制剂对酶反应的影响
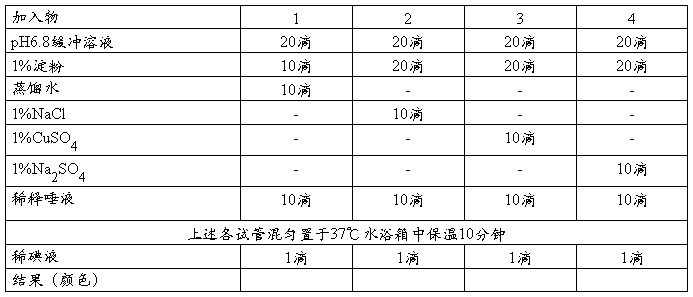
[分析各管的颜色变化原因]
实验四 721型分光光度计的使用
[目的]
[原理]
[构造]
[使用]
实验五 血清葡萄糖的测定
[目的]
[原理]
[操作]
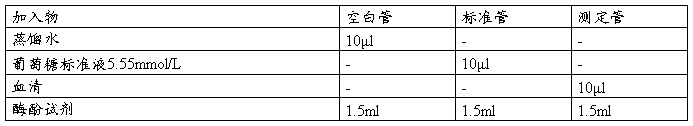
将上述各管混匀,置于37℃水浴箱中保温15分钟,取出分别倒入0.5cm的比色杯中,选择波长λ=505nm,用空白管调节“0”及“100”,分别读取标准管及测定管的吸光度
A标、A测。
[计算]
[临床意义]
实验六 琥珀酸脱氢酶的作用及抑制
[目的]
[原理]
[操作]取三支试管按下表操作
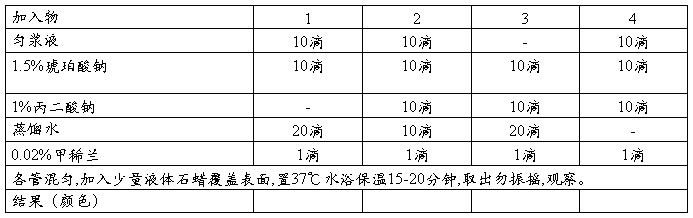
[思考]
1、液体石蜡起什么作用?
2、各管颜色变化的原因?
实验七 肝脏中酮体的生成作用
[目的]
[原理]
[操作]
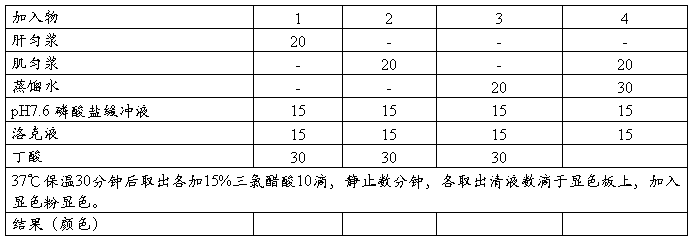
[分析各管颜色变化的原因]
实验八 血浆CO2CP测定
[目的]
[原理]
[操作]
[计算]
[意义]
实验九 血清谷丙转氨酶测定
[目的]
[原理]
[操作]

将空白管、测定管分别混匀,置入37℃水浴箱保温30分钟,取出加入2.4二硝基笨肼的盐酸溶液各0.5ml混匀后再置入37℃水浴保温20分钟。取出加入0.4M的NaOH5ml,混匀。
选择波长λ=505nm,用空白管调节“0”及“100”,读取测定管的吸光度A测。查标准曲线。
[结果]
[意义]
实验十 血清钾、钠测定
[目的]
[原理]
[操作]
1、钠测定
计算
2、钾测定
计算
[思考题]血清K+、Na+ 测定有何临床意义?
第二篇:生物化学实验报告论文
生物化学实验报告论文
班级:质量121
学号:20120844119
姓名:张瑶瑶
一、前言
生物化学是一门联系生物和化学的一门科学学科,学习生物化学可以提高我们严谨的科学分析以及熟练的实验操作,本文主要讲了金黄色葡萄球菌核糖核酸酶的分离实验,金黄色葡萄球菌是人类的一种重要病原菌,属于葡萄球菌属,可引起许多严重污染,本文主要通过 核酸酶活性的测定,考马斯亮蓝法测定蛋白质溶液浓度,DEAE-纤维素的处理及装柱,蛋白质亚基分子量测定SDS-PAGE凝胶电泳
二、实验材料准备
共分为四组,了解实验目的、方案 、原理 。
2.1、取已配制好的金黄色葡萄球菌于离心管内,8000 rpm离心除掉菌体,保留上清(留1-2ml,p1),用作后续实验。
2.2 、将锥形瓶中的金黄色葡萄球菌液体放到沸水中煮30分钟,10000rpm 离心,保留上清液(留1-2ml,p2),用作后续实验。
2.3、将离心好的上清液取60ml进行75%硫酸铵饱和度沉淀实验,放置离心管,配平后4度冰箱中放置24小时。将硫酸铵沉淀液10000rpm离心,去上清,保留沉淀,缓冲液洗涤,方法是在第一支离心管中加入2ml缓冲液混匀倒入第二支离心管中,再取2ml于第一支离心管中洗一次,再倒入第二支离心管中,最后在第二支离心管中再加入2ml缓冲液。终体积为6ml(留0.5ml,p3)。
2.4、DEAE-纤维素的处理及装柱
2.4.1、处理
本实验采用的是DEAE-纤维素DE52是弱酸型阴离子交换剂,具体处理方法为:先将DE52阴离子交换剂干粉浸泡于蒸馏水中,去除杂质;再在0.5N的Hcl溶液中浸泡1h,再用无离子水或蒸馏水洗至pH4以上,并将其在抽滤中抽干;将抽干的离子交换剂浸在0.5N的
NaOH溶液中1h,再用无离子水或蒸馏水将其洗至中性。
2.4.2、装柱
将层析柱清洗干净垂直固定到层析架上,加1/3体积的无离子水,打开下出液口,水流畅通,即刻将小烧杯中装有适宜浓度的柱才,轻轻倒入层析柱中,凝胶自然慢慢沉降在层析柱底部;凝胶沉积至高度10cm处,停止装柱;夹上止液夹。
2.4.3、平衡
在柱层析上样前必须对层析柱进行平衡,将平衡缓冲液泵入到层析柱内,打开层析柱下端的出口,当下出口流出液的PH值与平衡缓冲液的PH值一致时(大于50ml平衡液),层析柱达到了平衡。在本实验中,用0.001M Tris-HCl缓冲液PH9.0(内含0.0001M EDTA),预先将DE-52柱进行平衡。
2.5、上样
平衡液50ml用于收集,收集30-40ml即可。然后装入透析袋,PEG2包埋,浓缩。收集浓缩液p4-x;
2.6、透析袋预处理
新的透析袋在沸水中煮沸10min.即可进行透析。
三、核酸酶活性的测定
将甲苯胺蓝核酸琼脂溶化后,倒入平板中,凝固后,用直径为2mm的打孔器打孔,将琼脂取出,将待检酶液10ul,滴入孔中,置于加有湿棉纱的湿盒内,在37℃培养4h,阳性反应在孔的周围会出现1mm以上的粉红圈,测量粉红圈的直径。
四、 考马斯亮蓝法测定蛋白质浓度
4.1、实验原理
考马斯亮蓝能与蛋白质的疏水微区相结合,这种结合具有高度敏感性。考马斯亮蓝G250的磷酸溶液呈棕红色,最大吸收峰在465nm。当它与蛋白质结合形成复合物时呈蓝色,其最大吸收峰改变为595nm,考马斯亮G250-蛋白质复合物的高消光效应导致了蛋白质定量测定的高度敏感度。在一定范围内,考马斯亮蓝 G250-蛋白质复合物呈色后,在595nm下,吸光度与蛋白质含量呈线性关系,故可用于蛋白质浓度的测定。
4.2、实验仪器及用品
实验试剂:(1)水;(2)标准蛋白液:牛血清蛋白(0.1mg/ml);
(3)染液:考马斯亮蓝G250(0.01%),称取0.1g考马斯亮蓝G250 溶于50ml95%乙醇,再加入100ml浓磷酸,加蒸馏水定容到1000ml;(4)样品液:取牛血清白蛋白(0.1mg/ml)溶液,用0.9%NaCL稀释至一定浓度。
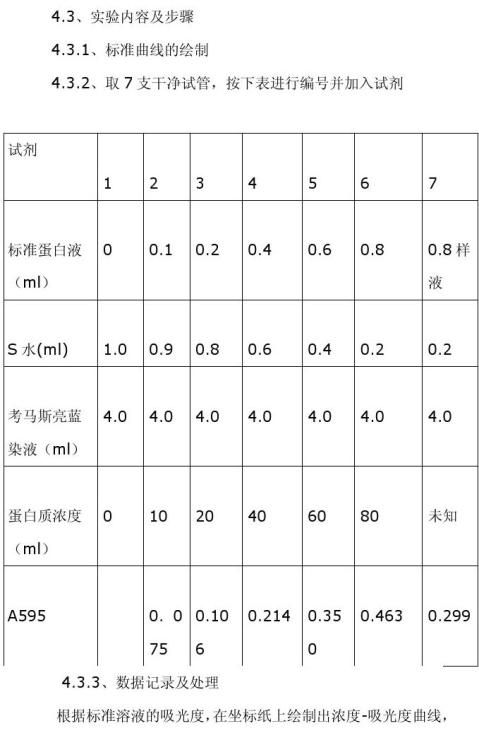
测出未知液的吸光度后,在标准曲线上查出未知液的浓度。
五、蛋白质亚基分子量测定SDS-PAGE凝胶电泳
5.1目的
掌握SDS-PAGE凝胶电泳测定蛋白质亚基分子量的基本原理和操作方法
5. 2、 原理
SDS是一种阴离子去污剂,作为变性剂和助溶性试剂,能断裂分子内和分子间的氢键,使分子去折叠,破坏蛋白质分子的二级,三级结构;而强还原剂,如二硫苏糖醇,β-巯基乙醇能使半胱氨酸残基之间的二硫键断裂。因此,在样品和凝胶中加入SDS和还原剂后,蛋白质分子被解聚为组成它们的多肽链,解聚后的氨基酸侧链与SDS结合后,形成带负电的蛋白质-SDS胶束,所带电荷远远超过了蛋白质原有的电荷量,消除了不同分子间的电荷差异;同时,蛋白质-SDS聚合体的形状也基本相同,这就消除了在电泳过程中分子形状对迁移率的影响。
5. 3、试剂和器材
试剂:1低分子量标准蛋白质 2待测 蛋白质样品 3凝胶贮液:30克丙烯酰胺,0.8克甲叉双丙烯酰胺,溶于100ml蒸馏水中,过滤,于4℃暗处储藏,一个月内使用 4:1mol╱l,ph8.8tris-HCl缓冲液,tris12.1g溶于蒸馏水,用浓盐酸调至PH8.8,以蒸馏水定容至100ml 5:10%(w╱v)SDS 6:10%(w╱v)过硫酸铵溶液(当天配) 7:四甲基乙二胺(TEMED) 8:电极缓冲液
PH8.3:Tris30.3g,甘氨酸144.2g,SDS10g,溶于蒸馏水并定容至1000ml,使用时稀释十倍 9:样品稀释液:SDS500mg,巯基乙醇1ml,甘油3ml,溴酚蓝4mg,1mol╱lTris-HCL(pH6.8),用蒸馏水溶解并定容至10ml,按每份1ml分装,可在4℃存放数周,或在-20℃保存数月。以此液制备样品时,样品若为液体,则加入与阳平等体积的原液混合即可。10 固定液:500ml乙醇,100ml冰醋酸,用蒸馏水定容至1000ml 11脱色液:250ml乙醇,80ml冰醋酸,用蒸馏水定容至1000ml 12染色液:0.29g考马斯亮蓝R-250溶解在250ml脱色液中
器材:微量进样针,电泳仪,电泳
槽 5. 4操作步骤
5.4.1分离胶制备:
凝胶浓度12.5%,凝胶贮液12.5ml,Tris-HCLPH8.81mol╱L11.2ml,水8.7ml,10%SDS0.3ml,10%过硫酸胺0.1ml,TEMED20μL
将上述胶液配好,混匀后,迅速加入两块玻璃板间隙中,使胶液面与矮玻璃和高玻璃之间形成凹槽处处平齐,而后插入“加样梳”,在室温下放置1小时左右,分离胶即可完全凝集。凝聚后,慢慢取出“加样梳”,取出时应防止把加样孔弄破,取出“加样梳”后,在形成的加样孔中加入蒸馏水,冲洗未凝集的丙烯酰胺,倒出加样孔中的蒸馏水后,在加入已稀释的电极缓冲液。
5.4.2 样品制备:
标准蛋白质制备,待测蛋白样品制备:
液体待测样品,可取500μL,加入等体积的“2×样品稀释液”,混匀,在沸水浴中加热5min,取出,冷却至室温备用。若液体待测样品蛋白质浓度太稀可经浓缩后再制备。
5.4.3,点样
用微量进样针吸取上述蛋白质样品20μl分别加入到各个加样孔中,为了获得准确的结果,每个样品应做两次重复。
5.4.4,电泳
将电泳槽与电泳仪连结,在电泳槽中加入已经稀释的电极缓冲液,打开电源,选择合适电压,保持恒电压300v,进行电泳,直至样品中燃料迁移至离下端1cm处,停止。
5.4.5,固定,染色,脱色
将凝胶浸入考马斯亮蓝染色液中,置摇床上缓慢震荡30min以上(染色时间需要根据凝胶厚度适当调整)。取出凝胶在水中漂洗数次,再加入考马斯亮蓝脱色液,震荡。凝胶脱色至大致看清条带约需1h,完全脱色则需要更换脱色液2-3次,震荡达24h以上。凝胶脱色后可经过扫描、摄录等方法进行蛋白质定量检测。
六、结果分析及讨论
6.1、核酸酶活性的测定的结果分析
P1:粉红圈内直径6.4mm ,外直径19.6mm
P2:粉红圈内直径6.6mm,外直径19.8mm
p3:粉红圈内直径6.8mm,外直径20.00mm
由上表可知0.8ml样液,即金黄色葡萄球菌核糖核酸酶的蛋白质的浓度为0.5712*0.299+0.0017=0.1725(ug每ml)。
6.3、讨论结果及注意事项
利用考马斯亮蓝法分析蛋白质必须要掌握好分光光度计的正确
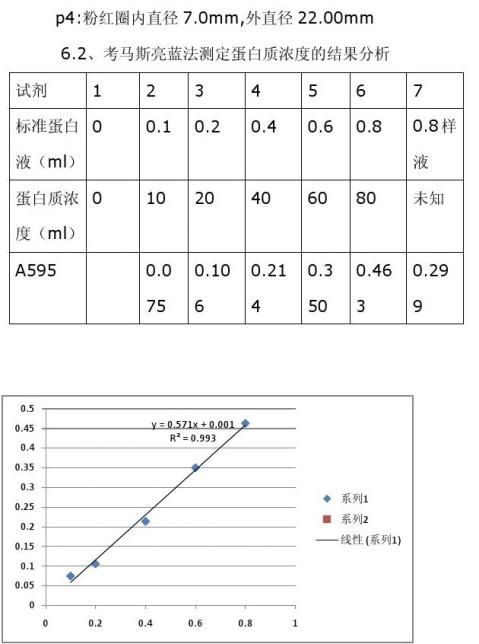
使用,重复测定吸光度时,比色杯一定要冲洗干净,制作蛋白标准曲线的时候,蛋白标准品最好是从低浓度到高浓度,防止误差。
-
生物化学实验报告
20xx年生物化学实验B姓名学号实验时间实验分组组内成员任课教师实验报告XXXX20xx年11月17日摘要本实验通过从小牛肠中通过…
-
生化实验报告4
生物化学实验报告纤维素酶活力的测定还原糖的测定35二硝基水杨酸法刘欣怡20xx0014005720xx级生物基地班周一下午同组者刘…
-
生物化学实验报告
实验一考马斯亮蓝G250染色法测定蛋白质的含量p24一目的要求掌握考马斯亮蓝CoomassieBrilliantBlue法测定蛋白…
-
生物化学综合实验报告
存车处生物化学综合实验实验报告项目名称核酸的分离纯化及性质研究指导教师商亚芳班级食品科学与工程类1304班姓名俞海清学号20xx2…
-
生物化学实验记录和实验报告的书写
第二节实验记录和实验报告的书写正确记录实验过程及书写实验报告是训练学生进行正规实验训练的重要内容实验是在理论指导下的科学实践目的在…
-
生物化学实验报告格式
《生物化学实验》实验报告本专业班级姓名学号目录实验一基本操作实验二血糖测定实验三血清谷丙转氨酶的测定实验四血清蛋白醋酸纤维薄膜电泳…
-
20xx生物化学实验报告册模板
生物化学实验报告姓名:张三学号:20xx000000001专业年级:20xx级生物技术组别:第五实验室生物化学与分子生物学实验教学…
-
大学生物化学实验报告标准格式汇总
生物化学实验报告班级姓名实验一血清蛋白质醋酸纤维薄膜电泳目的原理仪器组成操作与结果结果粘贴实验二酶的特异性目的原理操作与结果将以上…
-
生物化学实验报告册模板
生物化学实验报告姓名学号20xx000000001专业年级20xx级生物技术组别第五实验室生物化学与分子生物学实验教学中心一实验室…
-
生物化学实验记录和实验报告的书写
第二节实验记录和实验报告的书写正确记录实验过程及书写实验报告是训练学生进行正规实验训练的重要内容实验是在理论指导下的科学实践目的在…
-
生化实验总结
生化实验总结姓名:李梦华系年级:20xx级生科三班组别:55科目:生物化学实验题目:生化试验总结学号:20xx00140051指缝…