生物化学实验报告
20##年生物化学实验B
实验报告
姓 名: XXXX
学 号: XXXXXX
实验时间: 20##年11月17日
实验分组: 第7组
组内成员: XXXXXXXXXXX
XXXXXXXXXXX
任课教师: XXXX
摘要
本实验通过从小牛肠中通过刮去,离心,析出等方式提取小牛肠碱性磷酸酶,再通过SDS-聚丙烯凝胶电泳测定蛋白质相对分子量,利用考马斯亮蓝法测定蛋白质含量及测定酶的活性。
1.实验部分
1.1试剂与仪器
1.试剂:
(1)正丁醇、丙酮。
(2)1 mol/L 醋酸,1 mol/L NaOH,硫酸铵。
(3)平衡缓冲液:0.01 mol/L Tris-HCl,pH 8.0。
(4)底物缓冲液:1 mol/L 二乙醇胺-盐酸缓冲液。
(5)酶的底物溶液:用底物缓冲液配制15×10-3 mol/L 对硝基苯磷酸二钠溶液。
(6)30% 丙烯酰胺置棕色瓶。
(7)分离胶缓冲液:1.5 mol/L Tris-HCl缓冲液,pH 8.8,已加入10% SDS。
(8)浓缩胶缓冲液:0.5 mol/L Tris-HCl缓冲液,pH 6.8,已加入10% SDS。
(9)10% 过硫酸铵。
(10)TEMED(四甲基乙二胺)。
(11)上样缓冲液:称100 mg SDS、2 mg溴酚蓝、2 g甘油,加0.1 mL巯基乙醇、2 mL 0.05mol/L pH 8.0 Tris-HCl,加超纯水定容至10 mL。
(12)染色液:配置含0.1% 考马斯亮蓝R250,40%甲醇和10%冰醋酸的染色液500 mL,过滤后备用。
(13)脱色液:500 mL 10%甲醇和10%冰醋酸的脱色液1000 mL。
(14)电泳缓冲液。
2.仪器
匀浆机、eppebdorf5型冷冻离心机、GSY—2型恒温水浴、UV762型紫外可见分光光度计。离心管,剪刀,载玻片,不锈钢盘,搪瓷盘,滤布,漏斗,分液漏斗,量筒,烧杯,移液抢,比色皿,DYY—11型电泳仪,24D型电泳槽,制胶板,揺床,移液枪。
1.2 小牛肠碱性磷酸酶提取方法
1)取新鲜小牛肠,用剪刀剖开,用载玻片刮取小肠内粘膜,放到盘子一角。
2)将小肠粘膜液集中倒入匀浆机中,加冰冷蒸馏水,高速匀浆,重复多次。
3)缓慢加入冰冷正丁醇高速匀浆重复多次。在4℃,10000 rpm条件下离心。
4)用滤布过滤去除杂质,倒入分液漏斗中,静止分层,取下层水相,用HAc溶液调pH到4.9。4℃,10000 rpm,离心。
5)得到上清后放入离心管中,用NaOH溶液调pH至6.5,称取硫酸铵加到离心管中溶解;再加冰冷丙酮,混匀,4℃静置30 min以上。4℃,10000 rpm,离心。
6)上清液中加入冰冷丙酮,4℃放置30 min以上。4℃,10000 rpm,离心。
7)取沉淀溶于平衡缓冲液至全部溶解至冰箱保存待用。
8)底物处理:底物37℃水浴5 min。
1.3 小牛肠碱性磷酸酶酶活检测方法
1)将酶稀释10倍。
2)紫外分光光度计检测条件为405 nm波长,测定时间60 s,取值2 s,记录范围0.0-1.5。3)取2个2 mL比色皿,加入上述(2)加热的底物缓冲液,校对归零。
4)将稀释10倍的酶液加到其中1个比色皿中(仪器外侧),用手堵住皿口。快速上下倒2次,放回分光光度计中,测定酶动力学曲线
1.4 聚丙烯凝胶制备
1)装板:将垂直板型电泳的玻璃片洗净、晾干;放好胶条,用夹子夹好玻璃板,上面插上梳子,垂直放置在水平台面上备用。
2)制备分离胶:在小烧杯中按下表配制所需浓度的分离胶。
 3)制备浓缩胶:在小烧杯中按下表配制所需浓度的浓缩胶。
3)制备浓缩胶:在小烧杯中按下表配制所需浓度的浓缩胶。

4)蛋白样品处理:在1.5 mL离心管中按1:1体积比例,加样品和上样缓冲液,100°C加热使蛋白变性。
5)浓缩胶完全聚合后,去掉夹子和胶条,拔去梳子,将凝胶玻璃板固定于电泳装置内槽上,加入电泳缓冲液,缓冲液高过玻璃板凹面。
1.5 考马斯亮蓝法测定蛋白质含量
1)玻璃试管中加入考马斯亮蓝。
2)在1.5 mL离心管中,取酶液分别稀释50、100、200倍。
3)各取100 μL加入到5 mL考马斯亮蓝试管中,混匀,反应5 min以上。
4)紫外分光光度计检测条件:595 nm 波长。
5)取2个比色皿,加入考马斯亮蓝,分光光度计中校对归零。
6)将样品放入外侧比色皿中,读吸光值。
7)根据蛋白浓度标准曲线,计算酶蛋白浓度。
1.6 SDS-聚丙烯凝胶电泳测定蛋白质相对分子量
1)用移液枪依次在泳道加样。
2)电泳:连接正、负极,待溴酚兰指示剂迁移至下沿处,停止电泳。
3)剥胶染色:电泳结束后,取出凝胶玻璃板,用水冲洗,将剥离下来的凝胶用水漂洗,转入染色缸中,加染色液,置摇床染色。
4)脱色:染色完毕,回收染色液,用水漂洗,加入脱色液,置摇床脱色,脱色至背景清晰。
5)观察测定蛋白的迁移率及条带,对照标准样品,分析蛋白样品的分子量及纯度。
6)拍照电泳结果,用于完成实验报告。
2. 结果与讨论
2.1小牛肠碱性磷酸酶酶活检测
 根据酶动力计算公式:
根据酶动力计算公式:
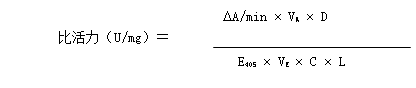
根据上图,DA/min=3.5/min;
VR=1.50002ml;
D=10;
E405=18.3L/(mol*cm);
VE=0.00002ml;
C=19.35mg/ml.
L=0.5cm;
所以比活力(U/mg)= U/mg;
U/mg;
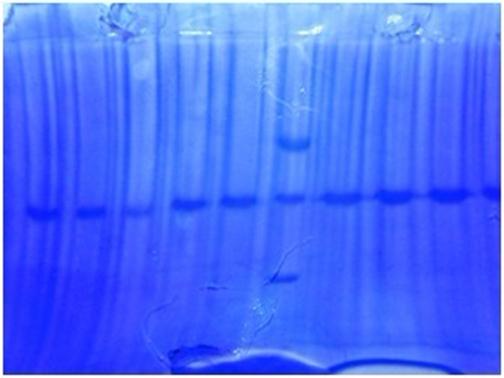 2.2 SDS-聚丙烯凝胶电泳
2.2 SDS-聚丙烯凝胶电泳
分析知,mark中出现了三条蛋白质标记线,根据其间距及参考文献中给出的mark泳道各条蛋白质标记线间距,可判定由上到下mark泳道中的三条蛋白质标记线分别是兔磷酸化酶B,牛血清白蛋白,兔肌动蛋白。样品蛋白质标记线与牛血清白蛋白迁移率相近,所以样品的分子量与牛血清白蛋白分子量相近,所以样品的分子量大致为66,200/mol.
2.3考马斯亮蓝法测定蛋白质含量
根据考马斯亮蓝常量法测蛋白质标准曲线,其方程为:y=0.697x-0.007;
蛋白质稀释50倍的情况下测得吸光值为0.2625,根据方程,稀释50倍时蛋白质浓度C=0.387mg/ml,则原蛋白质浓度C=19.35mg/ml。
2.4小牛肠碱性磷酸酶的提纯及酶活测定一些问题的讨论
1、测定底物浓度对酶反应速度的影响时,对酶反应的哪些条件要加以控制?本实验所取的条件是什么?
答:要对反应温度,酶浓度进行控制,本实验中反应温度为37℃,酶浓度为在原来酶浓度的基础上稀释10倍。
2、为什么实验中能以平均速度表示反应的瞬时速度?
答:因为酶催化的反应速率与底物浓度有关,本实验中底物远远过量,所以可以以平均速度表示反应的瞬时速度。
3、你认为实验中的关键步骤或值得注意的步骤是什么?
答:最关键的地方在于提取酶的时候要在低温环境下,免得酶失活,另外,测定酶活力的时候底物预热后要立即进行反应,防止底物提前分解影响实验结果。
4、本次实验的感受是什么?
答:本实验要细心,每个步骤都要认真搞懂原理的情况下再操作,免得破坏酶的活性影响实验结果。
2.5 SDS-PAGE电泳法测定蛋白质相对分子质量一些问题的讨论
1、用SDS-聚丙烯酰胺凝胶电泳法测定蛋白质相对分子质量时为什么要用巯基乙醇?
答:保持蛋白质的二级结构。蛋白中如果有二硫键存在的话,会容易被氧化断开,有了巯基乙醇(还原性的物质)就可以免除这一隐患
2、SDS在该电泳方法中的作用是什么?
答:在SDS-聚丙烯酰胺凝胶电泳中,加入一定量的十二烷基硫酸钠(SDS),形成蛋白质-SDS复合物,使蛋白质丧失了原有的电荷状态,形成了仅保持原有分子大小为特征的负离子团块,从而降低或消除了各种蛋白质分子之间的天然的电荷差异,此时,蛋白质分子的电泳迁移率主要取决于蛋白质的分子量大小,而其它因素对电泳迁移率的影响几乎可以忽略不计。根据标准样品在该系统电泳中所作出的标准曲线,推算出被测蛋白样品分子量的近似值。
3、分析自己实验的成败原因。
答:本实验中我们组的mark样品只有三条标记线,是分子量最多的三条,说明分子量小的蛋白质电泳进行得快,超出了凝胶的范围,所以没有在图像上有所体现。原因是电泳时间过长或电压过大造成的,因此应该适当减少电泳的时间或减少,免得分子量小的蛋白质“跑过头”。
参考文献:
[1]修志龙等.生物化学[M].化学工业出版社.2008.
[2]许文涛等.SDS-聚丙烯酰胺凝胶电泳快速染脱色方法的比较研究.食品科学[J]. 2004,Vol.25.No.增
{3}孙士青等.考马斯亮蓝法快速测定乳品中蛋白质含量.山东科学[J].2011.24(6)
[4]栾雨时, 包永明..生物工程实验技术手册[M].化学工业出版社.2005
第二篇:生物化学实验报告137030032
孝感学院生命科学技术学院实验报告



 专业: 学号: 姓名: 分数:
专业: 学号: 姓名: 分数:
 实验二 油脂酸价的测定
实验二 油脂酸价的测定
一、目的与要求
初步掌握测定油脂酸价的原理和方法;了解测定油脂酸价的意义。
二、实验原理
油脂在空气中暴露过久,部分油脂会被水解产生游离脂肪酸和醛等物质,并且这些物质具有刺激性气味,使油脂产生酸价。酸败的程度使以水解产生的游离脂肪酸的多少为指标的,常以酸价或者是酸值来表示。同一油脂若酸价高,则说明水解产生的游离脂肪酸就多。
酸价是指中和1g油脂中游离脂肪酸所需的氢氧化钾的毫克数。酸价越高,油脂的质量也越差。
三、主要仪器、实验材料和试剂
1. 锥形瓶(250 mL)3个; 2. 量筒(50 mL)1支;3. 碱式滴定管1支;4. 花生油、菜油、芝麻油等;5. 乙醇-乙醚混合液(1:1,V/V);6. 0.1 % KOH(1克KOH溶于1000 mL纯水中)。
四、操作步骤
1. 准确称取1~2 g油脂于250 mL锥形瓶中。
2. 在瓶内加入乙醇-乙醚混合液50 mL,充分振荡,使油脂样品完全溶解成透明溶液。
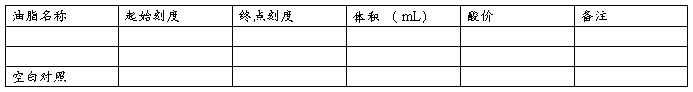
待油样完全溶解后,加入1%酚酞指示剂3~5滴,立即用0.1% KOH标准溶液滴定至溶液成微红色(放置30 S内不褪色)为终点,并记录用去的KOH的体积,并按下式进行计算。
酸价=2(V2-V1)/W
V2 :滴定油样时耗用氢氧化钾溶液的毫升数
V1 :滴定空白对照耗用氢氧化钾溶液的毫升数
W:油样重(g)
注:滴定过程中如出现混浊或分层,表明由碱液带进水过多,乙醇量不足以使乙醚与碱溶液互溶。一旦出现此现象,可补加乙醇,促使均一相体系的形成。
五、实验结果
六、思考题
请对你的实验结果进行分析。
 批阅教师: 年 月 日
批阅教师: 年 月 日
孝感学院生命科学技术学院实验报告



 专业: 学号: 姓名: 分数:
专业: 学号: 姓名: 分数:
 实验三蛋白质的提取及浓度测定(紫外吸收法)
实验三蛋白质的提取及浓度测定(紫外吸收法)
一、目的与要求
掌握蛋白质的提取方法;学习紫外分光光度法测定蛋白质含量的原理;熟练掌握紫外分光光度计的使用方法。
二、实验原理
大部分蛋白质都可溶于水、稀盐、稀酸或碱溶液,少数与脂类结合的蛋白质则溶于乙醇、丙酮、丁醇等有机溶剂中,因些,可采用不同溶剂提取分离和纯化蛋白质及酶。
由于蛋白质中存在着含有共轭双键的酪氨酸和色氨酸,因此蛋白质具有吸收紫外光的性质,最大吸收峰在280 nm波长处。在此波长范围内,蛋白质溶液的光密度OD280nm与其浓度呈正比关系,可作定量测定。
三、实验材料、主要仪器和试剂
1. 试验材料:萌发3天的小麦种子
2. 主要仪器
(1)紫外分光光度计,(2)离心机(3)试管与试管架,(4)刻度吸量管 (5)研钵 (6)100 mL容量瓶
3.试剂:标准牛血清蛋白溶液:准确称取经凯氏定氮法校正的结晶牛血清蛋白,配制成浓度为1mg/ mL(0.5克标准牛血清蛋白纯水定容至500 mL)的溶液。
四、操作步骤
1.蛋白质(淀粉酶)的提取
称取1g萌发3天的小麦种子(芽长约1cm),置于研钵中,加入少量石英砂和2 mL蒸馏水,研磨匀浆。将匀浆倒入离心管中,用6 mL蒸馏水分次将残渣洗入离心管。提取液在室温下放置提取15~20 min,每隔数分钟搅动1次,使其充分提取。然后在3,000 r/min转速下离心10 min,将上清液倒入100 mL容量瓶中,加蒸馏水定容至刻度,摇匀,即为蛋白质原液,用于蛋白质浓度的测定。
2. 标准曲线制作
按表1分别向每支试管内加入各种试剂,混匀。以光程为1 cm的石英比色杯,在280 nm波长处测定各管溶液的光密度值OD280nm。以蛋白质浓度为横坐标,光密度值为纵坐标,绘出标准曲线。
 批阅教师: 年 月 日
批阅教师: 年 月 日
表1 蛋白质标准曲线制作


3.样品测定
取提取的蛋白质溶液,按上述方法测定280 nm的光密度,并从标准工作曲线上查出提取蛋白质溶液的浓度。若提取蛋白质溶液的浓度大于2.0,超出测量范围,则稀释后再测,计算蛋白质浓度时乘以稀释倍数。
蛋白质浓度=
五、思考题
1. 为何要在280 nm波长下测定蛋白质浓度?在其它波长下测定可以吗?
2. 如果考虑核酸的存在,蛋白质浓度的实际的值比测量值是大还是小?为什么?
孝感学院生命科学技术学院实验报告



 专业: 学号: 姓名: 分数:
专业: 学号: 姓名: 分数:
 实验四淀粉酶活力的测定
实验四淀粉酶活力的测定
一、目的与要求
学习和掌握测定淀粉酶(包括α-淀粉酶和β-淀粉酶)活力的原理和方法。
二、实验原理
淀粉是植物最主要的贮藏多糖,也是人和动物的重要食物和发酵工业的基本原料。淀粉经淀粉酶作用后生成葡萄糖、麦芽糖等小分子物质而被机体利用。淀粉酶主要包括α-淀粉酶和β-淀粉酶两种。α-淀粉酶可随机地作用于淀粉中的α-1,4-糖苷键,生成葡萄糖、麦芽糖、麦芽三糖、糊精等还原糖,同时使淀粉的粘度降低,因此又称为液化酶。β-淀粉酶可从淀粉的非还原性末端进行水解,每次水解下一分子麦芽糖,又被称为糖化酶。淀粉酶催化产生的这些还原糖能使3,5-二硝基水杨酸还原,生成棕红色的3-氨基-5-硝基水杨酸。
淀粉酶活力的大小与产生的还原糖的量成正比。用标准浓度的麦芽糖溶液制作标准曲线,用比色法测定淀粉酶作用于淀粉后生成的还原糖的量,以单位重量样品在一定时间内生成的麦芽糖的量表示酶活力。
淀粉酶存在于几乎所有植物中,特别是萌发后的禾谷类种子,淀粉酶活力最强,其中主要是α-淀粉酶和β-淀粉酶。两种淀粉酶特性不同,α-淀粉酶不耐酸,在pH3.6以下迅速钝化。β-淀粉酶不耐热,在70 ℃15min钝化。根据它们的这种特性,在测定活力时钝化其中之一,就可测出另一种淀粉酶的活力。本实验采用加热的方法钝化β-淀粉酶,测出α-淀粉酶的活力。在非钝化条件下测定淀粉酶总活力(α-淀粉酶活力+β-淀粉酶活力),再减去α-淀粉酶的活力,就可求出β-淀粉酶的活力。
三、实验材料、主要仪器和试剂
1.实验材料
萌发的小麦种子(芽长约1cm)
2.仪器
(1)离心机(2)离心管(3)研钵(4)电炉(5)容量瓶:50mL×1, 100mL×1
(6)恒温水浴(7)20mL具塞刻度试管×13(8)试管架(9)刻度吸管:2mL×3, 1mL×2, 10mL×1 (10)分光光度计
3.试剂(均为分析纯)
(1)标准麦芽糖溶液(1mg/mL):精确称取100mg麦芽糖,用蒸馏水溶解并定容至100mL。
(2)3,5-二硝基水杨酸试剂:精确称取3,5-二硝基水杨酸1g,溶于20 mL 2 mol/L NaOH溶液中,加入50 mL蒸馏水,再加入30 g酒石酸钾钠,待溶解后用蒸馏水定容至100 mL。盖紧瓶塞,勿使CO2进入。若溶液混浊可过滤后使用。
(3)0.1mol/L pH5.6的柠檬酸缓冲液
A液:(0.1mol/L 柠檬酸):称取C6H8O7·H2O 21.01g,用蒸馏水溶解并定容至1L。
B液:(0.1mol/L柠檬酸钠):称取Na3C6H5O7·2H2O 29.41g,用蒸馏水溶解并定容至1L。
取A液55mL与B液145mL混匀,既为0.1mol/LpH5.6的柠檬酸缓冲液。
(4)1%淀粉溶液:称取1g淀粉溶于100mL 0.1mol/L pH5.6的柠檬酸缓冲液中。
 批阅教师: 年 月 日
批阅教师: 年 月 日
四、操作步骤
1.麦芽糖标准曲线的制作
取7支干净的具塞刻度试管,编号,按表1加入试剂:
表1 麦芽糖标准曲线制作
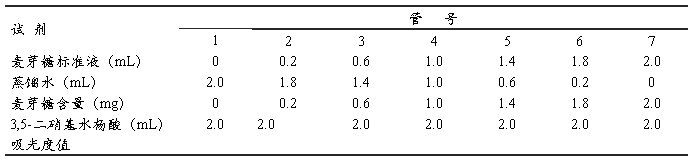
摇匀,置沸水浴中煮沸5 min。取出后流水冷却,加蒸馏水定容至20 mL。以1号管作为空白调零点,在540 nm波长下比色测定光密度。以麦芽糖含量为横坐标,光密度为纵坐标,绘制标准曲线。

2.淀粉酶液的制备
称取1g萌发3天的小麦种子(芽长约1 cm),置于研钵中,加入少量石英砂和2 mL蒸馏水,研磨匀浆。将匀浆倒入离心管中,用6 mL蒸馏水分次将残渣洗入离心管。提取液在室温下放置提取15~20 min,每隔数分钟搅动1次,使其充分提取。然后在3 000r/min转速下离心10min,将上清液倒入100 mL容量瓶中,加蒸馏水定容至刻度,摇匀,即为淀粉酶原液,用于α-淀粉酶活力测定。
吸取上述淀粉酶原液10 mL,放入50 mL容量瓶中,用蒸馏水定容至刻度,摇匀,即为淀粉酶稀释液,用于淀粉酶总活力的测定。
3.酶活力的测定:取6支干净的试管,编号,按表2进行操作。
表2 酶活力测定取样表

将各试管摇匀,置沸水浴中煮沸5 min。取出后流水冷却,加蒸馏水定容至20 mL。以1号管(做标准曲线时用过的)作为空白调零点,在540 nm波长下比色测定光密度,记录测定结果。
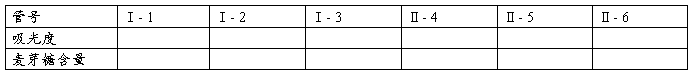
五、结果计算
计算Ⅰ- 2、Ⅰ- 3光密度平均值与Ⅰ- 1光密度之差,在标准曲线上查出相应的麦芽糖含量(mg),按下列公式计算α- 淀粉酶的活力。

=
计算Ⅱ- 5、Ⅱ- 6光密度平均值与Ⅱ- 4光密度之差,在标准曲线上查出相应的麦芽糖含量(mg),按下式计算(α+β)淀粉酶总活力(单位同上)。

(α+β)淀粉酶总活力
=
β-淀粉酶活力=(α+β)淀粉酶总活力-α-淀粉酶活力=
六、思考题
1.为什么要将Ⅰ- 1、Ⅰ- 2、Ⅰ- 3号试管中的淀粉酶原液置70 ℃水浴中保温15min?
2.为什么要将各试管中的淀粉酶原液和1%淀粉溶液分别置于40 ℃水浴中保温?
孝感学院生命科学技术学院实验报告



 专业: 学号: 姓名: 分数:
专业: 学号: 姓名: 分数:
 实验五 醋酸纤维薄膜电泳法分离血清蛋白质
实验五 醋酸纤维薄膜电泳法分离血清蛋白质
一、目的
学习醋酸纤维薄膜电泳的操作,了解电泳技术的一般原理。
二、原理
带电质点在电场中移动的现象称为电泳。电泳有很多类型,如,纸电泳、醋酸纤维薄膜电泳、纤维素或淀粉粉末电泳、淀粉凝胶电泳、琼脂糖凝胶电泳、聚丙烯酰胺凝胶电泳等。
任何一种物质的质点,由于其本身在溶液中的解离或由于其表面对其他带电质点的吸附,会在电场中向一定的电极移动。例如,氨基酸、蛋白质、酶、激素、核酸及其衍生物等物质都具有许多可解离的酸性和碱性基团,它们在溶液中会解离而带电。
不同的质点在同一电场中泳动速度不同,据此可将不同带电物质分开。
醋酸纤维薄膜电泳是用醋酸纤维薄膜作为支持物的电泳方法。
醋酸纤维薄膜由二乙酸纤维素制成,它具有均一的泡沫样的结构,厚度仅120微米,有强渗透性,对分子移动无阻力,作为区带电泳的支持物进行蛋白电泳有简便、快速、样品用量少、应用范围广、分离清晰、没有吸附现象等优点。目前已广泛用于血清蛋白、脂蛋白、血红蛋白和同功酶的分离及用在免疫电泳中。
三、器材及试剂
1.器材:

2.试剂:
①巴比妥缓冲液(PH8.6):巴比妥2.76克,巴比妥纳15.45克,加水至1000毫升。
②染色液:氨基黑10B 0.25克,甲醇50毫升,冰醋酸10毫升,水40毫升(可重复用)。
③漂洗液:含甲醇或乙醇45毫升,冰醋酸5毫升,水50毫升。
④透明液:含无水乙醇7份,冰醋酸3份。
四、操作步骤
1.浸泡:用镊子取醋酸纤维薄膜1张(识别出光泽面与无光泽面,并在无光泽面角上用铅笔做上记号)放在缓冲液中浸泡20分钟。
2.点样:把膜条从缓冲液中取出,夹在两层粗滤纸内吸干多余的液体,然后平铺在玻璃板上(无光泽面朝上),将点样器先在白磁板上的血清中沾一下,再在膜条一端2—3厘米处轻轻地水平落下并随即提起,这样即在膜条上点上了细条状的血清样品。
 批阅教师: 年 月 日
批阅教师: 年 月 日

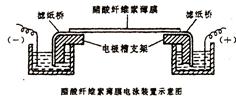 3.电泳:在电泳槽内加入缓冲液,使两个电极槽内的液面等高,将膜条平悬于电泳槽支架的滤纸桥上。(先剪裁尺寸合适的滤纸条,取双层滤纸条附着在电泳槽的支架上,使它的一端与支架的前沿对齐,而另一端浸入电极槽的缓冲液内。用缓冲液将滤纸全部润湿并驱除气泡,使滤纸紧贴在支架上,即为滤纸桥。它是联系醋酸纤维薄膜和两极缓冲液之间的“桥梁”。)膜条上点样的一端靠近负极。盖严电泳室。通电。调节电压至160V,电流强度0.4—0.7毫安/厘米膜宽,电泳时间约为60分钟。
3.电泳:在电泳槽内加入缓冲液,使两个电极槽内的液面等高,将膜条平悬于电泳槽支架的滤纸桥上。(先剪裁尺寸合适的滤纸条,取双层滤纸条附着在电泳槽的支架上,使它的一端与支架的前沿对齐,而另一端浸入电极槽的缓冲液内。用缓冲液将滤纸全部润湿并驱除气泡,使滤纸紧贴在支架上,即为滤纸桥。它是联系醋酸纤维薄膜和两极缓冲液之间的“桥梁”。)膜条上点样的一端靠近负极。盖严电泳室。通电。调节电压至160V,电流强度0.4—0.7毫安/厘米膜宽,电泳时间约为60分钟。
4.染色:电泳完毕后将膜条取下并放在染色液中浸泡10分钟。
5.漂洗:将膜条从染色液中取出,置漂洗液中漂洗数次至无蛋白区底色脱净为止,可得色带 清晰的电泳图谱。
清晰的电泳图谱。
6.定量(了解):有两种方法
(1)将上述漂净的薄膜用滤纸吸干,剪下各种蛋白质色带,分别浸于4.0ml 0.4mol·L-1NaOH溶液中(37℃)5—10分钟,色泽浸出后,比色(590nm)。设各部分的光密度分别为:OD白、ODα1、ODα2、ODβ、ODγ。则光密度总和(OD总)为:
OD总=OD白+ODα1+ODα2+ODβ+ODγ
白蛋白%=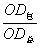 ×100 α1球蛋白%=
×100 α1球蛋白%=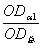 ×100 α2球蛋白%=
×100 α2球蛋白%=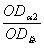 ×100
×100
β球蛋白%=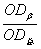 ×100 γ球蛋白%=
×100 γ球蛋白%=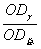 ×100
×100
(2)把薄膜放在滤纸上用电吹风吹干,待薄膜完全干燥后,浸入透明液中约5—10分钟,取出,平贴于干净玻璃片上,自然干燥或用电吹风冷风吹干,即得背景透明的电泳图谱,可用刀片刮开并从玻板上取下图谱。能用光密度计测定各蛋白斑点。此图谱可长期保存。
五、思考题
1.点样端为何放在负极?
2.实验中应注意哪些事项?
孝感学院生命科学技术学院实验报告



 专业: 学号: 姓名: 分数:
专业: 学号: 姓名: 分数:
 实验六 氨基酸的分离鉴定——纸层析法
实验六 氨基酸的分离鉴定——纸层析法
一、实验目的
通过氨基酸的分离,学习纸层析法的基本原理及操作方法。
二、实验原理
纸层析法是用滤纸作为惰性支持物的分配层析法。
层析溶剂由有机溶剂和水组成。
物质被分离后在纸层析图谱上的位置是用Rf值(比移)来表示的:
Rf = 原点到层析中心的距离 / 原点到容剂前沿的距离
在一定的条件下某种物质的Rf值是常数。Rf值的大小与物质的结构、性质、溶剂系统、层析滤纸的质量和层析温度等因素有关。本实验利用纸层析法分离氨基酸。
三、器材
1、层析缸 2、毛细管 3、喷雾器 4、培养皿 5、小烧杯 6、长颈漏斗7、层析滤纸(新华一号) 8、电吹风
四、试剂
1、扩展剂 正丁醇:88%甲酸:水=15:2.5:2.5(体积比),平衡溶剂与扩展剂相同。每组配制40 mL。
2、氨基酸溶液 0.5%的赖氨酸、脯氨酸、缬氨酸、亮氨酸溶液及它们的混合液(各组份浓度均为0.5%)。
3、显色剂 50~l00 mL 0.1% 水合茚三酮正丁醇溶液。
五、操作
1.将盛有扩展剂10 mL的小烧杯和培养皿置于密闭的层析缸中。
2.戴手套取层析滤纸(长22 cm、宽14 cm)一张。在纸的一端距边缘2~3 cm处用铅笔划一条直
线,在此直线上每间隔2.5 cm作一记号。
3.点样:用毛细管将各氨基酸样品分别点在这5个位置上,干后重复点一次,直径最大不超过3 mm。缝成筒状,两边不能接触。点样面朝外,点样端朝下,盖上层析缸盖,平衡约10~30分钟。
4.展层 用长颈漏斗,扩展剂的液面需低于点样线1cm。溶剂扩展至滤纸上沿约5厘米时,取出滤纸,用铅笔标出溶剂前沿界线,干燥。
5.显色 用0.1%茚三酮丙酮溶液均匀浸透,用热风吹干。脯氨酸、羟脯氨酸产生黄色物质外,所有α-氨基酸及一切蛋白质都能和茚三酮产生兰紫色物质。
 批阅教师: 年 月 日
批阅教师: 年 月 日
6.计算各种氨基酸的Rf值。
六、实验结果
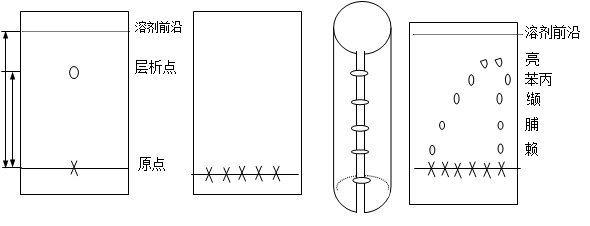
各种氨基酸的Rf值:

七、思考题
1. 实验过程中切勿用手直接接触滤纸和显色剂,为什么?
2. 点样过程中必须在第一滴样品干后再点第二滴,为什么?
孝感学院生命科学技术学院实验报告



 专业: 学号: 姓名: 分数:
专业: 学号: 姓名: 分数:
 实验七 基因组DNA的快速提取---碘化钾法
实验七 基因组DNA的快速提取---碘化钾法
一、实验目的
了解碘化钾法提取动物组织基因组DNA的原理;掌握DNA提取的相关操作技术。
二、实验原理
快速、经济地从血液、组织或培养细胞中得到高产量、高纯度的DNA 对于基因研究非常重要。
目前国内外基因组DNA 的提取方法有传统的蛋白酶K 消化法、尿素法、氯化锌法、辛酸法等, 这些方法存在操作步骤繁杂或者使用蛋白酶,且国内许多实验室不易得到方法中使用的试剂。 高浓度碘化钾可直接将细胞膜、核膜破坏、使DNA 释放出来,然后用异丙醇沉淀DNA。实验表明,KI 的浓度对DNA 的提取效率有影响,5 mol/ L 的KI 提取DNA 效果较好。
KI 法操作简便,不用价格较高的蛋白酶K。DNA 丢失少。该方法提取的DNA 与经典的蛋白酶K 法提取的DNA 比较电泳结果基本一致。
三、实验材料、试剂及主要器材
1. 实验材料
冷冻的新鲜动物肝脏。
2. 试剂
氯仿/异戊醇(24∶1):异戊醇21 mL加入到500 mL的氯仿试剂瓶中,混匀;5 mol/L 碘化钾:(41.5克碘化钾溶于50 mL纯水中);0. 9 % NaCl:4.5克NaCl溶于500 mL纯水中;无水乙醇。
3. 主要器材
台式高速(冷冻)离心机、移液器(10, 100,1000 µL),旋涡混合器、Eppendorf管等。
四、实验步骤
1. 取黄豆粒大小冷冻肝组织于EP管中(EP管上写上自己学号的最后两位数),有眼科剪捣碎;
2. 加50 µL 5 mol/ L KI,旋涡振荡30 s,静置3 min;
3. 加0. 9 % NaCl 375 µL,氯仿/异戊醇(24:1) 600 µL,充分振荡10 min,10 000 r/ min 离心5 min ;
4. 吸取水相层(上清)于另一Ependorf 管中,加-20度预冷乙醇1000 µL,轻轻混匀(此时应能看到DNA的絮状沉淀),12 000 r/ min 离心5 min 弃上清;
5. 加冷无水乙醇1000 µL,12,000 r/ min 离心3 min 弃净乙醇,待干(可在37 ℃烘干约10 min);以50 µL无菌双蒸水溶解DNA ,备用。
2. 加50 µL 5 mol/ L KI ,旋涡振荡30 s,将沉淀物混匀3 min;
3. 加0. 9 % NaCl 250 µL,氯仿/异戊醇(24∶1) 375 µL,充分振荡10 min ,10 000 r/ min 离心5 min ;
4. 吸取水相层(上清)于另一Ependorf 管中,加-20度预冷乙醇(-20度)300 µL,轻轻混匀(此时应能看到DNA的絮状沉淀),-20度冰箱静置5 min后12 000 r/ min 离心5 min 弃上清;
 批阅教师: 年 月 日
批阅教师: 年 月 日
5. 加冷无水乙醇1000 µL,12,000 r/ min 离心3 min 弃净乙醇,待干(可在37℃烘干约10 min);以50 µL无菌双蒸水溶解DNA ,备用。
五、思考题
1)在DNA 提取过程中乙醇的作用是什么?为什么用-20度预冷的乙醇效果更好?
2)实验所用的EP管和枪头等需要高温灭菌吗,为什么?
孝感学院生命科学技术学院实验报告



 专业: 学号: 姓名: 分数:
专业: 学号: 姓名: 分数:
 实验八 琼脂糖凝胶电泳技术——DNA样品检测
实验八 琼脂糖凝胶电泳技术——DNA样品检测
一、实验目的
学习与掌握琼脂糖凝胶电泳的技术方法,利用琼脂糖凝胶电泳检测DNA含量以及分子量,分离不同大小DNA片段。
二、实验原理
琼脂糖凝胶电泳是以琼脂糖凝胶为支撑物的区带电泳。不同大小、不同形状和不同构象的DNA分子在相同的电泳条件下(如凝胶浓度、电流、电压、缓冲液等),有不同的迁移率,所以可通过电泳使其分离。凝胶中的DNA可与荧光染料溴化乙锭(EB)结合,在紫外灯下可看到荧光条带,籍此可分析实验结果。
三、试剂配制
1. 5×TBE:Tris 54g;硼酸27.5g;0.5 M EDTA(pH 8.0)20 mL;加双蒸水至1 L。用时5倍稀释。
2. EB:用水配制成10 mg/mL的贮存液,分装,避光,4℃保存(1g溴乙锭于100 mL水中)。
3. 6×加样buffer:0.25%溴酚蓝;40%(W/V)蔗糖;溶于水中,贮存于4℃。
四、实验操作
1. 胶模 水平放置胶模。
2. 制胶 量取200 mL 1×TBE 缓冲液倒入三角烧瓶中,称取1.6克琼脂糖加入,在微波炉上加热至全熔(清澈透明)。凝胶加热时间不宜过长,以免蒸干。
3. 倒胶 用琼脂糖封好胶模,待凝胶冷至50℃左右时(手感容器能耐受),缓缓倒入制胶模中,迅速放好梳子。凝胶的厚度在3~5 mm之间。避免产生气泡,尤其梳子周围不能有气泡,若有气泡,可用吸管小心吸去。
4. 凝胶条件 凝胶通常需要在室温中放置20~30分钟。
5. 电泳缓冲液 凝胶完全凝固后,将凝胶放入电泳槽中(点样孔在负极),加入1×TBE电泳缓冲液,液面应高出凝胶表面1 mm。
6. 拔梳子 小心移去梳子和隔离板,保持点样孔完整。
7. 点样 用移液器取1-2 µL配制好的 Loading Buffer,分别与需要电泳的样品或Marker混合(5-10 µL),点样,记录点样次序。注意:每次电泳每块胶需留一孔点DNA marker。加样时Tip头不必插入孔中,可对准加样孔,在孔的上方加样,样品会沉入孔内。
8. 电泳 开启电泳仪电源开关,观察正负两极是否有气泡出现,如负极气泡比正极多,则表示电泳槽已经接通电源。电泳起始时需采用低压(80~100V),待电泳几分钟后溴酚蓝指示剂迁移至凝胶中,可调整电压至200V恒压电泳,当溴芬兰接近胶的先端,停止电泳。
9. 观测将胶在溴化乙锭(EB)溶液中浸泡约10分钟后,在用凝胶成像仪积分成像后观察并拍照。
 批阅教师: 年 月 日
批阅教师: 年 月 日
五、实验结果
DNA样品琼脂糖凝胶电泳检测图(在自己的点样孔上做上记号)。
六、思考题
1、如果实验成功了,请总结经验;如果实验失败了,请分析原因。
2、谈谈对生物化学实验的看法和建议。
-
生物化学实验报告
20xx年生物化学实验B姓名学号实验时间实验分组组内成员任课教师实验报告XXXX20xx年11月17日摘要本实验通过从小牛肠中通过…
-
生化实验报告4
生物化学实验报告纤维素酶活力的测定还原糖的测定35二硝基水杨酸法刘欣怡20xx0014005720xx级生物基地班周一下午同组者刘…
-
生物化学实验报告
实验一考马斯亮蓝G250染色法测定蛋白质的含量p24一目的要求掌握考马斯亮蓝CoomassieBrilliantBlue法测定蛋白…
-
生物化学综合实验报告
存车处生物化学综合实验实验报告项目名称核酸的分离纯化及性质研究指导教师商亚芳班级食品科学与工程类1304班姓名俞海清学号20xx2…
-
生物化学实验记录和实验报告的书写
第二节实验记录和实验报告的书写正确记录实验过程及书写实验报告是训练学生进行正规实验训练的重要内容实验是在理论指导下的科学实践目的在…
-
生物化学实验报告格式
《生物化学实验》实验报告本专业班级姓名学号目录实验一基本操作实验二血糖测定实验三血清谷丙转氨酶的测定实验四血清蛋白醋酸纤维薄膜电泳…
-
大学生物化学实验报告标准格式汇总
生物化学实验报告班级姓名实验一血清蛋白质醋酸纤维薄膜电泳目的原理仪器组成操作与结果结果粘贴实验二酶的特异性目的原理操作与结果将以上…
-
PCR扩增实验
1、PCR扩增试验原理:利用特异的引物,以重组质粒pGEX-4T-1〔His〕6-C-X为模板扩增X基因。n扩增反应1〕扩增引物2…
- 高中生物实验报告格式
-
微生物实验报告一
北方民族大学学生实验报告院部生物科学与工程学院姓名学号专业生物工程班级同组人员课程名称微生物学类实验实验名称产酶微生物的分离纯化与…
-
20xx生物化学实验报告册模板
生物化学实验报告姓名:张三学号:20xx000000001专业年级:20xx级生物技术组别:第五实验室生物化学与分子生物学实验教学…