物质的量知识点及习题
 一、物质的量浓度习题:
一、物质的量浓度习题:
1.0.5L 1mol/L的FeCl3溶液与0.2L 1 mol/L的KCl溶液中,Cl-浓度比为
A.15∶2 B.1∶1 C.3∶1 D.1∶3
2、有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4mol/L,SO42-的物质的量浓度为0.7mol/L,则此溶液中K+的物质的量浓度为
A.0.1mol/L B.0.15mol/L C.0.2mol/L D.0.25mol/L
3.100 mL2mol·L-1的Fe2(SO4)3溶液中含有的溶质的物质的量是多少?含有阴阳离子的物质的量各是多少?
与质量分数有关:
1. 某市售浓硫酸中溶质的质量分数为98%,密度为1.84g/cm3。计算该市售浓硫酸中H2SO4的物质的量浓度
2. 已知75mL2mol/LNaOH溶液的质量为80g。计算溶液中溶质的质量分数。
3. 常温下,将150mL 22% NaNO3溶液加100g蒸馏水后,溶液中溶质的质量分数变为14%。求原溶液的物质的量浓度
4.常温下,相对分子质量为M的某无水盐A的溶解度为Sg,则常温时,该盐饱
和溶液的质量分数为__________,如果已知该饱和溶液的密度为ρg/cm3,则该溶液的物质的量浓度为___________。
稀释问题:
1. 把4mol·L-1的盐酸15mL,配成0.15mol·L-1的盐酸溶液,加水多少毫升(假设混合后溶液的体积不变)?
2.将5mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度为
A. mol/L B.
mol/L B.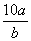 mol/L C.
mol/L C. mol/L D.
mol/L D. mol/L
mol/L
3.密度为0.910g/cm3氨水,质量分数为25.0%,该氨水用等体积的水稀释后,所得溶液的质量分数为( )
A.等于13.5% B.大于12.5%
C.小于12.5% D.无法确定
二、气体摩尔体积
l [练习] 下列说法是否正确,为什么?
1. 1.1mol氢气的体积约为22.4L 。
2. 2.标准状况下,1mol水的体积约22.4L。
3. 3.20℃时,1mol氧气的体积约22.4L。
4. 4.2×105 Pa时,1mol氮气的体积小于22.4L
推论一:在同温同压下,任何气体的体积之比 == 物质的量之比
1. 标准状况下,4.4克二氧化碳与多少克氧气所占的体积相同?
推论二:同温同压下,任何气体的密度之比 == 摩尔质量之比(即式量之比)
l 某有机气体A对氧气的相对密度为0.5,求A的式量是多少?
若已知该气体只含有碳和氢两种元素,试推测其化学式。
A气体对空气的相对密度是多少?
2.标准状况下,CO和CO2的混合气体质量为10克,体积是6.72升,
求:CO和CO2的体积和质量各是多少?
练习:
1.如果ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积是
A.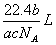 B.
B.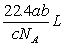 C.
C.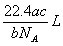 D.
D.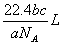
2.按体积比为4:2:3所组成的N2、O2、CO2,混合气体100g在标准状况下体积为___ L。
三、物质的量应用于化学方程式的计算
1.化学方程式中有关量的关系
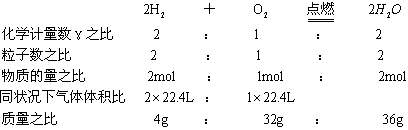
2.根据化学方程式计算时所列比例是否正确的判断依据是:“上、下单位要一致,左右单位要对应”。如: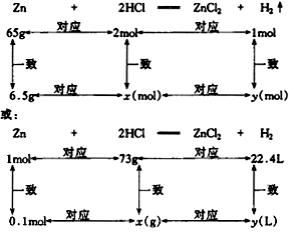
3.物质的量应用于化学方程式计算的一般格式
(1)设所求物质的物质的量为n(B)[或质量m(B)],或气体标准状况下体积V(B)、或溶液体积V[B(aq)]J。(2)写出有关反应的化学方程式。(3)在化学方程式有关物质的化学式下面先写出已知物和所求物的有关量的关系,再代入已知量和所求量。(4)写出所求物质的数学表达式。(5)写出解答和答案。
例1:6.5g Zn在与足量盐酸反应时产生的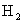 在标准状况下的体积是多少升?
在标准状况下的体积是多少升?
例2: 将一块铁片放入500mL,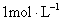 的
的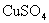 溶液中,反应一段时间后,取出铁片,小心洗净后干燥称量,铁片增重0.8g,反应后溶液中
溶液中,反应一段时间后,取出铁片,小心洗净后干燥称量,铁片增重0.8g,反应后溶液中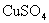 的物质的量浓度是( )
的物质的量浓度是( )
A.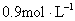 B.
B. C.
C.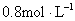 D.
D.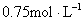
例3: 在托盘天平的两盘,放上质量相等的A、B两烧杯,调至平衡,然后分别倒入质量相等的足量盐酸,继而在AB两烧杯中放入下述各组物质,结果天平仍保持平衡的是( )
A.0.5mol Na和0.5mol Mg B.0.1mol Zn和0.1mol Al
C.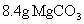 和
和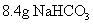 D.
D.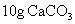 和
和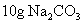
例题4: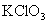 和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,其变化可表述为:
和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,其变化可表述为:
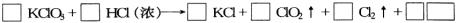
(1)请完成该化学方程式并配平(未知物化学式和系数填入框内)
(2)浓盐酸在反应中显示出来的性质是_____(填写编号、多选倒扣)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)产生0.1molCl2 则转移电子的物质的量为_____mol
(4)ClO2 具有很强的氧化性。因此,常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是Cl2 的_____倍。
5.向50mLNa2SO4和Na2CO3的混合溶液中加入过量的BaCl2溶液,得到14.51g白
色沉淀,向白色沉淀中加入过量的稀HNO3,充分反应后,沉淀减少到4.66g,并有
气体产生。
⑴原混合溶液中Na2SO4和Na2CO3的物质的量浓度各是多少?
⑵产生的气体在标准状况下的体积是多少?
作业:1.15g金属钠跟水反应,得到100mL溶液,试计算:
⑴生成的气体在标准状况下是多少毫升?
⑵反应后所得溶液的物质的量浓度是多少?
2.某学生配制0.1mol/LNaOH溶液100mL,下列操作会造成实际浓度偏高的是
A. 空盘时天平指针指向左边 B. 把烧碱放在纸上称量
C. 定容时俯视刻度线 D. 使用在空气中部分变质的烧碱31.配制一定物质的量浓度的溶液时,由于操作不慎,使液面略超过了容量瓶的刻
度(标线),这时应采取的措施是
A. 倾出标线以上的液体 B. 吸出标线以上的溶液
C. 影响不大,不再处理 D. 重新配制
3.配制100mL1mol/L的氢氧化钠溶液,下列操作错误的是
A. 在托盘天平上放两片大小相同的纸,然后将氢氧化钠放在纸上称取
B. 把称得的氢氧化钠放入盛有适量蒸馏水的烧杯中,溶解、冷却,再把溶液转入容量瓶中
C. 用蒸馏水洗涤烧杯、玻棒2~3次,洗涤液也移入容量瓶
D. 沿着玻棒往容量瓶中加蒸馏水,直至溶液凹面的最低点与刻度相切
4.下列实验操作所用仪器合理的是
A. 用25mL碱式滴定管量取14.80mLNaOH溶液
B. 用100mL量筒量取5.2mL盐酸
C. 用托盘天平称取25.20gNaCl
D. 用100mL容量瓶配制50mL0.10mol/L溶液
第二篇:物质的量知识点小结
物质的量知识点小结
有关概念:
1、物质的量(n)
①物质的量是国际单位制中七个基本物理量之一。
②用物质的量可以衡量组成该物质的基本单元(即微观粒子群)的数目的多少,它的单位是摩尔,即一个微观粒子群为1摩尔。
③摩尔是物质的量的单位。摩尔是国际单位制中七个基本单位之一,它的符号是mol。
④ “物质的量”是以摩尔为单位来计量物质所含结构微粒数的物理量。
⑤摩尔的量度对象是构成物质的基本微粒(如分子、原子、离子、质子、中子、电子等)或它们的特定组合。如1molCaCl2可以说含1molCa2+,2molCl-或3mol阴阳离子,或含54mol质子,54mol电子。摩尔不能量度宏观物质,如果说“1mol氢”就违反了使用准则,因为氢是元素名称,不是微粒名称,也不是微粒的符号或化学式。
⑥使用摩尔时必须指明物质微粒的名称或符号或化学式或符号的特定组合。
2.阿伏加德罗常数(NA):
①定义值(标准):以0.012kg(即12克)碳-12原子的数目为标准;1摩任何物质的指定微粒所含的指定微粒数目都是阿伏加德罗常数个。
②近似值(测定值):经过科学测定,阿伏加德罗常数的近似值一般取6.02×1023,单位是mol-1,用符号NA表示。
3.摩尔质量(M):
①定义:1mol某微粒的质量
②定义公式: ,
,
③摩尔质量的单位:克/摩。
④数值:某物质的摩尔质量在数值上等于该物质的原子量、分子量或化学式式量。⑤注意:摩尔质量有单位,是克/摩,而原子量、分子量或化学式的式量无单位。
4.气体摩尔体积(Vm)
①定义:在标准状况下(0℃,101kPa时),1摩尔气体所占的体积叫做气体摩尔体积。
②定义公式为: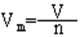
③数值:气体的摩尔体积约为22.4升/摩(L/mol)。
④注意:对于气体摩尔体积,在使用时一定注意如下几个方面:一个条件(标准状况,符号SPT),一个对象(只限于气体,不管是纯净气体还是混合气体都可),两个数据(“1摩”、“约22.4升”)。如“1mol氧气为22.4升”、“标准状况下1摩水的体积约为22.4升”、“标准状况下NO2的体积约为22.4升”都是不正确的。
⑤理解:我们可以认为22.4升/摩是特定温度和压强(0℃,101kPa)下的气体摩尔体积。当温度和压强发生变化时,气体摩尔体积的数值一般也会发生相应的变化,如273℃,101kPa时,气体的摩尔体积为44.8升/摩。
5.阿伏加德罗定律
①决定物质体积的三因素:物质的体积由物质的微粒数、微粒本身体积、微粒间的距离三者决定。气体体积主要取决于分子数的多少和分子间的距离;同温同压下气体分子间距离基本相等,故有阿伏加德罗定律:在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。反之也成立。
②阿伏加德罗定律:在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。
③阿伏加德罗定律及推论适用的前提和对象:可适用于同温、同压的任何气体。
6.阿伏加德罗定律的有关推论:
(其中V、n 、p、ρ、M分别代表气体的体积、物质的量、压强、密度和摩尔质量。)
①同温同压下: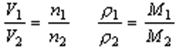 ;
;
②同温同体积: 。
。
7.标准状况下气体密度的计算
根据初中所学知识,密度=质量÷体积,下面我们取标准状况下1mol某气体,则该气体的质量在数值上等于摩尔质量,体积在数值上等于摩尔体积,所以可得如下计算公式:
标况下气体的密度(g·L-1)=气体的摩尔质量(g·mol-1)÷标况下气体的摩尔体积(L·mol-1)。
8.物质的量浓度
浓度是指一定温度、压强下,一定量溶液中所含溶质的量的多少。常见的浓度有溶液中溶质的质量分数,溶液中溶质的体积分数,以及物质的量浓度。
①定义:物质的量浓度是以单位体积(1升)溶液里所含溶质B的物质的量来表示溶液组成的物理量。
②定义公式为: 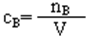
③单位:常用mol/L
④注意:溶液体积的计算及单位
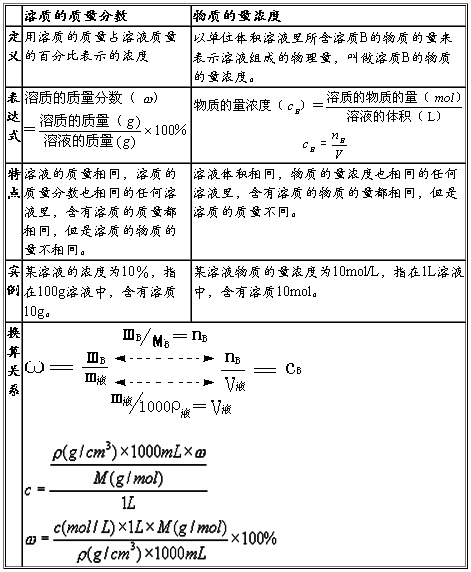
9.溶液的物质的量浓度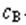 与溶液中溶质质量分数ω及溶液密度ρ(g·cm-3)之间的关系:
与溶液中溶质质量分数ω及溶液密度ρ(g·cm-3)之间的关系:
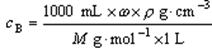
10.易混淆的概念辨析
①物质的量与摩尔:“物质的量”是用来计量物质所含结构微粒数的物理量;摩尔是物质的量的单位。
②摩尔质量与相对分子质量或相对原子质量:
摩尔质量是指单位物质的量的物质所具有的质量,它是一个有单位的量,单位为g·mol-1;相对原子质量或相对分子质量是一个相对质量,没有单位。摩尔质量与其相对原子质量或相对分子质量数值相同。
③质量与摩尔质量:质量是SI制中7个基本物理量之一,其单位是kg;摩尔质量是1摩尔物质的质量,其单位是g·mol-1;二者可通过物质的量建立联系。
二、物质的量的有关计算
1、关于物质的量浓度的计算。计算时运用的基本公式是:
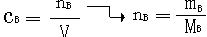
溶质的质量分数与物质的量浓度两浓度基本公式的换算关系:
3、一定物质的量浓度的稀释计算。
浓、稀溶液运算的基本公式是: 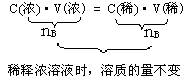
4.以物质的量为核心的换算关系
(1)NA 、M 、Vm、C 四个定义式的含义及相互换算关系:
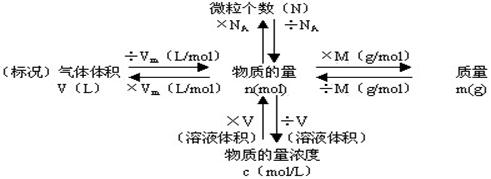

(2)与物质的量有关的物理量知识总结
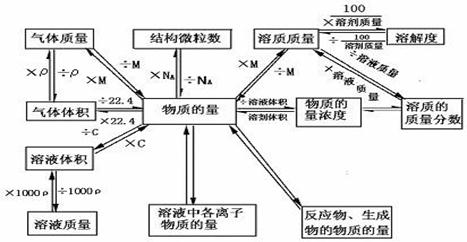
-
物质的量知识点总结
物质的量知识点复习1摩尔物质的量是国际规定的七个基本物理量之一用来表示含一定数目粒子的集体符号是n单位是mol摩尔是计量原子分子或…
-
物质的量单元知识点复习小结
物质的量单元知识点复习小结一有关概念1物质的量n物质的量是国际单位制中七个基本物理量之一用物质的量可以衡量组成该物质的基本单元即微…
-
高一化学物质的量知识点归纳2
化学计量在实验中的应用考点一物质的量与摩尔质量1物质的量1定义表示物质所含微粒多少的物理量也表示含有一定数目粒子的集合体2物质的量…
-
物质的量知识点小结
物质的量知识点小结有关概念1物质的量n物质的量是国际单位制中七个基本物理量之一用物质的量可以衡量组成该物质的基本单元即微观粒子群的…
-
物质的量知识点整理
第六讲物质的量1.复习重点1.理解质量守恒定律的涵义。2.明确摩尔的概念,掌握摩尔质量与相对分子质量、相对原子质量之间的区别与联系…
-
物质的量相关知识点总结
一、物质的量及单位——摩尔1.物质的量以________中所含的_________数为标准来衡量其他微粒集体所含微粒数目多少的物理…
-
盐类的水解知识点总结
盐类水解的应用考点1判断或解释盐溶液的酸碱性例如正盐KXKYKZ的溶液物质的量浓度相同其pH值分别为789则HXHYHZ的酸性强弱…
-
物质的量知识点总结
物质的量知识点复习1摩尔物质的量是国际规定的七个基本物理量之一用来表示含一定数目粒子的集体符号是n单位是mol摩尔是计量原子分子或…
-
物质的量单元知识点复习小结
物质的量单元知识点复习小结一有关概念1物质的量n物质的量是国际单位制中七个基本物理量之一用物质的量可以衡量组成该物质的基本单元即微…
-
高一化学物质的量知识点归纳2
化学计量在实验中的应用考点一物质的量与摩尔质量1物质的量1定义表示物质所含微粒多少的物理量也表示含有一定数目粒子的集合体2物质的量…