高中化学选修4第三章知识点分类总结
第三章 水溶液中的离子平衡
一、弱电解质的电离
1、定义:电解质: 在水溶液中或熔化状态下能导电的化合物,叫电解质 。
非电解质 : 在水溶液中或熔化状态下都不能导电的化合物 。
强电解质 : 在水溶液里全部电离成离子的电解质 。
弱电解质: 在水溶液里只有一部分分子电离成离子的电解质 。

2、电解质与非电解质本质区别:
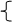 电解质——离子化合物或共价化合物
电解质——离子化合物或共价化合物
非电解质——共价化合物
注意:①电解质、非电解质都是化合物 ②SO2、NH3、CO2等属于非电解质
③强电解质不等于易溶于水的化合物(如BaSO4不溶于水,但溶于水的BaSO4全部电离,故BaSO4为强电解质)——电解质的强弱与导电性、溶解性无关。
3、弱电解质的电离平衡:在一定的条件下,当弱电解质分子电离成 离子的速率 和离子结合成 分子的速率相等 时,电离过程就达到了平衡状态,这叫弱电解质的电离平衡。
4、影响电离平衡的因素:
A、温度:电离一般吸热,升温有利于电离。
B、浓度:浓度越大,电离程度 越小 ;溶液稀释时,电离平衡向着电离的方向移动。C、同离子效应:在弱电解质溶液里加入与弱电解质具有相同离子的电解质,会减弱电离。D、其他外加试剂:加入能与弱电解质的电离产生的某种离子反应的物质时,有利于电离。
5、电离方程式的书写:
用可逆符号 弱酸的电离要分布写(第一步为主)
6、电离常数:在一定条件下,弱电解质在达到电离平衡时,溶液中电离所生成的各种离子浓度的乘积,跟溶液中未电离的分子浓度的比是一个常数。叫做电离平衡常数,(一般用Ka表示酸,Kb表示碱。 )
表示方法:AB A++B- Ki=[ A+][ B-]/[AB]
A++B- Ki=[ A+][ B-]/[AB]
K越大,弱电解质较易电离,其对应弱酸、弱碱较强。
H2SO3>H3PO4>HF>CH3COOH>H2CO3>H2S>HClO
7、影响因素:
a、电离常数的大小主要由物质的本性决定。
b、电离常数受温度变化影响,不受浓度变化影响,在室温下一般变化不大。
二、水的电离和溶液的酸碱性
1、水电离平衡::

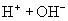
水的离子积:KW = c[H+]·c[OH-]
25℃时, [H+]=[OH-] =10-7 mol/L ; KW = [H+]·[OH-] = 1*10-14
注意:区分由水电离出的H+、OH-的浓度与水溶液中H+、OH-的浓度。
注意:KW只与温度有关,温度一定,则KW值一定
KW不仅适用于纯水,适用于任何溶液(酸、碱、盐)
2、水电离特点:(1)可逆 (2)吸热 (3)极弱
3、影响水电离平衡的外界因素:
①酸、碱 :抑制水的电离 KW〈1*10-14
②温度:促进水的电离(水的电离是吸热的)KW增大
③易水解的盐:促进水的电离 KW 〉 1*10-14
4、溶液的酸碱性和pH:
(1)pH=-lgc[H+]
(2)pH的测定方法:
酸碱指示剂—— 甲基橙 、石蕊 、酚酞 。
变色范围:甲基橙 3.1~4.4(橙色) 石蕊5.0~8.0(紫色) 酚酞8.2~10.0(浅红色)
pH试纸 —操作 玻璃棒蘸取未知液体在试纸上,然后与标准比色卡对比即可 。
注意:①事先不能用水湿润PH试纸;②广泛pH试纸只能读取整数值或范围
三、混合液的pH值计算方法公式
1、强酸与强酸的混合:(先求[H+]混:将两种酸中的H+离子物质的量相加除以总体积,再求其它) [H+]混 =([H+]1V1+[H+]2V2)/(V1+V2)
2、强碱与强碱的混合:(先求[OH-]混:将两种酸中的OH?离子物质的量相加除以总体积,再求其它) [OH-]混=([OH-]1V1+[OH-]2V2)/(V1+V2)
(注意 :不能直接计算[H+]混,此时水的电离大于酸的电离)
3、强酸与强碱的混合:(先据H+ + OH- ==H2O计算余下的H+或OH-,①H+有余,则用余下的H+数除以溶液总体积求[H+]混;OH-有余,则用余下的OH-数除以溶液总体积求[OH-]混,再求其它)
四、稀释过程溶液pH值的变化规律:
1、强酸溶液:稀释10n倍时,pH稀 = pH原+ n (但始终不能大于或等于7)
2、弱酸溶液:稀释10n倍时,pH稀 〈 pH原+n (但始终不能大于或等于7)
3、强碱溶液:稀释10n倍时,pH稀 = pH原-n (但始终不能小于或等于7)
4、弱碱溶液:稀释10n倍时,pH稀 〉pH原-n (但始终不能小于或等于7)
5、不论任何溶液,稀释时pH均是向7靠近(即向中性靠近);任何溶液无限稀释后pH均接近7
6、稀释时,弱酸、弱碱和水解的盐溶液的pH变化得慢,强酸、强碱变化得快。
五、强酸(pH1)强碱(pH2)混和计算规律 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
1、若等体积混合
pH1+pH2=14 则溶液显中性pH=7
pH1+pH2≥15 则溶液显碱性pH=pH2-0.3
pH1+pH2≤13 则溶液显酸性pH=pH1+0.3
2、若混合后显中性
pH1+pH2=14 V酸:V碱=1:1
pH1+pH2≠14 V酸:V碱=1:10〔14-(pH1+pH2)〕
六、酸碱中和滴定:
(一)、中和滴定的原理
1. 概念:利用中和反应,用已知浓度的酸(碱)滴定未知浓度的碱(酸)的实验方法。
2. 原理:H++OH—=H2O 即酸能提供的H+和碱能提供的OH-物质的量相等。
c碱=
式中:n——酸或碱中氢原子或氢氧根离子数;c——酸或碱的物质的量浓度;
V——酸或碱溶液的体积。
(由滴定曲线可知)
② 酸强碱相互滴定,可选用甲基橙或酚酞。
②若反应生成强酸弱碱盐溶液呈酸性,则选用酸性变色范围的指示剂(甲基橙);若反应生成强碱弱酸盐,溶液呈碱性,则选用碱性变色范围的指示剂(酚酞)
③ 蕊试液因颜色变化不明显,且变色范围过宽,一般不作滴定指示剂。
3. 实验重点 ⑴.准确测定两种溶液的体积
⑵.判断中和反应恰好完全进行:选用合适的指示剂。
(二)、中和滴定的操作过程:
(1)仪②滴定管的刻度,O刻度在上 ,往下刻度标数越来越大,全部容积 大于 它的最大刻度值,因为下端有一部分没有刻度。滴定时,所用溶液不得超过最低刻度,不得一次滴定使用两滴定管酸(或碱),也不得中途向滴定管中添加。②滴定管可以读到小数点后 一位 。
(2)药品:标准液;待测液;指示剂。
(3)准备过程:检漏
(4)试验过程
洗 :将实验所需的滴定管、锥形瓶等仪器洗涤干净,滴定管需要用对应的酸碱液进行润洗;
↓
取:调节液面在零刻度或零刻度以下,排除尖嘴部分的气泡;
↓
滴:先快后慢,2~3滴酚酞,左手控制活塞,右手震荡锥形瓶,眼睛注视锥形瓶中溶液颜色的变化,滴定终点的判断:加最后一滴标准溶液,颜色突变,30s不褪色;
↓
读:眼睛与凹液面相平;
↓
记:记录滴定前后滴定管的读数;
↓
算:计算待测液的浓度。
3、酸碱中和滴定的误差分析
误差分析:利用n酸c酸V酸=n碱c碱V碱进行分析
式中:n——酸或碱中氢原子或氢氧根离子数;c——酸或碱的物质的量浓度;
V——酸或碱溶液的体积。当用酸去滴定碱确定碱的浓度时,则:
c碱=

七、盐类的水解(只有可溶于水的盐才水解)
1、盐类水解:在水溶液中盐电离出来的离子跟水电离出来的H+或OH-结合生成弱电解质的反应。
2、水解的实质:水溶液中盐电离出来的离子跟水电离出来的H+或OH-结合,破坏水的电离,使平衡向右移动,促进水的电离。
3、盐类水解规律:
①有弱才水解,无弱不水解,越弱越水解;谁强显谁性,两弱都水解,同强显中性。
②多元弱酸根,浓度相同时正酸根比酸式酸根水解程度大,碱性更强 (如:Na2CO3 >NaHCO3)
4、盐类水解的特点:(1)可逆(与中和反应互逆) (2)程度小 (3)吸热
5、影响盐类水解的外界因素:
①温度:温度越 高 水解程度越大 (水解吸热,越热越水解)
②浓度:浓度越小,水解程度越 大 (越稀越水解)
③酸碱:促进或抑制盐的水解(H+促进 阴离子 水解而 抑制 阳离子水解;OH -促进阳离子水解而抑制阴离子水解)
6、酸式盐溶液的酸碱性:
①只电离不水解:如HSO4- 显 酸 性
②电离程度>水解程度,显 酸 性 (如: HSO3- 、H2PO4-)
③水解程度>电离程度,显 碱 性 (如:HCO3- 、HS- 、HPO42-)
7、双水解反应:
(1)构成盐的阴阳离子均能发生水解的反应。双水解反应相互促进,水解程度较大,有的甚至水解完全。使得平衡向右移。
(2)常见的双水解反应完全的为:Fe3+、Al3+与AlO2-、CO32-(HCO3-)、S2-(HS-)、SO32-(HSO3-);其特点是相互水解成沉淀或气体。双水解完全的离子方程式配平依据是两边电荷平衡,如:2Al3+ + 3S2- + 6H2O == 2Al(OH)3↓+ 3H2S↑
(3)不完全双水解:NH4+与S2- 、CO32-(HCO3-)、CH3COO-
8、盐类水解的应用:

9、水解平衡常数 (Kh)
对于强碱弱酸盐:Kh =Kw/Ka(Kw为该温度下水的离子积,Ka为该条件下该弱酸根形成的弱酸的电离平衡常数)
对于强酸弱碱盐:Kh =Kw/Kb(Kw为该温度下水的离子积,Kb为该条件下该弱碱根形成的弱碱的电离平衡常数)
电离、水解方程式的书写原则
1、多元弱酸(多元弱酸盐)的电离(水解)的书写原则:分步书写
注意:不管是水解还是电离,都决定于第一步,第二步一般相当微弱。
2、多元弱碱(多元弱碱盐)的电离(水解)书写原则:一步书写
强(弱)酸与强(弱)碱混合后溶液pH判断规律:
① 物质的量浓度相同,“元”相同的酸与碱等体积混合:谁强显谁性,都强显中性。
② pH之和为14的酸与碱等体积混合:谁弱显谁性,都强显中性。
八、溶液中微粒浓度的大小比较
☆☆基本原则:抓住溶液中微粒浓度必须满足的三种守恒关系:
①电荷守恒:任何溶液均显电 中 性,各阳离子浓度与其所带电荷数的乘积之和=各阴离子浓度与其所带电荷数的乘积之和
②物料守恒: (即原子个数守恒或质量守恒)
某原子的总量(或总浓度)=其以各种形式存在的所有微粒的量(或浓度)之和
③质子守恒:即水电离出的H+浓度与OH-浓度相等。
九、难溶电解质的溶解平衡
1、难溶电解质的溶解平衡的一些常见知识
(1)溶解度 小于 0.01g的电解质称难溶电解质。

(2)反应后离子浓度降至1*10-5以下的反应为完全反应。如酸碱中和时[H+]降至10-7mol/L<10-5mol/L,故为完全反应,用“=”,常见的难溶物在水中的离子浓度均远低于10-5mol/L,故均用“=”。
(3)难溶并非不溶,任何难溶物在水中均存在溶解平衡。
(4)溶解平衡存在的前提是:必须存在沉淀,否则不存在平衡。
2、溶解平衡
(1)溶解平衡的建立
在一定条件下,难溶电解质电解质溶解成离子的速率等于离子重新结合成沉淀的速率,溶液中各离子的浓度保持不变的状态。 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
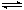 AmBn(s) mAn+(aq)+nBm-(aq)
AmBn(s) mAn+(aq)+nBm-(aq)
(2)溶解平衡的特征:逆、等、动、定、变。
(3)沉淀溶解平衡的影响因素
外因:①浓度:加水,平衡向溶解方向移动。
②温度:升温,多数平衡向溶解方向移动。【溶解平衡常为吸热,但Ca(OH)2为放热,升温其溶解度减少。】
② 同离子效应法
3. 容度积的计算
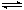 AmBn(s) mAn+(aq)+nBm-(aq)
AmBn(s) mAn+(aq)+nBm-(aq)
溶度积(KSP) KSP= [c(An+)]m ?[c(Bm-)]n
注:同类型的沉淀,KSP越小,溶解度越小。
4. 溶度积与溶解度区别和转化:
 区别: 溶度积是一个标准平衡常数,只与温度有关。
区别: 溶度积是一个标准平衡常数,只与温度有关。
溶解度与温度有关,还与系统的组成、pH值的改变及配合物的生成等因素有关。
(1)转化:在溶度积的计算中,离子浓度是物质的量的浓度,其单位为mol·L-1;而溶解度的单位有g/100g水,g·L-1, mol·L-1。计算时一般要先将难溶电解质的溶解度S的单位换算为mol·L-1。对于难溶物质饱和溶液浓度极稀,可作近似处理:(xg/100gH2O)×10/M mol· L-1。沉淀的溶解和生成
① QC 〉KSP 有沉淀析出
a加沉淀剂法:Ksp越小(即沉淀越难溶),沉淀越完全;沉淀剂过量能使沉淀更完全。
b调pH值除某些易水解的金属阳离子:如加MgO除去MgCl2溶液中FeCl3。
c氧化还原沉淀法:
d同离子效应法
② QC == KSP 平衡状态
③ QC 〈KSP 未饱和,继续溶解
沉淀的溶解就是使溶解平衡正向移动。常采用的方法有:①酸碱;②氧化还原;③沉淀转化。
(2)沉淀的转化
① 容度积大的生成溶解度小的,容度积小的生成容度积 更小 的。



 如:AgNO3 AgCl(白色沉淀) AgBr(淡黄色) AgI (黄色) Ag2S(黑色)
如:AgNO3 AgCl(白色沉淀) AgBr(淡黄色) AgI (黄色) Ag2S(黑色)
② 容度积小的也可以转化为容度积相对较大的沉淀。
如:除去重晶石(BaSO4)是先将容度积小的BaSO4转化为容度积相对较大的BaCO3。
第二篇:【人教版】高中化学选修4知识点总结:第四章电化学基础
第四章电化学基础
一、原电池
课标要求
1、掌握原电池的工作原理
2、熟练书写电极反应式和电池反应方程式
要点精讲
1、原电池的工作原理
(1)原电池概念: 化学能转化为电能的装置, 叫做原电池。
若化学反应的过程中有电子转移,我们就可以把这个过程中的电子转移设计成定向的移动,即形成电流。只有氧化还原反应中的能量变化才能被转化成电能;非氧化还原反应的能量变化不能设计成电池的形式被人类利用,但可以以光能、 热能等其他形式的能量被人类应用。
(2)原电池装置的构成
①有两种活动性不同的金属(或一种是非金属导体)作电极。
②电极材料均插入电解质溶液中。
③两极相连形成闭合电路。
(3)原电池的工作原理
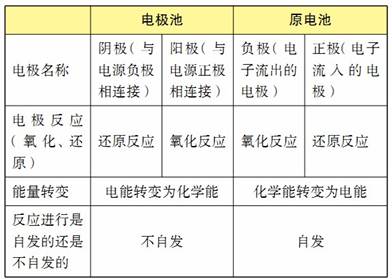
原电池是将一个能自发进行的氧化还原反应的氧化反应和还原反应分别在原电池的负极和正极上发生,从而在外电路中产生电流。负极发生氧化反应,正极发生还原反应,简易记法:负失氧,正得还。
2、原电池原理的应用
(1)依据原电池原理比较金属活动性强弱
①电子由负极流向正极,由活泼金属流向不活泼金属,而电流方向是由正极流向负极,二者是相反的。
②在原电池中,活泼金属作负极,发生氧化反应;不活泼金属作正极,发生还原反应。
③原电池的正极通常有气体生成,或质量增加;负极通常不断溶解,质量减少。
(2)原电池中离子移动的方向
①构成原电池后,原电池溶液中的阳离子向原电池的正极移动,溶液中的阴离子向原电池的负极移动;
②原电池的外电路电子从负极流向正极,电流从正极流向负极。
注:外电路:电子由负极流向正极,电流由正极流向负极;
内电路:阳离子移向正极,阴离子移向负极。
3、原电池正、负极的判断方法:
(1)由组成原电池的两极材料判断
一般是活泼的金属为负极,活泼性较弱的金属或能导电的非金属为正极。
(2)根据电流方向或电子流动方向判断。
电流由正极流向负极;电子由负极流向正极。
(3)根据原电池里电解质溶液内离子的流动方向判断
在原电池的电解质溶液内,阳离子移向正极,阴离子移向负极。
(4)根据原电池两极发生的变化来判断
原电池的负极失电子发生氧化反应,其正极得电子发生还原反应。
(5)根据电极质量增重或减少来判断。
工作后,电极质量增加,说明溶液中的阳离子在电极(正极)放电,电极活动性弱;反之,电极质量减小,说明电极金属溶解,电极为负极,活动性强。
(6)根据有无气泡冒出判断
电极上有气泡冒出,是因为发生了析出H2的电极反应,说明电极为正极,活动性弱。
本节知识树
原电池中发生了氧化还原反应,把化学能转化成了电能。

二、化学电源
课标要求
1、了解常见电池的种类
2、掌握常见电池的工作原理
要点精讲
1、一次电池
(1)普通锌锰电池
锌锰电池是最早使用的干电池。锌锰电池的电极分别是锌(负极)和碳棒(正极),内部填充的是糊状的MnO2和NH4Cl。电池的两极发生的反应是:
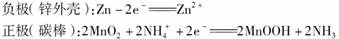
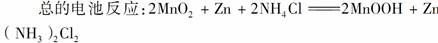
(2)碱性锌锰电池
用KOH电解质溶液代替NH4Cl作电解质时,无论是电解质还是结构上都有较大变化,电池的比能量和放电电流都能得到显著的提高。它的电极反应如下:

(3)银锌电池——纽扣电池
该电池使用寿命较长,广泛用于电子表和电子计算机。其电极分别为Ag2O和Zn,电解质为KOH溶液。其电极反应式为:
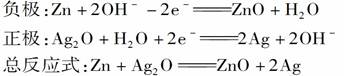
(4)高能电池——锂电池
该电池是20世纪70年代研制出的一种高能电池。由于锂的相对原子质量很小,所以比容量(单位质量电极材料所能转换的电量)特别大,使用寿命长。
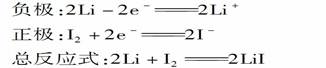 如作心脏起搏器的锂碘电池的电极反应式为:
如作心脏起搏器的锂碘电池的电极反应式为:
2、二次电池
原理:充电电池在放电时进行的氧化还原反应在充电时又逆向进行,生成物重新转化为反应物,使充电放电可在一定时期内循环进行。
铅蓄电池
构成:该电池以Pb和PbO2作电极材料,硫酸作电解质溶液。
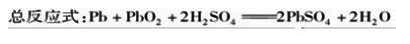
放电时二氧化铅电极上发生还原反应,铅电极上发生氧化反应。充电时二氧化铅电极上发生氧化反应,铅电极上发生还原反应。
3、氢氧燃料电池
(1)氢氧燃料电池的构造
在氢氧燃料电池中,电解质溶液为KOH溶液。石墨为电极, H2和 O2或空气)源源不断地通到电极上。
(2)氢氧燃料电池的优点是产物只有水,不产生污染物。
本节知识树
根据原电池的工作原理,设计了各种用途的原电池产品。需要了解常见电池的基本构造、 工作原理、 性能和使用范围。

三、电解池
课标要求
1、掌握电解池的工作原理
2、能够正确书写电极反应式和电解池反应方程式
3、了解电解池、 精炼池、 电镀池的原理
要点精讲
1、电解原理
(1)电解的含义:使电流通过电解质溶液(或熔化的电解质)而在阴、 阳两极引起氧化还原反应的过程叫做电解, 这种把电能转变成化学能的装置叫做电解池。
(2)构成电解池的条件
①直流电源。
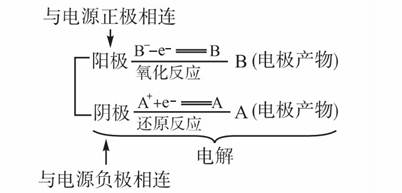
②两个电极。其中与电源的正极相连的电极叫做阳极,与电源的负极相连的电极叫做阴极。
③电解质溶液或熔融态电解质用石墨、 金、 铂等制作的电极叫做惰性电极,因为它们在一般的通电条件下不发生化学反应。用还原性较强的材料制作的电极叫做活性电极,它们作电解池的阳极时,先于其他物质发生氧化反应。
(3)阴、阳极的判断及反应原理
与电源的正极相连的电极为阳极。阳极如果是活泼的金属电极,则金属失去电子生成金属阳离子;阳极如果不能失去电子,则需要溶液中能失去电子(即具有还原性)的离子在阳极表面失去电子,发生氧化反应。
与电源的负极相连的电极为阴极。阴极如果是具有氧化性的物质,则阴极本身得到电子,发生还原反应,生成还原产物;阴极如果不能得到电子,则溶液中的离子在阴极表面得电
子,发生还原反应(如下图所示)
2、电解原理的应用
(1)电解饱和食盐水以制备烧碱、氯气和氢气
①电解饱和食盐水的反应原理

②离子交换膜法电解制烧碱的主要生产流程

(2)电镀
①电镀的含义: 电镀是应用电解原理在某些金属表面镀上一薄层其他金属或合金的过程。
②电镀的目的:电镀的目的主要是使金属增强抗腐蚀能力、 增加美观和表面硬度。
③电镀特点:“一多、一少、 一不变” 。一多指阴极上有镀层金属沉积,一少指阳极上有镀层金属溶解,一不变指电解液浓度不变。
(3)电镀的应用——铜的电解精炼
①电解法精炼铜的装置
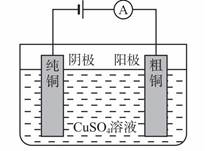
②电解法精炼铜的化学原理
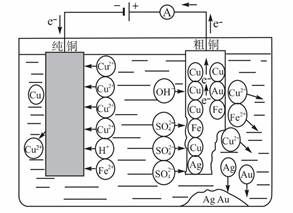
电解精炼是一种特殊的电解池。电解精炼中的两个电极都是同种金属单质,阳极是纯度较低的金属单质,阴极是纯度较高的金属单质。
(3)电冶金
原理:化合态的金属阳离子,在直流电的作用下,得到电子,变成金属单质。
本节知识树
化学能与电能可以相互转化。电能转化为化学能的反应为电解反应,实现电能转化成化学能的装置叫电解池。

原电池与电解池比较
四、金属的电化学腐蚀与防护
课标要求
①能够解释金属电化学腐蚀的原因
②了解金属腐蚀的危害
③掌握金属腐蚀的防护措施
要点精讲
1、金属的腐蚀
(1)定义: 金属的腐蚀是指金属与周围的气体或液体物质发生氧化还原反应而引起损耗的现象。
(2)分类:由于金属接触的介质不同,发生腐蚀的情况也不同,一般可分为化学腐蚀和电化学腐蚀。
①化学腐蚀: 金属跟接触到的物质直接发生反应而引起的腐蚀叫做化学腐蚀。化学腐蚀过程中发生的化学反应是普通的氧化还原反应,而不是原电池反应,无电流产生。
②电化学腐蚀:不纯的金属与电解质溶液接触时,会发生原电池反应。比较活泼的金属失去电子而被氧化,这种腐蚀叫做电化学腐蚀。
(3)电化学腐蚀
电化学腐蚀,实际上是由大量的微小的电池构成微电池群自发放电的结果。
①析氢腐蚀
钢铁在潮湿的空气中表面会形成一薄层水膜,在钢铁表面形成了一层电解质溶液的薄膜,与钢铁里的铁和少量的碳恰好形成了原电池。这无数个微小的原电池遍布钢铁表面,在这些原电池里,铁是负极,碳是正极。若电解质溶液酸性较强则发生析氢腐蚀。
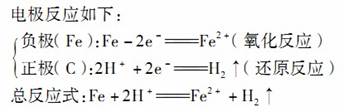
②吸氧腐蚀
金属表面酸性较弱或呈中性时,溶解在溶液中的氧气与水结合,生成OH-,消耗了氧气,从而使得溶液不断吸收空气中的氧气而发生吸氧腐蚀。
2、金属的防护
金属防护的目的就是防止金属的腐蚀。金属的防护要解决的主要问题就是使金属不被氧化。
(1)牺牲阳极的阴极保护法
将被保护的金属与更活泼的金属连接,构成原电池,使活泼金属作阳极被氧化,被保护的金属作阴极。
(2)外加电源的阴极保护法
利用外加直流电, 负极接在被保护金属上成为阴极,正极接其他金属。
(3)非电化学防护法
①非金属保护层②金属保护层③金属的钝化
3、判断金属活动性强弱的规律
(1)金属与水或酸的反应越剧烈,该金属越活泼。
(2)金属对应的最高价氧化物的水化物的碱性越强,该金属越活泼。
(3)一种金属能从另一种金属的盐溶液中将其置换出来,则该金属比另一种金属更活泼。
(4)两金属构成原电池时,作负极的金属比作正极的金属更活泼。
(5)在电解的过程中,一般地先得到电子的金属阳离子对应的金属单质的活泼性比后得到电子的金属阳离子对应的金属单质的活泼性弱。
本节知识树
在揭示金属腐蚀的严重性和危害性的基础上,分析发生金属腐蚀的原因,探讨防止金属腐蚀的思路和方法。

本章知识网络
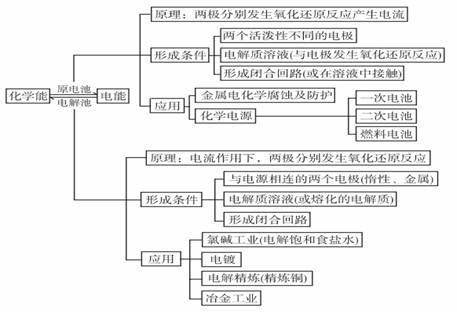
金属冶炼方法总结
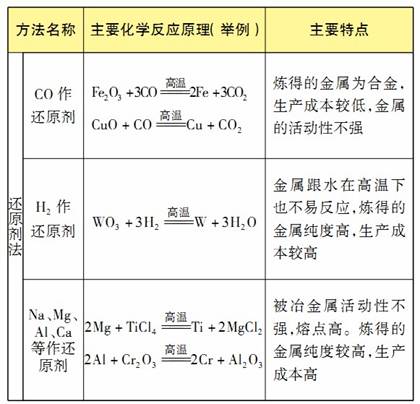
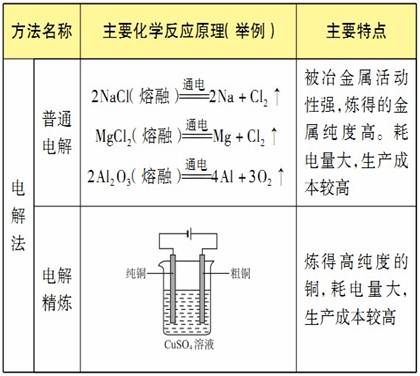
-
化学选修4第三章知识点归纳
第三章水溶液中的离子平衡一弱电解质的电离1定义电解质在水溶液中或熔化状态下能导电的化合物叫电解质非电解质在水溶液中或熔化状态下都不…
-
高中化学选修4知识点归纳总结律
高中化学选修4知识点归纳总结第一章化学反应与能量一焓变反应热1反应热一定条件下一定物质的量的反应物之间完全反应所放出或吸收的热量2…
-
高中化学选修4第三章水溶液中的离子平衡知识点和题型总结
水溶液中的离子平衡1知识要点一弱电解质的电离1定义电解质非电解质强电解质弱电解质混和物强电解质强酸强碱绝大多数金属氧化物和盐如HC…
-
高中化学选修4第三章知识点分类总结
第三章水溶液中的离子平衡一弱电解质的电离1定义电解质非电解质在水溶液中或熔化状态下都不能导电的化合物强电解质在水溶液里全部电离成离…
-
化学选修4 第三章 复习知识点总结练习(修订)
第三章知识点复习一弱电解质的电离1定义电解质非电解质强电解质弱电解质混和物强电解质如HClNaOHNaClBaSO4弱电解质如HC…
-
高中化学选修4知识点归纳总结律
高中化学选修4知识点归纳总结第一章化学反应与能量一焓变反应热1反应热一定条件下一定物质的量的反应物之间完全反应所放出或吸收的热量2…
-
高中化学选修4知识点总结
高中化学选修4知识点总结第1章化学反应与能量转化一化学反应的热效应1化学反应的反应热重点1反应热的概念当化学反应在一定的温度下进行…
-
高中化学选修4知识点归纳总结律
高中化学选修4知识点归纳总结第一章化学反应与能量一焓变反应热1反应热一定条件下一定物质的量的反应物之间完全反应所放出或吸收的热量2…
-
高中化学选修4知识点总结
高中化学选修4知识点总结第1章化学反应与能量转化化学反应的实质是反应物化学键的断裂和生成物化学键的形成化学反应过程中伴随着能量的释…
-
高中化学选修4知识点归纳总结
高中化学选修4知识点归纳总结第一章化学反应与能量一、焓变反应热1.反应热:一定条件下,一定物质的量的反应物之间完全反应所放出或吸收…
-
【人教版】高中化学选修3知识点总结:第一章原子结构与性质
第一章原子结构与性质小结【课标要求】1.了解原子核外电子的能级分布,能用电子排布式表示常见元素的(1~36号)原子核外电子的排布。…