氧化还原反应中的知识点配套练习
第一章 氧化还原反应中的知识点、配套练习
氧化剂、还原剂
(一)氧化剂、还原剂;氧化性、还原性;氧化产物、还原产物判断
题型一:氧化剂、还原剂;氧化产物、还原产物判断
10.在下列反应中,水作还原剂的是( )
A.SO3+H2O=H2SO4 B.2Na+2H2O=2NaOH+H2↑
C.2H2+O2 2H2O D.2F2+2H2O=4HF+O2
2H2O D.2F2+2H2O=4HF+O2
11.CaH2常做生氢剂,其中氢元素是-1价,化学方程式为:
CaH2+2H2O=Ca(OH)2+2H2↑,其中水是 ( )
A.还原剂 B.既是氧化剂,又是还原剂
C.氧化剂 D.既不是氧化剂,又不是还原剂
12.在2KMnO4==2K2MnO4 + MnO2 + O2↑中,KMnO4所起的作用是:( )
A.氧化剂 B.既不是氧化剂又不是还原剂
C.还原剂 D.既是氧化剂又是还原剂
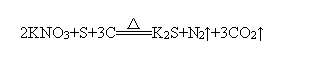
13.黑火药的爆炸反应为: ,其中被还原的元素是 ( )
A.N B.C C.N和S D.N和C
14.下列表示SO2被还原的反应是 ( )
A.SO2+2H2O+Cl2==H2SO4+2HCl
B.SO2+2H2S==3S↓+2H2O
C.SO2+H2O==H2SO3
D.2SO2 + O2 ===2SO3
题型二:氧化性、还原性判断
20.下列微粒①Al3+ ②Cl- ③N2 ④MnO4- ⑤CO2 ⑥H2O2 ⑦Fe2+ ⑧MnO42-
既具有氧化性又具有还原性的是
A.①④⑤⑦ B.③⑥⑦⑧ C.④⑤⑥⑧ D.①②③⑥
21.下列离子最容易给出电子的是( )
A.Cl— B.Cu2+ C.Fe2+ D.F—
22.人体血红蛋白中含有Fe2+离子,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+离子转化为Fe3+离子,生成高铁血红蛋白而丧失与O2的结合的能力,服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有( )
A.酸性 B.碱性 C.氧化性 D.还原性
23.阅读下列材料后,回答相应问题
一个体重50Kg的健康人,含铁2g。这2g铁在人体中不是以单质金属的形式存在的,而是以Fe2+和Fe3+和—的形式存在。二价铁离子易被吸收,给贫血者补充铁时,应给予含二价铁离子的二价铁盐,如硫酸亚铁(FeSO4)。服用维生素C,可使食物中的三价铁离子还原成二价铁离子,有利与铁的吸收。
(1)、人体中经常进行 的转化,A中Fe2+做 剂,B中Fe3+做 剂。
的转化,A中Fe2+做 剂,B中Fe3+做 剂。
(2)、“服用维生素C,可使食物中的三价铁离子还原成二价铁离子。”这句话指出维生素C在这一反应中做 剂,具有 性。
24.在Fe、Fe2+、Fe3+、Cl2、Cl-、Na+几种粒子中,只有氧化性的是 ,只有还原性的是 ,既有氧化性又有还原性的是 。
25.在下列反应中A.Na2O2+HCl — H2O2+NaCl
B.Ag2O+H2O2—Ag+O2↑+H2O
C.H2O2 — H2O+O2↑
D.H2O2+Cr2(SO4)3+KOH — K2SO4+H2O+K2CrO4
(1)H2O2仅体现氧化性的反应为(填代号)
(2)H2O2既表现氧化性,又表现还原性的为
(3)H2O2表现出酸性的是 因为
题型三:
26、下列变化中,一定需加还原剂才能实现的是( )
A.Cl2→Cl- B.FeCl3→FeCl2 C.C→CO2 D.KMnO4→MnO2
27.下列变化必须加入氧化剂才能实现的是
A. CuO→CuSO4 B.CO2→CO C.Fe→Fe3O4 D.KClO3→O2
28.下列变化需加入氧化剂才能实现的是 ( )
A.CuO→Cu B.CaCO3→CaO
C.Fe→FeCl2 D.HCl→Cl2
(二)氧化性、还原性强弱比较
题型一:根据金属(非金属)活动顺序表判断

得电子能力越强的元素,氧化性越强,失电子能力越强的元素,还原性越强
30.下列对氧化还原反应的分析中合理的是 ( )
A. Cu2+氧化性比Na+强
B. Cl2得电子的能力比Br2强,所以氧化性:Cl2 >Br2
C.凡是氧化还原反应都能造福于人类
D.氧化还原反应中元素的原子电子失去的越多,还原性越强
如:钠原子能失去1个电子,铝原子能失去3个电子,所以铝的还原性比钠强
题型二:较强的氧化剂+较强的还原剂 较弱的还原剂+较弱的氧化剂
较弱的还原剂+较弱的氧化剂
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
31(05广东)从海水中可以提取溴,主要反应为:2Br—+Cl2=2Cl—+Br2,下列说法正确的是
A.溴离子具有氧化性 B.氯气是还原剂
C.该反应属于复分解反应 D.氯气的氧化性比溴单质强
32.已知在某温度时发生如下三个反应:
(1)C+CO2=2CO (2)C+H2O=CO+H2 (3)CO+H2O=CO2+H2
据此判断,该温度下C、CO、H2的还原性强弱顺序是:
A.CO>C>H2 B.C>CO>H2
C.C>H2>CO D.CO>H2>C
33.根据以下四个反应:
(1)H2S+I2=2H++2I-+S¯ (2)H2SO3+2H2S=3S¯+3H2O
(3)2I-+Br2=2Br-+I2 (4)H2SO3+I2+H2O=H2SO4+2HI
确定Br-、I-、H2S和H2SO3还原性由强到弱的顺序是
A.H2S>H2SO3>I->Br- B.Br->I->H2SO3>H2S
C.H2SO3>H2S>Br->I- D.I->Br->H2S>H2SO3
34.已知:①2FeCl3+2KI=2FeCl2+2KCl+I2 ②2FeCl2+Cl2=2FeCl3判断下列物质的氧化能力由大到小的顺序是
(A)Fe3+>Cl2>I2 (B)Cl2>Fe3+>I2 (C)I2>Cl2>Fe3+ (D)Cl2>I2>Fe3+
35. 根据下列反应,判断氧化性强弱正确的是( )
(1)2H2S+O2===2S↓+2H2O (2)4NaI+O2+2H2O===4NaOH+2I2
(3)Na2S+I2===2NaI+S↓
A.O2>I2>S (B) O2>S>I2 C.I2>O2>S D.S>I2>O2
36.有下列反应(其中A、B、C、D各代表一种元素)
2A-+B2===2B-+A2 2A-+C2===2C-+A2 2B-+C2===2C-+B2 2C-+D2===2D-+C2
其中氧化性最强的物质是( )
A.A2 B.B2 C.C2 D.D2
题型三:根据氧化性、或还原性强弱判断反应能否进行
37.(05江苏)已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2氧化性依次减弱。下列反应在水溶液中不可能发生的是
A.3 Cl2 + 6 FeI2 = 2FeCl3 + 4 FeI3 B.Cl2 + FeI2 = FeCl2 + I2
C.Co2O3 + 6 HCl = 2CoCl2 + Cl2↑+ 3H2O D.2Fe3+ + 2I— = 2Fe2+ + I2
题型四:判断元素的化合价变化趋势
38.G、Q、X、Y、Z均为氯的含氧化合物,我们不了解它们的化学式,但知道它们在一定条件下具有如下的转换关系(未配平) (1)G → Q+NaCl;

这五种化合物中氯的化合价由低到高的顺序为( )
A.QGZYX B.GYQZX C.GYZQX D.ZXGYQ
(提示:氯的含氧化合物一般Cl的化合价为正价.)
39.G、Q、X、Y、Z均为含氯的化合物,在一定的条件下具有如下转化关系:①G→Q+NaCl, ②Q+H2O→X+H2↑, ③Y+NaOH→G+Q+H2O,④Z+NaOH→Q+X+H2O。试判断氯的化合价由高到低的排列顺序是 ( )
A.X>Y>Z>G>Q B.Y>X>Z>G>Q
C.G>Y>Q>Z>X D.X>Z>Q>Y>G
题型五:选择满足条件的氧化剂或还原剂
40.已知下列3个反应:2FeCl3+2KI=2FeCl2+2KCl+I2
2FeCl2+Cl2=2FeCl3
KClO3+6HCl=3Cl2↑+3H2O+KCl
若某溶液中有FeCl2和FeI2同时存在,要氧化I-而得到FeCl2溶液,应加入适量 ( )
A.FeCl3 B.Cl2 C.KClO3 D.HCl
五、氧化还原反应的计算:电子守恒
45.在3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O反应中,若有64gCu被氧化,则被还原的HNO3的质量是( )
A.168g B.42g C.126g D.60g
46.在一定条件下,RO3n-和氟气可发生如下反应:
RO3n-+F2+2OH-=RO4-+2F-+H2O。
从而可知在RO3n-中,元素R的化合价是 ( )
A.+4 B.+5 C.+6 D.+7
47.在下列反应中11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4
①还原剂是 氧化剂是
②被氧化的P原子个数和被还原P的个数比是
③每个Cu2+氧化的P原子个数是
48.R2O8n-离子在一定条件下可以把Mn2+离子氧化为MnO4-,若反应后R2O8n-离子变为R042-离子,又知反应中R2O8n-和Mn2+的个数之比为5 :2, 则n值是多少?
填空题参考答案
18.K2Cr2O7 ,HCl ; Cl ; Cr ;Cl2 ;CrCl3
19.K2Cr2O7,CH3CH2OH,CH3COOH, Cr2(SO4)3
23.(1)还原 ,氧化 (2)还原 还原
24.Na+ ,Fe 、Cl- ,Fe2+、Fe3+、Cl2
(1)B(2)C (3)A 强酸制弱酸
44. (1) Cl2 ==73.3 (2) Cl2 ==70.7
47.①P,P、CuSO4②6:5③1/5
48.n=2
第二篇:氧化还原反应中的知识点配套练习
第一章 氧化还原反应中的知识点、配套练习
一、氧化还原反应概念
1.下面有关氧化还原反应的叙述不正确的是 ( )
A.在反应中不一定所有元素的化合价都发生变化
B.肯定有一种元素被氧化,另一种元素被还原
C.在氧化还原反应中,失去电子的物质,所含元素化合价降低
D.氧化还原反应的本质是电子的转移
2.氧化还原反应的实质是 ( )
A.得氧和失氧 B.化合价的升降 C.有无新物质生成 D.电子的转移
3.下列叙述正确的是 ( )
A.在氧化还原反应中,做氧化剂的物质不能做还原剂
B.分解反应都是氧化还原反应
C.反应中某元素的原子变为阳离子,则该元素的单质在反应中一定是还原剂
D.凡是没有电子转移也就没有化合价升降的反应,就不属于氧化还原反应
4.下列反应中,属于氧化还原反应的是( )
A.CaCO3+2HCl CaCl2+CO2↑+H2O B.CaO+H2O
CaCl2+CO2↑+H2O B.CaO+H2O Ca(OH)2
Ca(OH)2
C.Fe+CuSO4 FeSO4+Cu D.
FeSO4+Cu D. 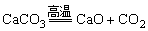
5.下列反应属于非氧化还原反应的是( )


A.Fe2O3+3CO====2Fe+3CO2 B.NH4NO3====N2O↑+2H2O


C.2NaHCO3==Na2CO3+CO2↑+H2O D.Cu2(OH)2CO3==2CuO+CO2↑+H2O
6.实验室利用氧化还原反应制取的气体是( )
A.O2 H2 CO2 B.O2 CO2 C.CO2 D.H2 O2
二、氧化还原反应与四大基本反应类型的关系
7.下列反应一定属于氧化还原反应的是( )
A.化合反应式 B.分解反应 C.置换反应 D.复分解反应
8.下列说法中错误的是( )
A.凡是氧化还原反应,都不可能是复分解反应
B.化合反应不可能是氧化还原反应
C.置换反应一定是氧化还原反应
D.分解反应可能是氧化还原反应
9.如图18-1所法,能正确表示四种基本类型反应与氧化还原反应关系的示意图是( )

三、氧化剂、还原剂
(一)氧化剂、还原剂;氧化性、还原性;氧化产物、还原产物判断
题型一:氧化剂、还原剂;氧化产物、还原产物判断
10.在下列反应中,水作还原剂的是( )
A.SO3+H2O=H2SO4 B.2Na+2H2O=2NaOH+H2↑
C.2H2+O2 2H2O D.2F2+2H2O=4HF+O2
2H2O D.2F2+2H2O=4HF+O2
11.CaH2常做生氢剂,其中氢元素是-1价,化学方程式为:
CaH2+2H2O=Ca(OH)2+2H2↑,其中水是 ( )
A.还原剂 B.既是氧化剂,又是还原剂
C.氧化剂 D.既不是氧化剂,又不是还原剂
12.在2KMnO4==2K2MnO4 + MnO2 + O2↑中,KMnO4所起的作用是:( )
A.氧化剂 B.既不是氧化剂又不是还原剂
C.还原剂 D.既是氧化剂又是还原剂

13.黑火药的爆炸反应为: ,其中被还原的元素是 ( )
A.N B.C C.N和S D.N和C
14.下列表示SO2被还原的反应是 ( )
A.SO2+2H2O+Cl2==H2SO4+2HCl
B.SO2+2H2S==3S↓+2H2O
C.SO2+H2O==H2SO3
D.2SO2 + O2 ===2SO3
15.(05江苏)在下列生成二氧化硫的反应中,反应物中的含硫物质被氧化的是
A. 硫在空气中燃烧 B. 铜片与浓硫酸共热
C. 红热的木炭与浓硫酸反应 D. 亚硫酸钠与稀硫酸反应
16.在下列反应中,氧化产物与还原产物是同一种物质的是 ( )
A.二氧化碳通过赤热的炭层
B.氧化铜和木炭在高温下反应
C.氢气通过灼热的氧化铜
D.一氧化碳通过高温的赤铁矿
17.某元素在化学反应中由化合态变为游离态,则该元素 ( )
A.可能被氧化 B.一定被还原
C.既可能被氧化又可能被还原 D.以上都不是
18.在K2Cr2O7+14HCl==2KCl+2CrCl3+3Cl2↑+7H2O反应中,______是氧化剂;______是还原剂;______元素被氧化;______元素被还原;______是氧化产物;______是还原产物
19.K2Cr2O7是一种橙红色具有强氧化性的化合物,当它在酸性条件下被还原成三价铬时,颜色变为绿色。据此,当交警发现汽车行驶不正常时,就可上前阻拦,并让司机对填充了吸附有K2Cr2O7的硅胶颗粒的装置吹气。若发现硅胶变色达到一定程度,即可证明司机是酒后驾车。这时酒精(CH3CH2OH)被K2Cr2O7氧化为醋酸(CH3COOH)。该氧化还原反应的方程式可表示为:
2K2Cr2O7+3CH3CH2OH+8H2SO4 = 2K2SO4+2Cr2(SO4)3+3CH3COOH+11H2O
在这一反应中,氧化剂是___________,还原剂是________,氧化产物是________,还原产物是____________________。
题型二:氧化性、还原性判断
20.下列微粒①Al3+ ②Cl- ③N2 ④MnO4- ⑤CO2 ⑥H2O2 ⑦Fe2+ ⑧MnO42-
既具有氧化性又具有还原性的是
A.①④⑤⑦ B.③⑥⑦⑧ C.④⑤⑥⑧ D.①②③⑥
21.下列离子最容易给出电子的是( )
A.Cl— B.Cu2+ C.Fe2+ D.F—
22.人体血红蛋白中含有Fe2+离子,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+离子转化为Fe3+离子,生成高铁血红蛋白而丧失与O2的结合的能力,服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有( )
A.酸性 B.碱性 C.氧化性 D.还原性
题型三:
26、下列变化中,一定需加还原剂才能实现的是( )
A.Cl2→Cl- B.FeCl3→FeCl2 C.C→CO2 D.KMnO4→MnO2
27.下列变化必须加入氧化剂才能实现的是
A. CuO→CuSO4 B.CO2→CO C.Fe→Fe3O4 D.KClO3→O2
28.下列变化需加入氧化剂才能实现的是 ( )
A.CuO→Cu B.CaCO3→CaO
C.Fe→FeCl2 D.HCl→Cl2
-
氧化还原反应知识点归纳
氧化还原反应知识点归纳(氧化还原反应中的概念与规律;氧化还原反应的表示方法及配平。)氧化还原反应中的概念与规律:一、五对概念在氧化…
-
高中化学知识点总结氧化还原反应
燕园教育教师培训手册三氧化还原反应1准确理解氧化还原反应的概念11氧化还原反应各概念之间的关系1反应类型氧化反应物质所含元素化合价…
-
氧化还原反应知识点总结
一氧化还原基本概念1四组重要概念间的关系1氧化还原反应凡是反应过程中有元素化合价变化或电子转移的化学变化叫氧化还原反应氧化还原反应…
-
高一化学之三 氧化还原反应知识点总结
714氧化还原反应知识点一概念氧化还原反应的实质电子的转移电子的得失或共用电子对的偏移口诀失电子化合价升高被氧化氧化反应还原剂得电…
-
氧化还原反应知识点总结
专题四氧化还原反应一氧化还原反应的基本概念1基本概念略氧化还原反应氧化反应还原反应氧化剂还原剂等2知识体系3常见氧化剂1活泼非金属…
-
高一化学下册知识点总结
高一化学必修二知识点总结一、元素周期表★熟记等式:原子序数=核电荷数=质子数=核外电子数1、元素周期表的编排原则:①按照原子序数递…
-
初三化学第六章知识点总结
碳和碳的氧化物课题1金刚石、石墨和C60一、碳的几种单质(金刚石、石墨、C60)1、金刚石(C钻探机的钻头(体现了它的硬度大)等。…
-
高一化学必修二知识点总结
高一化学必修二知识点总结一.元素周期表中元素及其化合物的递变性规律1.1原子半径(1)除第1周期外,其他周期元素(惰性气体元素除外…
-
20xx初中化学酸碱盐知识点总结(新)
20xx年初中化学酸碱盐知识点总结一物质的分类金属FeCuMgAl单质稀有气体HeNeAr固态非金属CSP非金属气态非金属HOCl…
-
高一高二化学知识点总结汇总
高一化学模块I主要知识及化学方程式一研究物质性质的方法和程序1基本方法观察法实验法分类法比较法2基本程序第三步用比较的方法对观察到…