氧化还原反应知识点总结
一、氧化还原基本概念
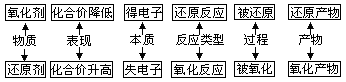
1. 四组重要概念间的关系
(1) 氧化还原反应:凡是反应过程中有元素化合价变化(或电子转移)的化学变化叫氧化还原反应。
氧化还原反应的特征:元素化合价的升降;氧化还原反应的实质:电子转移。
(2) 氧化反应和还原反应:在氧化还原反应中,反应物所含元素化合价升高(或者说物质失去)电子的反应成为氧化反应;反应物所含元素化合价降低(或者说是物质得到电子)的反应称为还原反应。
(3) 氧化剂、还原剂是指反应物。所含元素化合价降低的物质叫做氧化剂,所含元素化合价升高的物质叫做还原剂。
(4) 氧化产物、还原产物是指生成物。所含元素化合价升高被氧化,所得产物叫做氧化产物,所含元素化合价降低被还原,所得产物叫做还原产物。
关系:

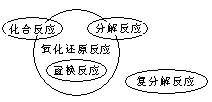
2. 氧化还原反应与四种基本反应类型

注意:有单质参加的化合反应和有单质生成的分解反应均为氧化还原反应。
二、氧化还原反应的有关计算
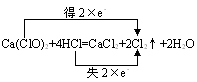
1. 氧化还原中的电子转移表示法
(1) 双线侨法:在反应物和生成物之间表示电子转移结果,该法侧重于表示同一元素的原子或离子间的电子转移情况,如


注意:
1线桥从方程式的左侧指向右侧;
2箭头不表示得失,只表示变化,所以一定要标明“得”或“失”。
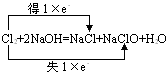
(2) 单线桥法:在反应物中的还原剂与氧化剂之间箭头指向氧化剂,具体讲是箭头从失电子的元素出发指向得电子的元素。如

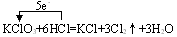

三、氧化还原反应的类型
1.还原剂+氧化剂氧化产物+还原产物
此类反应的特点是还原剂和氧化剂分别为不同的物质,参加反应的氧化剂或还原剂全部被还原或氧化,有关元素的化合价全部发生变化。例如:

2. 部分氧化还原反应
此类反应的特点是还原剂或氧化剂只有部分被氧化或还原,有关元素的化合价只有部分发生变化,除氧化还原反应外,还伴随非氧化还原反应。例如
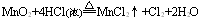
3. 自身氧化还原反应
自身氧化还原反应可以发生在同一物质的不同元素之间,即同一种物质中的一种元素被氧化,另一种元素被还原,该物质既是氧化剂又是还原剂;也可以发生在同一物质的同种元素之间,即同一物质中的同一种元素既被氧化又被还原。例如:

4. 归中反应
此类反应的特点是同一种元素在不同的反应物中有两种价态,反应后转化成中间价态。但应注意的是同一种元素反应时,其化合价只靠拢不交叉。例如


四、氧化性、还原性强弱的判断
1.氧化性、还原性的强弱取决于得失电子的难易程度,与得失电子的数目多少无关。如K - e-→K+,Al - 3e-→Al3+,但根据金属活动性顺序表,Na比Al活泼,更易失去电子,所以Na比Al的还原性更强。
从元素的价态分析:最高价态—只有氧化性,如Fe3+、H2SO4、KMnO4等;最低价态—只有还原性,如金属单质、Cl-、S2-等;中间价态—既有氧化性又有还原性,如Fe2+、S、SO2等。
2.常用判断方法
(1)根据元素活动性顺序判断
1金属活动性顺序

2非金属活动性顺序(常见元素)

(2) 根据元素在周期表中的位置判断
1同主族元素(从上到下)
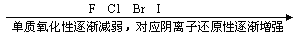
2同周期主族元素(从左到右)

(3)根据元素最高价氧化物的水化物酸碱性强弱判断
例如:由酸性:HClO4>H2SO4>H3PO4>H2CO3,可判断氧化性:Cl2>S>P>C。
(4)根据氧化还原反应的方向判断
氧化剂(氧化性)+还原剂(还原性)=还原产物+氧化产物
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
(5)根据氧化产物的价态判断
当变价的还原剂在相似条件下作用于不同的氧化剂时可根据氧化产物价态得高低来判断氧化剂氧化性的强弱。
如:由

可以判断氧化性:Cl2>S
(6)根据反应条件判断
当不同的氧化剂与同一还原剂反应时,如果氧化产物价态相同,可根据反应条件的高低来进行判断。例如:

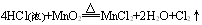

上述三个反应中,还原剂都是浓盐酸,氧化产物都是Cl2,而氧化剂分别是KMnO4、MnO2、O2。第一个式子中KMnO4常温下即可把浓盐酸中的氯离子氧化成氯原子;第二个式子中MnO2需要再加热条件下才能完成;第三个式子中O2不仅需要加热,而且还需要CuCl2作为催化剂才能完成。由此我们可以得出的结论:
氧化性:KMnO4 >MnO2>O2
(7)根据物质的浓度大小判断
具有氧化性或还原性的五一值浓度越大,其氧化性或还原性越强,反之,其氧化性或还原性越弱。如氧化性:
1浓硝酸大于稀硝酸
2MnO2能与浓盐酸反应而不能与稀盐酸反应。
(8)根据原电池和电解池的电极反应判断
1两种不同的金属构成原电池的两极,负极金属是电子流出的极,反应中被氧化。其还原性:负极>正极。
2用惰性电极电解混合溶液时,在阴极先放电的阳离子的氧化性较强,在阳极先放电的阴离子的还原性较强。
此外:物质氧化性与还原性的强弱与元素价态的高低没有必然联系,不是价态越高,氧化性越强。
常见强氧化剂
单 质:O3,卤素单质(X2)
氧 化 物:H2O2,NO2,Na2O2
含氧酸盐:KMnO4,K2Cr2O7(重铬酸钾),NaClO,KClO3,NaNO3(硝酸盐在强酸条件下),FeCl3(较强);
含氧酸:浓H2SO4,稀浓HNO3,HClO。
常见强还原剂
活泼金属单质(H)前;
SO32-,S2->I->Fe2+>Br-;
H2S>H2SO3>HI>HBr;
C,H2,CO(加热条件下)。
五、氧化还原反应的有关规律
1.守恒规律
化合价有升必有降,电子有得必有失。对于一个完整的氧化还原反应,化合价升降总数相等,得失电子总数相等。
应用:有关氧化还原反应的计算技巧及配平氧化还原反应方程式的根本依据。
2.强弱规律
较强氧化性的氧化剂跟较强还原性的还原剂反应,生成弱还原性的还原产物和弱氧化性的氧化产物。
应用:在适宜条件下,用氧化性较强的物质制备氧化性较弱的物质或用还原性较强的物质制备还原性较弱的物质,还能比较物质之间的氧化性或还原性的强弱。
3.价态规律
元素处于最高价态,只有氧化性;处于最低价态,只有还原性;若处于中间价态,既有氧化性又有还原性,但在一个反应中,主要表现一种性质。
应用:判断元素或物质氧化性或还原性的有无。
4.转化规律
氧化还原反应中,以元素相邻价态间的转化最易;同种元素不同价态之间若发生反应,元素的化合价只靠近而不交叉;同种元素相邻价态间不发生氧化还原反应。
应用:分析判断氧化还原反应中的物质变化及推测变化产物。
5.难易规律
越易失电子的物质,失电子后就越难得电子,越易得电子的物质,得电子后就越难失电子;一种氧化剂同时和几种还原剂相遇时,优先与还原性最强的还原剂发生反应;同理,一种还原剂同时和几种氧化剂相遇时,优先与氧化性最强的氧化剂发生反应。
应用:判断物质的稳定性及反应顺序。
第二篇:氧化还原反应知识点总结
一、氧化还原基本概念
1. 四组重要概念间的关系
(1) 氧化还原反应:凡是反应过程中有元素化合价变化(或电子转移)的化学变化叫氧化还原反应。
氧化还原反应的特征:元素化合价的升降;氧化还原反应的实质:电子转移。
(2) 氧化反应和还原反应:在氧化还原反应中,反应物所含元素化合价升高(或者说物质失去)电子的反应成为氧化反应;反应物所含元素化合价降低(或者说是物质得到电子)的反应称为还原反应。
(3) 氧化剂、还原剂是指反应物。所含元素化合价降低的物质叫做氧化剂,所含元素化合价升高的物质叫做还原剂。
(4) 氧化产物、还原产物是指生成物。所含元素化合价升高被氧化,所得产物叫做氧化产物,所含元素化合价降低被还原,所得产物叫做还原产物。
关系:
2. 氧化还原反应与四种基本反应类型
注意:有单质参加的化合反应和有单质生成的分解反应均为氧化还原反应。
二、氧化还原反应的有关计算
1. 氧化还原中的电子转移表示法
(1) 双线侨法:在反应物和生成物之间表示电子转移结果,该法侧重于表示同一元素的原子或离子间的电子转移情况,如
注意:
1线桥从方程式的左侧指向右侧;
2箭头不表示得失,只表示变化,所以一定要标明“得”或“失”。
(2) 单线桥法:在反应物中的还原剂与氧化剂之间箭头指向氧化剂,具体讲是箭头从失电子的元素出发指向得电子的元素。如
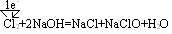
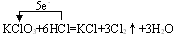

三、氧化还原反应的类型
1.还原剂+氧化剂氧化产物+还原产物
此类反应的特点是还原剂和氧化剂分别为不同的物质,参加反应的氧化剂或还原剂全部被还原或氧化,有关元素的化合价全部发生变化。例如:
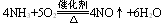
2. 部分氧化还原反应
此类反应的特点是还原剂或氧化剂只有部分被氧化或还原,有关元素的化合价只有部分发生变化,除氧化还原反应外,还伴随非氧化还原反应。例如
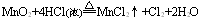
3. 自身氧化还原反应
自身氧化还原反应可以发生在同一物质的不同元素之间,即同一种物质中的一种元素被氧化,另一种元素被还原,该物质既是氧化剂又是还原剂;也可以发生在同一物质的同种元素之间,即同一物质中的同一种元素既被氧化又被还原。例如:
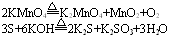
4. 归中反应
此类反应的特点是同一种元素在不同的反应物中有两种价态,反应后转化成中间价态。但应注意的是同一种元素反应时,其化合价只靠拢不交叉。例如
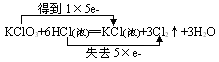
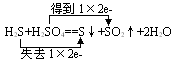
四、氧化性、还原性强弱的判断
1.氧化性、还原性的强弱取决于得失电子的难易程度,与得失电子的数目多少无关。如K - e-→K+,Al - 3e-→Al3+,但根据金属活动性顺序表,Na比Al活泼,更易失去电子,所以Na比Al的还原性更强。
从元素的价态分析:最高价态—只有氧化性,如Fe3+、H2SO4、KMnO4等;最低价态—只有还原性,如金属单质、Cl-、S2-等;中间价态—既有氧化性又有还原性,如Fe2+、S、SO2等。
2.常用判断方法
(1)根据元素活动性顺序判断
1金属活动性顺序
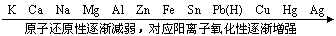
2非金属活动性顺序(常见元素)
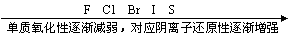
(2) 根据元素在周期表中的位置判断
1同主族元素(从上到下)
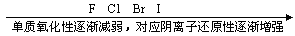
2同周期主族元素(从左到右)

(3)根据元素最高价氧化物的水化物酸碱性强弱判断
例如:由酸性:HClO4>H2SO4>H3PO4>H2CO3,可判断氧化性:Cl2>S>P>C。
(4)根据氧化还原反应的方向判断
氧化剂(氧化性)+还原剂(还原性)=还原产物+氧化产物
氧化性:氧化剂>氧化产物 还原性:还原剂>还原产物
(5)根据氧化产物的价态判断
当变价的还原剂在相似条件下作用于不同的氧化剂时可根据氧化产物价态得高低来判断氧化剂氧化性的强弱。
如:由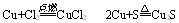 可以判断氧化性:Cl2>S
可以判断氧化性:Cl2>S
(6)根据反应条件判断
当不同的氧化剂与同一还原剂反应时,如果氧化产物价态相同,可根据反应条件的高低来进行判断。例如:
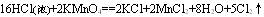
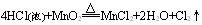
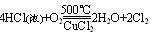
上述三个反应中,还原剂都是浓盐酸,氧化产物都是Cl2,而氧化剂分别是KMnO4、MnO2、O2。第一个式子中KMnO4常温下即可把浓盐酸中的氯离子氧化成氯原子;第二个式子中MnO2需要再加热条件下才能完成;第三个式子中O2不仅需要加热,而且还需要CuCl2作为催化剂才能完成。由此我们可以得出的结论:
氧化性:KMnO4 >MnO2>O2
(7)根据物质的浓度大小判断
具有氧化性或还原性的五一值浓度越大,其氧化性或还原性越强,反之,其氧化性或还原性越弱。如氧化性:
1浓硝酸大于稀硝酸
2MnO2能与浓盐酸反应而不能与稀盐酸反应。
常见强氧化剂
单 质:O3,卤素单质(X2)
氧 化 物:H2O2,NO2,Na2O2
含氧酸盐:KMnO4,K2Cr2O7(重铬酸钾),NaClO,KClO3,NaNO3(硝酸盐在强酸条件下),FeCl3(较强);
含氧酸:浓H2SO4,稀浓HNO3,HClO。
常见强还原剂
活泼金属单质(H)前;
SO32-,S2->I->Fe2+>Br-;H2S>H2SO3>HI>HBr; C,H2,CO(加热条件下)。
五、氧化还原反应的有关规律
1.守恒规律
化合价有升必有降,电子有得必有失。对于一个完整的氧化还原反应,化合价升降总数相等,得失电子总数相等。
应用:有关氧化还原反应的计算技巧及配平氧化还原反应方程式的根本依据。
2.强弱规律
较强氧化性的氧化剂跟较强还原性的还原剂反应,生成弱还原性的还原产物和弱氧化性的氧化产物。
应用:在适宜条件下,用氧化性较强的物质制备氧化性较弱的物质或用还原性较强的物质制备还原性较弱的物质,还能比较物质之间的氧化性或还原性的强弱。
3.价态规律
元素处于最高价态,只有氧化性;处于最低价态,只有还原性;若处于中间价态,既有氧化性又有还原性,但在一个反应中,主要表现一种性质。
应用:判断元素或物质氧化性或还原性的有无。
4.转化规律
氧化还原反应中,以元素相邻价态间的转化最易;同种元素不同价态之间若发生反应,元素的化合价只靠近而不交叉;同种元素相邻价态间不发生氧化还原反应。
应用:分析判断氧化还原反应中的物质变化及推测变化产物。
5.难易规律
越易失电子的物质,失电子后就越难得电子,越易得电子的物质,得电子后就越难失电子;一种氧化剂同时和几种还原剂相遇时,优先与还原性最强的还原剂发生反应;同理,一种还原剂同时和几种氧化剂相遇时,优先与氧化性最强的氧化剂发生反应。
应用:判断物质的稳定性及反应顺序。
-
氧化还原反应知识点归纳
氧化还原反应知识点归纳(氧化还原反应中的概念与规律;氧化还原反应的表示方法及配平。)氧化还原反应中的概念与规律:一、五对概念在氧化…
-
高中化学知识点总结氧化还原反应
燕园教育教师培训手册三氧化还原反应1准确理解氧化还原反应的概念11氧化还原反应各概念之间的关系1反应类型氧化反应物质所含元素化合价…
-
氧化还原反应知识点总结
一氧化还原基本概念1四组重要概念间的关系1氧化还原反应凡是反应过程中有元素化合价变化或电子转移的化学变化叫氧化还原反应氧化还原反应…
-
高一化学之三 氧化还原反应知识点总结
714氧化还原反应知识点一概念氧化还原反应的实质电子的转移电子的得失或共用电子对的偏移口诀失电子化合价升高被氧化氧化反应还原剂得电…
-
氧化还原反应知识点总结
专题四氧化还原反应一氧化还原反应的基本概念1基本概念略氧化还原反应氧化反应还原反应氧化剂还原剂等2知识体系3常见氧化剂1活泼非金属…
-
氧化还原反应知识点归纳
氧化还原反应知识点归纳一、概念1、氧化反应:元素化合价升高的反应还原反应:元素化合价降低的反应氧化还原反应:凡有元素化合价升降的化…
-
氧化还原反应知识点归纳
氧化还原反应知识点归纳(氧化还原反应中的概念与规律;氧化还原反应的表示方法及配平。)氧化还原反应中的概念与规律:一、五对概念在氧化…
-
氧化还原反应知识点总结
专题四氧化还原反应一氧化还原反应的基本概念1基本概念略氧化还原反应氧化反应还原反应氧化剂还原剂等2知识体系3常见氧化剂1活泼非金属…
-
氧化还原反应知识点总结
一氧化还原基本概念1原反应氧化还原反应的特征元素化合价的升降氧化还原反应的实质电子转移2氧化反应和还原反应在氧化还原反应中反应物所…
-
高中化学知识点总结氧化还原反应
燕园教育教师培训手册三氧化还原反应1准确理解氧化还原反应的概念11氧化还原反应各概念之间的关系1反应类型氧化反应物质所含元素化合价…
-
高一化学下册知识点总结
高一化学必修二知识点总结一、元素周期表★熟记等式:原子序数=核电荷数=质子数=核外电子数1、元素周期表的编排原则:①按照原子序数递…