WB-Protocol 免疫印迹实验方法总结(精华)
WB-protocol
配液:
1mol/L Tris-HCl:12.114g Tris-base,加水至100ml,PH6.8
1.5mol/L Tris-HCl:18.7g Tris-base,加水至100ml,PH8.8
10%SDS: 5g电泳级SDS加水定容至50ml,可加热至68℃助溶
 Acrylamide<!> 29g
Acrylamide<!> 29g
30%丙烯酰胺 methylene diacrylamide<!> 1 g
加水至100ml溶解,避光4℃保存
{ 将29g丙烯酰胺和1g N,N’-亚甲双丙烯酰胺溶于总体积为60ml的水中。加热至37℃溶解之,补加水至终体积为100ml。用Pall滤器(0.45μm孔径)过滤除菌,查证该溶液的pH值应不大于7.0,置棕色瓶中保存于室温。}
10% AP:Ammonium persulfate10%(w/v)-20℃保存一个星期,一般一次配1ml。
 Glycine 144g
Glycine 144g
10×running buffer (1L) Tris-base 30g
SDS 10g
加水至1L
1×running buffer (1L): 直接从10×running buffer加水稀释
 Glycine 145g
Glycine 145g
10× transfer buffer (1L) Tris-base 29g
加水至 1L
 10×transfer buffer 100ml
10×transfer buffer 100ml
1×transfer buffer (1L) methanol 200ml
加水至1L
 Tris-base 24.2g
Tris-base 24.2g
10×TBS (1L) Nacl 80g
36%Hcl 约14ml
pH调至7.6,加水至1L
 10×TBS 100ml
10×TBS 100ml
1×TBST (1L) Tween-20 0.5ml(即0.05%,临用时加入)
加水至1L
封闭液(5%):也为抗体稀释液,5g脱脂奶粉溶于100ml 1×TBST配制
 Glycerine 2ml(20%)
Glycerine 2ml(20%)
20×loading buffer(变性剂) bromophenol blue 0.03%(适量)
DTT 0.3ml(3%)<!>
4×upper tris 7.7ml
4×upper tris:Tris-base 12.12g(0.5M)、10%SDS 8ml,PH6.8,总计200ml
1×sample buffer:50mmol/L Tris-HCl(PH6.8),20g/L SDS(电泳级),10%Glycerol
Ponceau S 丽春红: 0.1%, 0.1g溶于5ml冰醋酸;H2O 至100ml,4℃保存。(可重复使用)
DTT
组份浓度: 1 M DTT
配制量:10mL
配制方法:
1. 称取1.545g DTT,加入到15mL塑料离心管内。
2. 加10mL的0.01 M 的NaOAc(醋酸钠)(pH5.2),溶解后使用0.22μm滤器过滤除菌。
3. 适量分成小份后,-20℃保存。
3 M 醋酸钠(NaOAc)(100 ml)
1.称取40.8 g NaOAc•3H2O置于100~200ml烧杯中,加入约40ml的去离子水后搅拌溶解。
2.加冰醋酸调节pH值至5.2。
3.定容至100 ml,高压灭菌后室温保存。
(参照《分子克隆》二版P884)
0.01 M NaOAc (pH5.2) 参照此配方配制。
实验步骤
一、蛋白样品制备
1、 培养细胞的蛋白质样品的制备(还没做过组织的,以后补充)
a、收集:细胞培养至皿(100cm)上长满时,经PBS漂洗3次,加入1ml的1×sample buffer,细胞刮收集,冰上操作,转移至离心管中,置-20℃保存。
b、裂解:超声(超声5s间歇10s,功率100至120w)或注射器反复抽吸破碎,至细胞裂解液澄清不粘稠为止。置于冷冻离心机4℃25000g离心15min取上清;
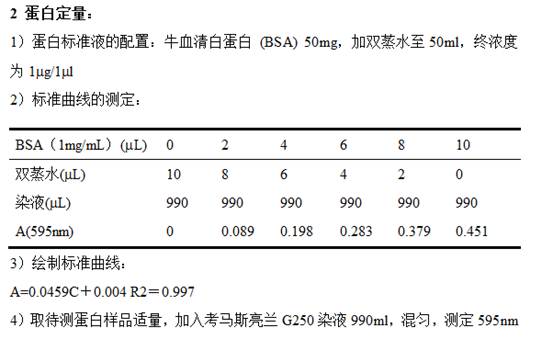
2、 BCA(标准曲线)蛋白定量:
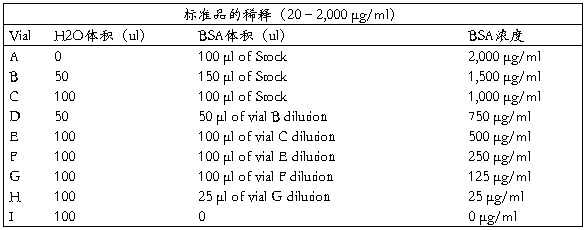
a. 准备蛋白标准品
b. 准备工作液 Working Reagent(A:B=50:1 )
所需体积=(# standards + # unknowns) × (# replicates) × (volume of WR per sample)
c.操作步骤:
1.吸取25ul标准品及待测样品到96孔板(复孔1个),sample/WR=1:8(如果样品量太少多,改为上10ul sample/WR=1:20,检测范围125-2,000 µg/ml)
2.加200ul的WR,摇床混匀1min;
3.合上盖子在37℃孵育30min;
4.冷却至室温,约20-30min
5.在紫外分光光度计562nm下读数
6.画标准曲线,算出待测样品浓度
3、 蛋白变性:在提取的蛋白中按每100ul加5ul 20×loading buffer混匀后,置98℃水浴锅中煮沸10min使蛋白变性。若离心5min可以避免拖尾现象。
二、制胶
1、 分离胶:一般来说,蛋白分子量越小 需要胶的浓度越大,SDS-PAGE分离胶浓度最佳分离范围(6%胶 50-150Kd;8%胶 30-90kD;10%胶 20-80kD;12%胶 12-60kD;15%胶 10-40kD)
按比例配制分离胶,轻缓摇动溶液8~9次,使激活剂混合均匀,配好后灌胶,然后用超纯水封胶。当水和胶之间有一条折射线时(约30min),就可倒去胶上层水并用吸水纸将水吸干。
2、 浓缩胶:沿玻璃板平缓注入凝胶溶液,然后保持水平插梳(上样孔不得留有气泡),静置30min后保证完全聚合。
3、 上样,依次加入蛋白marker和待分析样品,加样时间尽量短,避免样品扩散和边缘效应,可在未加样的孔中加入等量样品缓冲液。
三、 电泳
加样完毕,盖好电泳槽盖子并选择适当恒压,一般浓缩胶80V,20min,分离胶120V,90min,电泳至溴酚蓝跑出凝胶末端处即可停止。(通电时,检查有否气泡产生)
四、电转
电泳结束后,取出凝胶,在预冷电转甘氨酸缓冲液中漂洗数秒;
1、膜的预处理:
按胶的大小剪下相应大小的PVDF膜(在右上角剪一个缺角,作为转膜时正面的标记,下方标注蛋白名称、日期);将PVDF膜于甲醇中浸泡3-5min,放置于转膜液中;
2、按胶的大小剪切转膜用滤纸,共6张,置于转膜液中浸湿5min;
3、将浸透转移液的海绵、滤纸、PVDF膜和胶按下列顺序从下至上放置于湿转膜器中。从下至上为:夹子透明边-海绵-三层滤纸-PVDF膜-胶-三层滤纸-海绵-夹子黑色边。用玻璃棒轻轻碾压,挤出可能存在的气泡;放入转膜器(注意方向,PVDF膜对正极,胶对负极);
4、加入4℃预冷 Transfer buffer,80mA恒流转膜(低温),分子量50KDa左右的蛋白用120min,20KDa左右的用90min。一般转膜电流200mA之间,时间30~60min或15~20mA过夜。大片段(>50KD)可选350mA,小片段可选250mA。滤纸最好不要比膜大,防止短路,各层之间无气泡。槽内夹子两旁放入冰袋。
五、膜的封闭
进行抗体杂交前需对转印膜进行封闭,防止免疫试剂的非特异性吸附,取1×TBS漂洗3次×5min的转印膜,放入5%脱脂奶粉的封闭液内,摇床震动,室温封闭1h。
六、抗体杂交
封闭后的杂交膜放入杂交袋中,加入抗体稀释液稀释的一抗,去除袋内所有气泡,封口,4℃孵育过夜或室温(22~25℃)摇动孵育1h,1×TBST洗膜3次×5min,加入5%脱脂奶稀释的HRP标记二抗(不能加叠氮钠,因为对过氧化酶有抑制作用)室温1h,1×TBST洗膜3次×5min。
七、检测辣根过氧化物酶-ECL法
增强化学发光(ECL)检测是利用辣根过氧化物酶催化化学发光物质,生成不稳定的中间代谢物,其衰变时是在暗室里形成明显的肉眼可见的化学发光带,并可利用X光感光胶片记录发光结果,这里使用SuperSignal West Pico(Thermo)增强ECL发光剂,在暗室将杂交后印记膜放入显色盒中,加上混合好的显色液,用纸巾吸去多余的显色液,加盖一透明玻璃纸并抚平,将印记膜在暗室中使胶片曝光不同时间,其间冲洗胶片以确定所测抗原的最佳曝光时间。
化学显色,显影,定影
(1)将显色发光剂A、B各取1滴(1:1混匀约共1.5ml)滴于PVDF膜上,反应2-3min后,用滤纸将PVDF膜边缘或者边角多余液体吸干,加盖一层透明玻璃纸并抚平,保证干的表面与胶片接触,在暗室中放置胶片,一旦放上,便不能移动,关上暗盒。
(2) 将显影液、自来水和定影液分别到入搪瓷盘中;根据信号的强弱适当调整曝光时间,一般为1min或5min;曝光完成后,打开曝光盒,取出X光片,迅速浸入显影液中显影,待出现明显条带后,自来水冲洗终止显影。显影时间一般为1~3min(20~25℃),温度过低时(低于16℃)需适当延长显影时间;显影结束后,自来水中漂洗数秒,把X光片浸入定影液中,定影时间一般为1min,以胶片透明为止;用自来水冲去残留的定影液后,室温下晾干。

第二篇:免疫印迹(WB法)检测技术
免疫印迹(WB法)检测技术.doc







-
华中科技大学C++实验总结报告(图形编辑器)
C++实验总结报告研究课题:图形编辑器学校:华中科技大学院系:班级:姓名:指导老师:一、实验目的1.熟悉C++的一些重要性质,利用…
-
c语言综合性实验总结
华北科技学院计算机学院综合性实验实验报告课程名称程序设计语言(C)实验学期20##至20##学年第二学期学生所在学院建筑工程学院年…
-
c语言实验 总结
第一次实验的程序1输出HelloWorld程序2运行几个例子程序第二次实验的程序1编写一程序在屏幕上输出如下的内容xxx0002给…
-
关于C语言的实验题自己总结的
实验1的内容和要求1.同学们在上机的时候,请选择开机菜单中的“Develop”项进入系统。2.在实验过程中,你编写的程序不要存放在…
-
c语言实验题目总结
1编写power函数该函数的功能是得到从键盘输入的两个数的X值要求在主函数中调用power函数实现求解从键盘上输入二进制数字要求将…
-
染色质免疫沉淀(ChIP)实验指南及技术总结
染色质免疫沉淀(ChIP)实验指南及技术总结ChIP是一项比较流行的研究转录因子(transcriptionfactor,TF)与…
-
HE染色与免疫组织化学染色实验报告
华中农业大学动物科技动物医学院HE染色与免疫组织化学染色实验报告1实验目的及意义11了解石蜡切片的制作过程12掌握HE染色与免疫组…
-
免疫学实验指导080410
免疫学实验指导生命科学与工程学院生物工程生物技术动物医学专业用冯玉萍分组4人组实验用动物器材以每组需要量设计班级20xx生物工程生…
-
免疫学实验报告1
免疫学实验报告姓名买迪来木坎代尔学号20xx20xx1222班级20xx131实验一多克隆抗体的制备和抗体效价的检测一实验原理有了…
-
免疫学实验教案
键入公司名称免疫学实验教案研究生教育实习潘熙萍Y20xx020120xx114在此处键入文档的摘要摘要通常是对文档内容的简短总结在…