《物理性质和化学性质》评课稿
《物理性质和化学性质》评课稿
张超颖
接连两周,听了两次胡巧玲老师上的《物理性质和化学性质》。本节课是浙教版《科学》七年级上册第四章第六节第一课时的内容。本节内容主要阐述了物理变化与化学变化的概念,通过对概念的学习,了解它们之间本质的区别是是否生成新的物质,从而引入对物理性质和化学性质学习。物理变化与化学变化是自然界与生产生活中非常常见的物质变化形式,通过对这部分知识的学习与应用,可更好地服务于生产与生活。胡巧玲老师能抓住本节教材的重点和难点,以生为本、以启发为主,讲练结合,通过多媒体辅助教学、开展实验探究,使本节课的教学取得了较好的效果。
一、重点突出、目标明确
胡巧玲老师在本课教学中重点突出,目标明确,能抓住物理变化与化学变化的概念这一重点,由小活动引入变化,再从学生身边实例出发,接着列表分析比较,各种物质变化中发生变化的现象,如颜色、状态、温度等,进而寻找各种变化中有没有别的物质生成,从而得出物理变化与化学变化这两个概念。因为这两个概念是构建本节知识的支架,是判断物理变化与化学变化本质区别的基础,是学习物理性质与学生性质的前提,进行有效的练习能对知识进行及时的巩固,也为后续的教学做铺垫。
二、教学设计的评价
教学设计理念依据新一轮基础课程改革《科学课程标准》中:让生活走向科学,让科学走向社会的基本理念,面向全体学生。改变了学生被动接受的传统的教学模式,“在教师引导下的有效学习”贯穿整个课堂教学。整个课堂设计完整、结构紧凑、逻辑严密、前后呼应。
三、教学过程的评价
1.巧设活动,导入新课
胡巧玲老师利用一张纸,让学生动手活动,能让这张纸发生怎样的变化。通过这个小活动不仅引发学生积极思考,也让学生在进行简单的活动后体验到成功的乐趣,为接下来的教学创设了求知的气氛。这样的引入,从一开始就让学生处在浓厚的学习兴趣中,激发学生学习欲望。
2、注重探究,教学方法多样
本节课在教学设计和实际授课中营造了浓厚的探究氛围,让学生始终处于积极的思考和探究活动中。第一次课,探究木炭在氧气中燃烧,盐酸和镁带的反应,第二次课,主要以镁带为主线,探究镁带在空气中燃烧,盐酸和镁带的反应,还有蜡烛燃烧过程的探究。通过探究,引导学生进行有效的观察,并尝试实验现象的描述,从而激发学生的学习兴趣和求知欲,将学生学习不断推向新的高潮。
3、注重情感目标的培养
在教学中,通过教师有序的引导,学生积极的参与、体验、合作、讨论与交流,培养学生具有主动、负责、开拓、创新的个性特征和科学的思维方式。将知识与技能,过程与方法,情感态度和价值观有机的结合。培养学生终身的探索兴趣和科学的学习态度,树立将科学转化为技术服务于人类的意识。在整个教学活动中始终面对全体学生,让每一个学生都有收获,都得到成功的体验,充分体现了全面育人的新课标精神。
四、教学建议
1、由于本节课知识内容比较多,教师在安排上是否能进行有效教学,如删去“化学变化时常伴随着物理变化”内容。
2、对于教师提出的问题,学生有时不能立刻回答,教师逐步引导,引发学生思考,能否再多给学生一点时间进行消化。
3.本节教材有较多的知识是以前几节内容为基础,由于学生未学习,教学中带来一些困难,教师不得不花时间加以解释,造成不必要的拖堂,
4.学生亲身体验探究的过程比较少,小组合作交流的不够有待加强。
第二篇:物理性质与化学性质
第6节 物理性质与化学性质
知识点1:物理变化和化学变化
1, 物理变化:物质从一种状体变成另一种状态,没有新物质生成的变化。(分子、
原子没有发生变化)如:水结冰(液态水变成固态水)铁块拉成铁丝(形状发生改变)矿石粉碎,典升华等。
2, 化学变化:物质从一种状体变成另一种状态,有新物质生成的变化。(分子、
原子发生了变化)如:木炭在氧气中燃烧生成了二氧化碳(原来的木炭变成二氧化碳生成了新物质),钢铁生锈,食物腐烂等,
3, 物理变化与化学变化的本质区别:变化时是否有新的物质生成。
4, 物理变化与化学变化的联系:化学变化过程中一定伴随物理变化
5, 注意事项:化学变化常伴随着发光、发热等现象,但发光、发热等现象产生
的变化却不一定是化学变化。如灯泡发光发热就是物理变化。
知识点2:物理性质和化学性质
1,物理性质:物质不需要发生化学变化就能表现出来的性质叫做物理性质。如颜色、状态、气味、熔点、沸点、硬度、溶解性、延展性、导电性、导热性、挥发性、磁性等
2,化学性质:物质在化学变化中变现出来的性质叫做化学性质:如可燃性、酸碱性、稳定性等。
3.,物理(化学)变化和物理(化学)性质的区别:物质的变化是一个过程,而物质的性质是指物质固有的属性。
4,例题:下列叙述中,哪些属于物理性质的描述( ),哪些属于化学性质描述( ),哪些是物理变化的描述( ),哪些是属于化学变化的描述( )。 ①木炭燃烧 ②木炭能燃烧 ③木炭是黑色的 ④块状木炭碾成碳粉
5,注意事项:酸味是物理性质,不是化学性质。
知识点3:酸性物质和碱性物质。
1,酸性物质:醋酸、盐酸、硫酸、硝酸等都是酸。
食醋是一种酸溶液,具有酸性。平时吃的果汁含有某些酸,具有酸性。某些地方的雨中含有某些酸,也具有酸性。不同的酸性物质的酸性强度是不同的。
2,碱性物质:烧碱(氢氧化钠)、熟石灰(氢氧化钙)、氢氧化钾、氢氧化钡、氨水等都是碱。另外小苏打、纯碱、洗涤剂等的水溶液都具有碱性。碱性物质的碱性也有强弱。某些碱性物质(洗涤剂)有一定的去污能力。
3,例题:
①下列说法正确的是( )
A 碱与酸大部分具有很强的腐蚀性,使用时不要直接接触。
B 洗涤剂有较强的去污能力,它属于强碱。
C 紫色石蕊试液能使酸溶液变红
D 酸雨对植物不会造成太大的伤害
②下列物质中不属于强酸的是( )
A 浓盐酸 B 浓醋酸 C 硫酸 B 硝酸
知识点4:溶液酸碱性的测定
我们怎样来判断哪些物质呈酸性,哪些物质呈碱性呢?
1, 最简单的方法就是使用石蕊试液,
2, 紫色石蕊试液变???红色?遇酸?无色酚酞试液?变???蓝色?遇碱?不???变色?遇酸??变???红色?遇碱?
3, 酸碱指示剂只能对溶液的酸碱性作出一个定性的判断。
4, 酸或碱溶液使指示剂变色,而不是指示剂使酸或碱溶液变色。
知识点5:溶液的酸碱度的测定
1,酸碱度:物质的酸碱性的强弱。
2,测定酸碱度的方法:测定酸碱度最常用、最简单的方法是使用pH试纸。
测定方法:用洁净的玻璃棒蘸取被测试的溶液,滴在pH试纸上,将试纸显
示的颜色与标准比色卡对照,即可得出被测液体的pH值。
3, pH值的数值是反映物质酸碱性强弱的指标。pH的范围通常在0~14之间。
酸性溶液的pH<7, pH越小,酸性越强;
碱性溶液的pH>7,pH越大,碱性越强:
中性溶液的pH=7,
4, 注意事项:
①测定溶液的酸碱性常用石蕊试液;测定溶液的酸碱度常用pH试纸,用pH
表示溶液的酸碱度。
②测定溶液的pH时,不能把pH试纸浸泡在待测液中,以免污染待测液。
不能把pH试纸先用水湿润在滴待测液,以免使待测液变稀,造成误差。
③pH试纸测试方法比较粗略而且测出的是整数值,精确的测试可使用一种
称为酸碱计的仪器。
5, 例题:
①在氢氧化钠溶液里加入1~2滴无色酚酞试液,然后逐渐滴入稀盐酸。直到反
应完成,在整个过程中溶液的颜色变化为( )
A红色→无色→红色 B 红色→无色→无色
C无色→红色→无色 D无色→蓝色→无色
②小明用紫色石蕊试液测定某饮料的酸碱性,结果发现石蕊试液变红色,则该饮
料为( ) A 碱性B 中性 C 酸性 D无法判定
③我国土壤的分布情况大体是“南酸北碱”,南方农民引淡水冲洗以降低其酸性,在下图中
符合冲洗过程酸碱性变化的曲线是
( )
A B C D
知识点6;
溶液的酸碱性与人体生命活动的关系
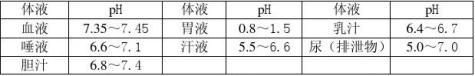
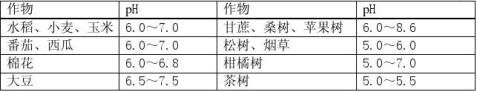
溶液的酸碱性与作物生长的关系
-
初中化学评课稿
20xx-20xx学年度第二学期教学工作总结赵雄20xx年x月x日本学期我担任九年级(5)、(7)班的化学教学工作和(5)、(6)…
-
化学万能评课稿
化学评课稿:《酸和碱之间会发生什么反应》评课稿今天听了***老师《酸和碱之间会发生什么反应》的这节课,令我印象尤为深刻的主要特点我…
-
化学评课稿
化学评课稿来源作者汤福生录入人汤福生发布时间20xx5592936化学评课稿评课人南京市天景山中学汤福生课题水的相关问题探究执教者…
-
化学评课稿
化学评课稿质量守恒定律评课稿邵逸夫中学张秀清20xx年12月质量守恒定律是自然科学基本定律之一是初中学生在化学科学习中第一次接触严…
-
九年级化学评课稿
评课稿一从教学目标上分析这节课在语言知识上从词汇方面为学生提供了大量的词汇从话题上讨论了的背景及基础知识从功能句上练习了一些发表个…
-
化学万能评课稿
化学评课稿:《酸和碱之间会发生什么反应》评课稿今天听了***老师《酸和碱之间会发生什么反应》的这节课,令我印象尤为深刻的主要特点我…
-
初中化学评课稿
20xx-20xx学年度第二学期教学工作总结赵雄20xx年x月x日本学期我担任九年级(5)、(7)班的化学教学工作和(5)、(6)…
-
初中化学说课稿模板
《酸碱盐的实验复习课》说课稿一、教材及中考分析酸碱盐的复习是初中化学复习的重点,也是难点,在教材中有很重要的地位,酸碱盐与现实生活…
-
沪教版初三化学说课稿
沪教初三化学说课稿全集第一章开启化学之门第一节化学给我们带来什么?《化学给我们带来什么》说课人:HaferHighschoolSm…
-
初中化学说课稿:《溶解度》说课稿范文
初中化学说课稿溶解度一教材分析本课题分为饱和溶液和溶解度两部分以学生亲身参与的两个活动与探究和两个讨论为线索组织教学过程第一个活动…
- 初中物理说课稿:八年级物理《光的反射》说课稿范文