化学试卷分析
泉湖中学20xx年区一考化学试卷分析
孟卫东
一、试题分析
(一)试题结构
20xx年区一检化学试题总题数为17小题,满分60分。其中选择题10小题共20分,所占分值比例为30%;填空题5小题共33分,所占分值比例为55%;实验与探究题2小题共17分,所占分值比例为24%;计算题2小题共7分,所占分值比例为11%。容易题、中等题、较难题的分值比例为5:3.2:1.8。与近两年中考化学试题相比难度略有下降,具体表现为:“送分题”约只有9%左右;“选拔题”约占22%左右;其余大多数题目难度中等,且均有一定答题障碍(主要表现在学生读题有困难、部分题目分析潜在考点、知识点有一定难度);答题容易犯细节性错误。
(二)试题特点
20xx年区化学一考试题的特点,可总结为“四个注重,一个淡化”
1、注重重点,强调实验操作和溶液知识的应用;
2、注重基础,强调常规题型;
3、注重联系生活,强调与时俱进;
1
4、注重方法指导,强调锻炼学生逻辑思维能力;
5、淡化计算,强调计算的基础性和实用性。
二、试卷分析
(一)试卷常见错误分析
选择题第6题,错误较多,可能是题干本身设有阅读障碍、记忆不准确、审题不清,正确答案应该是C,部分同学选A。
选择题第7题,学生对此类题的解题技巧没有很好掌握,错误率较高。
选择题第10题,学生对此类反常规题还不能正确分析。所进行的训练也是加热一定量的高锰酸钾横轴为KMnO4的量,纵轴为释放氧气的量,一变为时间和剩余固体的量学生就还是按常规去分析,至使错误率较高。
实验题14,15题是推断题,主要考察学生对化学方程式的掌握情况及分析问题、解决问题的能力。常见错误:方程式、反应条件、化学式没有记下,审题不仔细、做题方法没有掌握。
第16题是属于送分题,是本试卷失分最少的一题。错误,但也有个别学生分子式量算错,以致连代分子式中元素的质量比出错、答题不准确。
17题为一个5分计算题,得分率较差。常见错误:少数由于基本功不扎实无法动笔,个别学生由于粗心出现错误, 2
仍是化学式量算错造成全盘皆输。部分学生溶质的总量都已计算正确,而溶液的总量出现计算结果错误。此题,不是满分就是一分或零分,两极分化严重。
(二)答题中暴露出的问题归纳
1、审题不严密。学生对试题一知半解、忽略了试题解答的限制条件,导致学生答题不准确或完全错误。
2、学生化学基础知识不扎实。因基础知识掌握不牢造成的失分现象非常普遍。在为数不多的几个方程式中化学方程式的书写不到位,化学式书写错误,缺少条件,未写气体符号和沉淀符号等的情况相当普遍;不知道混合物中的除杂不能在生成物中出现第三种物质等等。不难看出这些试题失分的主要原因并不是题目本身难度大,而是学生化学学习兴趣不高以至对这些最基本的化学知识掌握不牢固导致的。
3、化学用语表达不规范、文字表达能力差。如:元素符号的书写大小写字母问题,错字、别字,物质化学式书写张冠李戴等,近年来试题的开放性较强,对学生的文字表达能力要求较高,但从学生的答题情况看,一些学生的文字表达能力较差。
4、科学探究、读图识图、实验能力较弱。本套试题着重考查了学生的实验探究和分析能力、实验评价的能力、实验与计算相结合能力、获取和处理信息的能力、表达能力等。解题中反映出学生不能正确分析图象所表示的化学含义,获 3
取与处理信息的能力较弱,因此,得分率较低。
三、成绩分析及试题评价
(一)成绩分析
今年中考,从二个班52份试卷来看,我校化学学科考试的平均分为41.7分,合格率(以30分计)为96%,优秀率(以40分计)为80%,从一分二率的情况来看,成绩情况比较不好。从抽样调查的试卷中,客观题得分率为55.8%;主观题得分率为41.8%。从整卷来看,基础题得分率一般,学生分析、解决问题的能力、实验探究能力、综合思考问题能力普遍偏低。学生对知识的理解和运用能力有待进一步提高。但总体看来,学生对最简单基础知识的掌握方面是值得肯定的。具体请看下表:
(二)试卷评价
1、立足教材,侧重学以致用。试题特别注重考查了学生适应现代生活及未来社会所必需的基础内容,而且从应用入手,紧密联系社会生活实际,以学生的生活实际为切入点,以日常生活和社会建设所用到的化学知识为背景,融入社会生活中的实际问题,让考生在熟悉的生活情景中,运用最基础的化学知识解决生活中的一些实际问题。这些试题为学生体验化学与科学、技术、社会、生活的紧密联系创设了丰富多彩的生产生活情境,既考查了学生运用化学知识解决实际 4
问题的能力,又促使学生体验化学的应用价值,感到学有所得,学有所用,体现了“生活中处处有化学”。
2、紧扣双基,着重化学基本素养。今年中考化学试题内容考查知识面宽、覆盖面大,减少了考查的偶然性和片面性。试题将化学的基本知识放在真实的情境中,通过学生对问题情境的分析和解决的过程,来考查学生利用所学的化学知识来分析和解决具体问题的能力,考查了学生的化学基本素养。
3、注重实验,考查科学探究能力。化学是一门以实验为基础的学科,其中科学探究的能力是新课程标准提出的重要内容。加强实验考查的力度,有利于培养学生利用化学知识解决实际问题的能力,也有利于培养学生的阅读分析能力、信息处理能力、实验操作能力、文字表达能力。
4、源于教材,精心设计。今年中考试题的许多题目学生感到“似曾相似”又有所不同。
四、命题与教学建议
通过以上对20xx年庆阳市化学中考试卷的分析,在以后的化学命题与教学过程中应注意以下几点:
1、重视基础,强调应用
无论是容易题还是难题,无论是客观判断题还是主观分析题,都是以重要的基础知识为依托展开的。实践表明,初中化学中的那些最基本、最核心的内容,始终是中考重点。 5
坚实的化学基础知识,清晰的化学知识结构,是运用已有知识解决新问题的重要基础,所以对化学基础知识和基本技能应准确把握,并扎扎实实地落实到位,防止进行“超纲”性学习,已经明确的不作要求或降低要求的内容,不再往高处拔。
2、重视教材,强调知识的全面性
加大对教材知识的重视程度,要能够挖掘教材中的隐含考题,注意教材知识的覆盖面要加大。要特别重视教材中有关化学知识与社会、化学知识与生活相关的内容。
3、重视化学与社会、生活、环境的联系
建议关注每年发生的新闻事件,特别是与之相关的化学物质。关注国家大的方针、政策性趋势性考题。
4、重视学生的实验探究能力
实验是自然科学的一种探究性活动,其探究性原理应体现在我们的学习活动中。加强实验教学,不仅要培养观察能力和实验操作能力,还要通过一些探究性的实验培养学生的实验设计能力,培养创新意识和创新思维品质。在化学实验中,值得我们去探究的问题有很多,例如探究反应条件、探究实验装臵、探究实验原理、探究实验步骤等。我们应经常把知识和技能应用到化学实验、生产生活的实际问题中去,使学生得到运用化学知识和技能分析问题、解决问题的训练,在实践中提高能力。
6
5、要强化学生审题能力和分析能力
学生细心审题、深刻理解题意和分析题意也是化学教学的重点。
二〇一〇二年四月二十五日
7
第二篇:分析化学试卷3
《分析化学》课程试卷(3)
一、填空题(1-6小题每空1分,其余每空0.5分,共35分)
1.在滴定分析中,滴定管、移液管和吸量管在用自来水充分冲洗后,再用蒸馏水润洗内壁2~3次,在正式装入操作溶液前,还要用 荡洗内壁2~3次。
2.把试样装在称量瓶内,称量后倒出1份试样,再称量,前后两次称量的质量之差即该份试样的质量。这种称量方法称为 。
3.若配制1L 0.2 mol·L-1 HCl 溶液,需取6 mol·L-1 HCl mL。
4.已知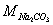 = 106.0 g·mol-1,某试样中含Na2CO3约20%,要求滴定时消耗0.2 mol·L-1 HCl 溶液约25mL,应称取试样约 g。
= 106.0 g·mol-1,某试样中含Na2CO3约20%,要求滴定时消耗0.2 mol·L-1 HCl 溶液约25mL,应称取试样约 g。
5.已知MNaOH = 40.00 g·mol-1,TNaOH/HCl = 0.004000g·mL-1,则cHCl = mol·L-1。
6.已知CaF2的Ksp = 2.7×10-11,CaF2在纯水中的溶解度s = mol·L-1。
7.进行滴定操作时,应用 手持滴定管;移取溶液时应用 手持移液管。
8.常量分析的分析结果一般以 位有效数字报出,计算误(偏)差时一般保留 位有效数字;pH12.68这个数据含有 位有效数字。
9.按分析的任务,分析化学可以分为 分析、 分析和 分析三部分。
10.一般化验室日常生产中的分析称为 分析。由国家标准局组织制订和颁布的标准分析法称为 ,代号为 。
11.定量分析过程包括的主要步骤为:试样的采集→ →试样分解→ → 。
12.准确度指 接近的程度,准确度的高低用 来衡量。精密度指 接近的程度,精密度的高低用 来衡量。
13.在滴定分析中,滴加标准溶液的操作过程称为 ,滴加的标准溶液与被测组分定量反应完全的这一点称为 ,指示剂颜色发生突变而终止滴定的这一点称为 ,因此两点不一定恰好吻合而引入的误差称为 。
14.分析浓度皆为0.10 mol·L-1的HCl和HAc溶液,HCl溶液的pH = ;HAc(pKa= 4.74)溶液的pH = 。
15.Ac-的分布分数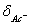 = ,Ac-的酸效应系数
= ,Ac-的酸效应系数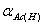 与
与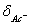 之间和关系为 。
之间和关系为 。
16.酸碱指示剂的理论变色点为pH = ,理论变色范围为pH = 。酸碱滴定中,选择酸碱指示剂的原则是 。
17.在酸碱滴定中,指示剂法的终点检测精度ΔpH≈0.3,滴定一元弱酸,若允许误差Er = 0.2%,用指示剂法准确滴定的界限(判据)是 。滴定二元酸H2A(Ka2>10-8),Er = 0.5%,进行分步滴定的判据是 。
18.根据质子理论,Al(OH)3是 ,接受H+生成 ,给出H+生成 。
19.在络合滴定中,最常用的络合剂是 ,该试剂的中文名称是 ,其二钠盐试剂的化学式一般用 表示;它与大多数金属离子形成1∶ 的络合物。
20.在络合滴定中采用的滴定方式有 、 、 和 四种,其中测定过程最简便的滴定方式是 。
21.在氧化还原滴定中使用的指示剂有 、 和氧化还原指示剂三类,选择氧化还原指示剂的原则是 。
22.I2标准溶液常用 法配制;在滴定时应使用 式滴定管来装盛I2标准溶液。I2标准溶液应贮于 试剂瓶中,于暗处保存。
23.影响沉淀溶解度的主要因素是: 、 、 、 以及温度、溶剂、沉淀颗粒的大小和结构等。
24.沉淀滴定法常用的是银量法,银量法根据指示剂的不同,可分为 、 、 三种。
25.萃取效率E = ;在纸层析和薄层层析中,比移值Rf = 。
二、选择填空题(共13分,请把选项的序号填在括号内)
1(2分).在下面的各操作步骤中,应使用何种玻璃量具?
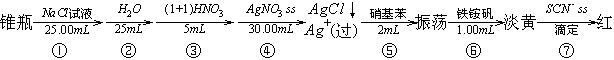
①( );②( );③( );④( );⑤( );⑥( );⑦( )。
A、滴定管 B、移液管 C、刻度吸量管 D、量筒
2(2分).在下列情况下,( )引起系统误差,( )引起随机误差。
A、把25.35mL错记为25.53mL; B、重量法测定硫时,BaSO4溶解损失;
C、气温的微小波动,引起仪器微小变化; D、滴定管刻度不准,又未经校准。
3(2分).根据质子理论,下列物质中,( )是酸,( )是碱,( )是两性物质。
A、NH4+ B、H2NCH2CH2NH3+ C、HPO42- D、Ac-
4(1分).碘量法测定铜时,应控制溶液酸度为pH3~4,应选择( )酸碱缓冲溶液。
A、HF-NH4F,HF的pKa = 3.46;
B、HAc-NaAc,HAc的pKa = 4.74;
C、(CH2)6N4H+-(CH2)6N4,(CH2)6N4H+的pKa = 5.15;
D、NH4Cl-NH3·H2O,NH4+的pKa = 9.26。
5(1分).若在 pH10 的氨性缓冲溶液中用EDTA标准溶液滴定Ni2+,已知 lgKNiY = 18.67,lgαY(H) =0.45,lg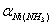 = 4.17,此时( )。
= 4.17,此时( )。
A、lgK/NiY = 18. 22,不能准确滴定Ni2+; B、lgK/NiY = 14. 05,能准确滴定Ni2+;
C、lgK/NiY = 14.50,能准确滴定Ni2+; D、lgK/NiY = 14. 05,不能准确滴定Ni2+。
6(1分).在络合滴定中,金属指示剂与某些金属离子生成极稳定的络合物,以致在sp或sp后溶液不变色的现象称为指示剂的( );指示剂与金属离子形成的络合物在水中的溶解度小,使滴定终点变色缓慢导致终点拖长的现象称为指示剂的( )。
A、钝化作用 B、僵化现象 C、氧化变质现象 D、封闭现象
7(1分).Fe3+与F- 作用生成稳定的FeF63-,在含Fe3+和Fe2+的溶液中加入NH4F后,Fe3+/Fe2+电对的电极电位将会( )。
A、增大 B、减小 C、不变
8(1分).聚集速度主要取决于沉淀条件,定向速度则取决于沉淀物质本身的性质。构晶离子的聚集速度大,定向速度小,则一般得到( )。
A、粗晶形沉淀 B、细晶形沉淀 C、非晶形沉淀
9(2分).从给出的试剂中选择一种最合适的试剂分离下列混合物质:
Fe(OH)3+Al(OH)3 ( ); BaSO4+PbSO4 ( );
Bi3++Fe3+ ( ); Al3++Zn2+ ( )。
A、NH4Ac B、H3PO4 C、HCl D、NaOH E、NH3·H2O
三、计算题(每小题8分,共32分)
1.测定某试样中ZnO的含量,得结果如下:21.34%,21.37%,21. 50%,21.35%,21.33%。先用Q检验法确定21. 50%这个数据是否保留(置信度为95%,n=5时,Q0.95=0.73),然后再计算平均值 ,平均偏差
,平均偏差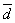 ,相对平均偏差
,相对平均偏差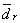 ,标准偏差s,变异系数CV。
,标准偏差s,变异系数CV。
2.计算下列溶液的pH:① 0.20mol·L-1NH4Cl溶液;② 0.20mol·L-1NaAc溶液;③ 200 mL 0.50mol·L-1 NH3·H2O和50.0 mL 0.50 mol·L-1 HCl的混合溶液。(用最简式计算,已知NH3的pKb = 4.74,HAc的pKa = 4.74。)
3.称取含Fe2O3和Al2O3的试样0.5000g,溶解后定量转入250mL容量瓶中,加水至刻度。移取上述试液25.00mL,在pH2时以磺基水杨酸作指示剂,用0.02008mol·L-1EDTA ss滴定Fe3+,消耗15.20mL。再加入上述EDTA溶液25.00mL,煮沸使Al3+完全络合,调至pH4.5,以PAN作指示剂,趁热用0.02112mol·L-1Cu2+标准溶液返滴过量的EDTA,用去8.16mL。计算该试样中Fe2O3和Al2O3的质量分数。(已知: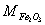 = 159.7g·mol-1,
= 159.7g·mol-1,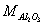 = 102.0g·mol-1)
= 102.0g·mol-1)
4.用Ce(SO4)2标准溶液滴定Sn2+的反应如下:
Sn2+ + 2Ce4+ = 2Ce3+ + Sn4+
求该反应的条件平衡常数lgK/,化学计量点电位Esp和化学计量点附近的电位突跃范围。(已知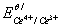 = 1.44v,
= 1.44v,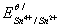 = 0.14v。)
= 0.14v。)
四、问答题(每小题5分,共20分)
1、在酸碱滴定法中,讨论滴定曲线有何作用?
2、在络合滴定中,为什么要用酸碱缓冲溶液严格控制溶液酸度?
3、用Na2C2O4作基准物标定KMnO4 ss 的操作如下:
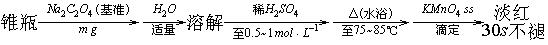
① 写出标定反应和计算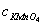 的计算公式。
的计算公式。
② 为什么要加稀H2SO4至0.5~1mol·L-1?酸度过高或过低有何不利影响?
③ 为什么要水浴加热至75~85℃?温度过高或过低有何不利影响?
4、在重量分析中,沉淀晶形沉淀的条件是什么?
-
20xx-20xx化学试卷分析
20XX20XX化学试卷分析20XX20XX学年第一学期期末化学试卷分析本次考试试题考查学生的化学基础知识与基本技能、学习化学的过…
-
高一年级下学期期中考试化学试卷分析
高一年级下学期期中考试化学试卷分析一、试卷分析:本次期中考试是对学生半学期以来所学知识的一次检测,为教师便于教师了解学生学习中存在…
-
初三化学试卷分析
初三化学试卷分析一、试题分析:本试题充分体现了《考试说明》的要求,考试内容紧紧围绕“化学-生活-技术”这一主线展开,充分体现化学学…
-
高三化学试卷分析与阶段复习总结
高三化学试卷分析与阶段复习总结高三化学组韦婉雯一、试卷的整体分析试卷体现了新课标的教学理念,着重考查学生对化学基础知识掌握的程度,…
-
初三化学试卷分析模板
20XX---20XX学年期中测试卷分析_区初三化学(一)、试卷评析1、结构合理,难易适中,全卷共有4个大题,32个小题,题型丰富…
-
高三化学试卷分析与阶段复习总结
高三化学试卷分析与阶段复习总结高三化学组韦婉雯一、试卷的整体分析试卷体现了新课标的教学理念,着重考查学生对化学基础知识掌握的程度,…
-
初三化学试卷分析
初三化学试卷分析一、试题分析:本试题充分体现了《考试说明》的要求,考试内容紧紧围绕“化学-生活-技术”这一主线展开,充分体现化学学…
-
高一年级下学期期中考试化学试卷分析
高一年级下学期期中考试化学试卷分析一、试卷分析:本次期中考试是对学生半学期以来所学知识的一次检测,为教师便于教师了解学生学习中存在…
-
20xx-20xx化学试卷分析
20XX20XX化学试卷分析20XX20XX学年第一学期期末化学试卷分析本次考试试题考查学生的化学基础知识与基本技能、学习化学的过…
-
20xx年初中毕业会考暨高中招生化学试卷分析报告
庆阳市20xx年中考化学试卷分析报告化学评卷组王朝志朱恩琴一试题分析一试题结构20xx年庆阳市化学中考试题总题数为18小题满分10…