化学试卷分析
2015届高三上学期第一次段考化学分析
一、 化学成绩分析
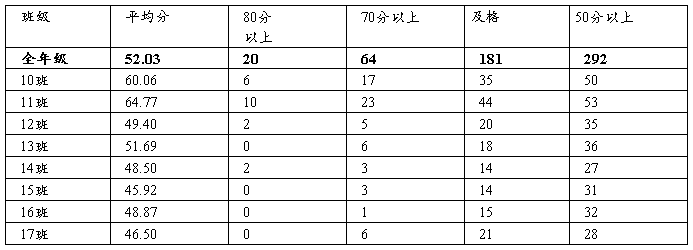
二、试卷以及学生答题情况分析
选择题考察的知识点覆盖范围广,涉及了氧化还原反应、物质的量、离子共存、元素周期表、有机化学、溶液三大守恒,现象结论因果关系等。其中失分较为严重的有第7题有机常识题,在以后教学中要叫学生有意识的积累有机常识的知识。另外22题双选题考察溶液中的粒子大小关系比较得分率很低,此模块知识对于学生来说也是难点,同时也是高考的重点,在以后教学中要循规渐进慢慢惨透这方面的知识。
30题:本题主要考察有机物的相关性质,题目的难度适中,考点覆盖面较广,主要考察的内容有:一、官能团的名称书写;二、反应类型的判断;三、酯化反应的书写;四、有机中和反应的书写;五、同分异构体的书写;六、酚类、不饱和有机物性质的判断。从答题的情况来看,学生的作答情况良好,基本能够完成。暴露出来的问题有几点:一、官能团字体书写错误;二、有机物书写马虎,乱涂乱画和连笔较为突出;三、漏写;四、同分异构体的书写没有审题清楚,胡乱作答;五、方程式书写的配平和条件混乱。当然,总的来讲,瑕不掩瑜,本次学生对于有机题的把握应该来说是相当不错的。
31题结合了高中化学原理所涉及的化学反应与能量、化学平衡的内容,考查考生知识拓展、综合分析及归纳总结规律的能力。从卷面情况来看,(1)盖斯定律的应用,很多同学都掌握的很好,一小部分的同学写的时候会少了前面的负号。(2)关于化学平衡的问题,本小题中很多同学对于A、B点的平衡常数的判断出错,忘了平衡常数只与温度有关。有些同学审题不清,忽略条件:结果保留两位有效数字,部分同学写出来的结果是分数或者1.33,还忘了带上单位。(3)对于电极反应平时的练习较少涉及到,所以很多学生都忘了如何写电极反应。总体来说,本道题的得分没有预想中的高,主要原因是学生对于一些知识点没有常用而遗忘。接下来复习过程中对于练习的讲解要多多延伸,多拓展,帮助学生加强记忆。
32题是工业流程图,题目难度适中,用锌渣来制取氧化锌。主要考察的内容有:1、影响化学反应速率的因素有哪些;2、过滤所需要的仪器有哪些;3、根据题给信息分析流程图每一步的目的 4、推测相关化学方程式。从学生答题情况上看,得分没有预想的高。主要存在问题有:1、答题不全面,只能回答其中的其中一点,漏写;2、基础不扎实,且不会灵活应用所学知识;3、不会根据题给信息推出化学方程式,或漏写某个生成物、或漏写反应条件,或没有配平。4、答题不规范,不能用化学用语规范答题。
接下来复习过程中要注重基础,强化学生规范答题,练习讲解适当延伸,拓展,帮助学生加强记忆。
33题实验探究题,考察了反应速率和实验结合起来的具体应用,同时考察了离子的验证检验。学生基本思路都有,但答题不规范,思维严谨性欠佳,所以并不能拿到很高的分数。
三.措施
1、抓基础、重应用,要注重基础知识的教学,对记忆性的概念和原理等要在理解和实际运用的基础上加强记忆。要进一步强化课堂教学目标的达标率,课堂教学要实在、有效。要加大对学生思维能力的训练,要能用所学的知识分析和解决有关的化学问题。
2、加大学生的做题量,及时复习,对于学生的易错点、易漏点反复强调,让学生在重复的过程中记忆、理解、应用。
3、培养学生良好的学习习惯,平时做题不但要注重质量而且要加快速度,字迹要整洁、大方,按题意完成题目。
4、多鼓励、关心学生,肯定学生的每一次进步,培养学生的学习信心,激发学生的学习兴趣。
第二篇:分析化学试卷9及答案
一、选择题 ( 共 9题 18分 ) 1. 2 分
不能用作对照试验的试样是-------------------( ) (A) 标准试样 (B)管理试样
(C) 组成类似的试样 (D) 人工合成试样
2. 2 分
用佛尔哈法测定Ag+,滴定剂是------------------- ( ) (A)NaCl (B)NaBr (C)NH4SCN (D)Na2S
3. 2 分
在下列溶液中,用1.0×10-2mol/L EDTA 滴定1.0×10-2mol/L Zn2+ 至化学计量点时, pZn'最小的是-----------------------------------( )
(A) pH=9.0, [NH3]=0.01mol/L (B) pH=10.0, [NH3]=0.01mol/L (C) pH=9.0, [NH3]=0.05mol/L (D) pH=10.0, [NH3]=0.15mol/L
4. 2 分
在下列4个量中表征有限次测定数据集中趋势的是-----------( ) (1) 算术平均值 (2) 中位数M
(3) 总体平均值μ (4) 真值
(A)1,2 (B)3,4 (C)1,3 (D)2,4
5. 2 分
用重量法测定试样中的砷,首先使其形成Ag3AsO4沉淀,然后转化为AgCl,并以此为称量形式,则用As2O3表示的换算因数是---------------------------------------( )
(A) Mr(As2O3)/Mr(AgCl) (B) 2Mr(As2O3)/3Mr(AgCl) (C) 3Mr(AgCl)/Mr(As2O3) (D) Mr(As2O3)/6Mr(AgCl)
6. 2 分
已知乙二胺(L)与Ag+形成络合物的lgb1,lgb2分别为4.7与7.7,当AgL络合物为主要存在形式时,溶液中游离L的浓度范围是-------------------( ) (A) 10-4.7>[L]>10-7.7 (B) 10-3.0>[L]>10-7.7 (C) 10-3.0>[L]>10-4.7 (D) [L]=10-4.7
7. 2 分
在下列溶液中,以0.020 mol / L EDTA滴定同浓度的Zn2+至化学计量点时,pY?计值最小的是……………………… ( )
( A ) pH = 10 .0, [ NH3 ] = 0.02 mol / L ( B ) pH = 10.0 , [ NH3 ]
= 0.05 mol / L
( C ) pH = 10.0 , [ NH3 ] = 0.1 mol / L ( D ) pH = 10.0 , [ NH3 ] = 0.2 mol / L
8. 2 分
在下列两种情况下,以EDTA滴定相同浓度的Zn2+;一是在pH = 10.0的氨性缓冲溶液中,二是在pH=5.5的六次甲基四胺缓冲溶液中。叙述滴定曲线pZn突跃范围大小正确的是
………………………( )
( A )突跃范围大小相同 ( B )前者pZn的突跃范围比后者大
( C )前者pZn的突跃范围比后者小 ( D )上述三种情况都有可能
9. 2 分
指出下列叙述中错误的结论-----------------( )
(A) 络合剂的酸效应使络合物的稳定性降低
(B) 金属离子的水解效应使络合物的稳定性降低
(C) 辅助络合效应使络合物的稳定性降低
(D) 各种副反应均使络合物的稳定性降低
二、填空题 ( 共14题 32分 )
1. 3分
某(NH4)2HPO4溶液c[(NH4)2HPO4] = c mol/L,其物料平衡式为____________
________________; 电荷平衡式为___________________ ______
________________。
2. 3 分
正态分布的?称为__________,?称为___________,其曲线的概率密度函数为______ _____________。
3. 2 分
用K2Cr2O7法测定铁, 试样重 1.000 g, 若使滴定管上的 K2Cr2O7 溶液体积读
数在数值上恰好等于试样中铁的质量分数, 则配制 K2Cr2O7溶液的浓度为
__________ ________________mol/L。
[Mr(K2Cr2O7)= 294.2, Ar(Fe)= 55.85]
4. 2 分
(Ⅰ)试液中含有SO42-,(Ⅱ)试液中含有Ba2+。欲用BaSO4重量法测定其含量,
已知两种试液中均含有H+、Mg2+、K+、Na+、NO3-杂质。则(Ⅰ)试液中扩散层优先吸
附的离子是______;(Ⅱ)试液扩散层优先吸附的离子是____。
5. 2 分
国产721型分光光度计单色器元件是 ________, 检测器(接受器)元件是 _________。
6. 2 分
EDTA滴定中, 介质pH越低, 则?Y(H)值越____, K'(MY)值越____, 滴定的pM'
突跃越____,化学计量点的pM'值越____。
7. 2 分
8. 2 分
各级试剂所用的符号为(填A,B,C,D)
(1) 一级 _____________ (A) A.R.
(2) 二级 _____________ (B) C.P.
(3) 三级 _____________ (C) G.R.
(4) 四级 _____________ (D) L.R.
9. 2 分 常用的分解试样的方法有:?????????? 法、?????????? 法、?????????? 法。
根据有效数字的运算规则,下面算式的结果应为______。
0.1000×(25.00-21.25)×0.1020
────────────
1.5021
10. 2 分
卤化银对卤化物和各种吸附指示剂的吸附能力如下: 二甲基二碘荧光
黄>Br->曙红>Cl->荧光黄。如用法扬司法测定Br-时,应选________指示剂;若测定Cl-,应选______指示剂。
11. 2 分 (3120)
某人误将参比溶液的透射比调至98%,而不是100%, 在此条件下测得有色溶液的透射比为36%,则该有色溶液的正确透射比应为_________%。
12. 2 分
某溶液含有M和N两种金属离子,已知K(MY) > K(NY)。lg K?(MY)先随溶液的pH增加而增大,这是由于 ________________;而后当pH增加时,lg K?(MY)保持在某一定值(N在此条件下不水解),这是因为_______________ _________________。
13. 4分
下列基准物常用于何种反应? (填A,B,C,D)
(1) 金属锌 ___________ (A) 酸碱反应
(2) K2Cr2O7 ___________ (B) 络合反应
(3) Na2B4O7·10H2O ___________ (C) 氧化还原反应
(4) NaCl ___________ (D) 沉淀反应
14. 2 分
单盘天平优于双盘天平是因为其______恒定,没有_____误差,缩短了_______的时间。
三、计算题 ( 共 4题 30分 )
1. 10 分
某一溶液由HCl,KH2PO4和HAc混合而成,其浓度分别为c(HCl) = 0.10 mol/L,
c(KH2PO4) = 1.0×10-3mol/L, c(HAc) = 2.0×10-6mol/L 。计算该溶液的pH及
[Ac-],[PO43-]各为多少?
(已知H3PO4的pKa1~pKa3分别是2.12,7.20, 12.36, HAc 的pKa = 4.74)
2. 5 分
测得某试样中钒的质量分数w(V)/%为:1.20, 1.27, 1.22, 1.15, 1.30。计算置信度95%时平均值的置信区间。

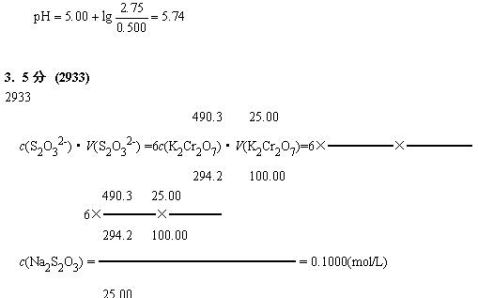
3. 5 分
称取0.4903g纯K2Cr2O7,用水溶解并稀释至100.00mL。移取25.00mL,加入
H2SO4及KI,以Na2S2O3溶液滴定至终点,消耗25.00mL。计算此Na2S2O3溶液的浓度。
[Mr(K2Cr2O7)=294.2]。
4. 10分
已知??(Ag+/Ag)=0.799V, ??(Ag2CrO4/Ag)=0.446V。计算Ag2CrO4在纯水中的溶解度及Ag+的浓度
四、问答题 ( 共 2题 20分 )
1. 10 分
已知氯乙酰(CH3COCl)和水及醇(ROH)在吡啶介质中及适当条件下发生如下
反应:
CH3COCl+H2O=HCl+CH3COOH (1)
CH3COCl+ROH =HCl+CH3COOR (2)
试利用以上反应设计测定水的方法,不必指出详细条件,只需指出测定方法,标准溶液,指示剂以及n(H2O)的计算式。
2. 10 分
Fe3+与I-反应能否达到99.9%的完全度?为什么能用间接碘量法测定Fe3+?
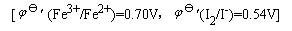
化学分析试卷 答案
一、选择题 ( 共 9题 18分 )
1-5.CCDAD 6-9. CDDD
二、填空题 ( 共14题 32分 )
1. 3 分
[NH4+]+[H+] = [H2PO4-]+2[HPO42-]+3[PO43-]+[OH-]
2. 4 分
总体平均值,总体标准差, y = [1/(s(2p)1/2)]exp[-(x-m)2/(2s2)]
3. 2 分
0.02984
4. 2 分
NO3- H+
5. 2 分
玻璃棱镜, 光电管
6. 2 分
大, 小, 小, 小
7. 2 分
溶解、 熔融、 干灰化
8. 4 分
1. C 2. A 3. B 4. D
9. 2 分
0.0255
10. 2 分
3064
曙红或荧光黄; 荧光黄
11. 2 分
36.7
12. 2 分
aY(H)减小(或酸效应系数减小);此时aY(N) > aY(H),而K?(MY)的大小由aY(N)决定,aY(N)基本上与pH无关。
13. 2 分
1. B 2. C 3. A 4. D
14. 2 分
感量(或灵敏度); 不等臂性; 调整砝码
三、计算题 ( 共 4题 30分 )
1. 10 分
c(HCl)>>c(H2PO4-),溶液[H+]由HCl决定
pH = 1.00
10-4.74
[Ac-]= cx0=10-5.7──────── =10-9.44
10-4.74+10-1.0
= 3.6×10-10 (mol/L)
[PO43-]= cx0
10-21.68
= 10-3.0────────────────
10-3.0+10-4.12+10-10.32+10-21.68
= 10-21.71 = 1.9×10-22
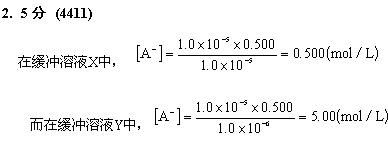
(mol/L)
X和Y等体积混合,则有[HA]= 0.500 mol/L,[A]=(0.500 + 5.00)/2 = 2.75 (mol/L), -
因此所得溶液的pH为
4. 10 分
5031
??(Ag2CrO4/Ag) = ??(Ag+/Ag)+0.059/2×lgKsp
Ksp = 1.1×10-12
S = (Ksp/4)1/3 = 6.5×10-5(mol/L)
[Ag+] = 2S = 1.3×10-4(mol/L)
四、问答题 ( 共 2题 20分 )
1. 10 分
移取同量氯乙酰溶液两份:
其一:在一干燥瓶中准确加入一定量氯乙酰及被测水和吡啶,在适当条件下待反应完成后, 加入过量无水乙醇, 然后以酚酞为指示剂, 以NaOH标准溶液滴定耗去V1;
其二:为空白实验,仅不含水,方法同前,此耗去NaOH标准溶液为V2 , 则: n(H2O) = c(NaOH)·(V1-V2)
2. 10 分
不能,(当n1=1,n2=2时,?E>0.27V时才能反应完全),间接碘量法是加入
过量I-,而且生成的I2不断被S2O32-滴定,故反应很完全。
-
20xx-20xx化学试卷分析
20XX20XX化学试卷分析20XX20XX学年第一学期期末化学试卷分析本次考试试题考查学生的化学基础知识与基本技能、学习化学的过…
-
高一年级下学期期中考试化学试卷分析
高一年级下学期期中考试化学试卷分析一、试卷分析:本次期中考试是对学生半学期以来所学知识的一次检测,为教师便于教师了解学生学习中存在…
-
初三化学试卷分析
初三化学试卷分析一、试题分析:本试题充分体现了《考试说明》的要求,考试内容紧紧围绕“化学-生活-技术”这一主线展开,充分体现化学学…
-
高三化学试卷分析与阶段复习总结
高三化学试卷分析与阶段复习总结高三化学组韦婉雯一、试卷的整体分析试卷体现了新课标的教学理念,着重考查学生对化学基础知识掌握的程度,…
-
初三化学试卷分析模板
20XX---20XX学年期中测试卷分析_区初三化学(一)、试卷评析1、结构合理,难易适中,全卷共有4个大题,32个小题,题型丰富…
-
高三化学试卷分析与阶段复习总结
高三化学试卷分析与阶段复习总结高三化学组韦婉雯一、试卷的整体分析试卷体现了新课标的教学理念,着重考查学生对化学基础知识掌握的程度,…
-
初三化学试卷分析
初三化学试卷分析一、试题分析:本试题充分体现了《考试说明》的要求,考试内容紧紧围绕“化学-生活-技术”这一主线展开,充分体现化学学…
-
高一年级下学期期中考试化学试卷分析
高一年级下学期期中考试化学试卷分析一、试卷分析:本次期中考试是对学生半学期以来所学知识的一次检测,为教师便于教师了解学生学习中存在…
-
20xx-20xx化学试卷分析
20XX20XX化学试卷分析20XX20XX学年第一学期期末化学试卷分析本次考试试题考查学生的化学基础知识与基本技能、学习化学的过…
-
20xx年初中毕业会考暨高中招生化学试卷分析报告
庆阳市20xx年中考化学试卷分析报告化学评卷组王朝志朱恩琴一试题分析一试题结构20xx年庆阳市化学中考试题总题数为18小题满分10…