实验一 乙醇的蒸馏
实验一 乙醇的蒸馏
一、实验目的:
⑴了解蒸馏提纯液体有机物的原理、用途。
⑵掌握蒸馏提纯液体有机物的操作步骤。
⑶了解沸点测定的方法和意义。
二、实验原理(参照本章)2.2.1.1
三、仪器与药品
⑴仪器
100ml圆底烧瓶 100ml锥形瓶 蒸馏头 接液管 30cm直型冷凝管 150℃温度计200ml量筒 乳胶管 沸石 热源等
⑵药品
乙醇水溶液(乙醇:水=60:40) 95%的乙醇[1]
四、实验步骤:
⑴仪器的安装
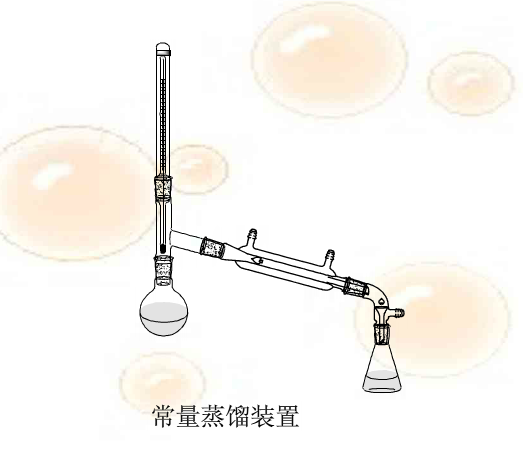
安装的顺序从热源开始,按自下而上、自左至右的方法。高度以热源为准。各固定的铁夹位置应以蒸馏头与冷凝管连接成一直线为宜。冷凝管的进水口应在靠近接收管的一端,完整的仪器装置图见2-5。
安装过程中要特别注意:各仪器接口要用凡士林密封;铁夹以夹住仪器又能轻微转动为宜。不可让铁夹的铁柄接触到玻璃仪器,以防损坏仪器;整个装置安装好后要做到端正,使之从正面和侧面观察,全套仪器的各部分都在同一平面。
⑵蒸馏操作
①加料
将60%乙醇水溶液60ml通过长颈漏斗倒入圆底烧瓶中,再加入2-3粒沸石,按图2-5安好装置,接通冷凝水[2]。
若蒸馏液体很粘稠或含有很多固体物质,加热时易发生局部过热和暴沸,此时沸石失效。可选用油浴加热。
②加热
开始加热时可大火加热,温度上升较快,开始沸腾后,蒸汽缓慢上升,温度计读数增加。当蒸汽包围水银球时,温度计读数急速上升,记录第一滴馏出液进入接收器时的温度[3]。此时调节热源,使水银球上始终有液滴,并与周围蒸汽达到平衡,此时的温度即为沸点。
③收集馏出液
在液体达到沸点时,控制加热,使流出液滴的速度为每秒钟1-2滴。当温度计读数稳定时,另换接收器收集记录下各馏分的温度范围和体积。95%乙醇馏分最多应为77-79℃。在保持加热程度的情况下,不再有馏分且温度突然下降时,应立即停止加热。记下最后一滴液体进入接收器时的温度。关冷凝水,计算产率。
要求:a.测定所给乙醇的浓度。
b.收集前馏分和77℃~ 79℃的馏分。
c.记录乙醇的沸程。
d.测定收集的乙醇浓度和残留液的浓度。
本实验约需要4小时
五、附 注
[1]蒸馏法只能提纯到95%的乙醇,因为乙醇和水形成恒沸化合物(沸点78.1℃),若要制得无水乙醇,需用生石灰、金属钠或镁条法等化学方法。
[2]接通冷凝水应从下口入水,上口出水,方可达到最好的冷凝效果。
[3]加热记录温度时,热源温度不能太高或太低。太高会在圆底烧瓶中出现过热现象,使温度计读数偏高;太低,温度及水银球周围蒸汽短时中断,使温度计读数偏低或不规则。
六、思考题
(1)什么叫沸点? 液体的沸点和大气压有什么关系? 文献上记载的某物质的沸点温度是
否即为你们那里的沸点温度?
(2)蒸馏时为什么蒸馏瓶所盛液体的量不应超过其容积的2/3,也不应少于1/3 ?
(3)蒸馏时加入沸石的作用是什么? 如果蒸馏前忘记加入沸石,能否立即将沸石加至将近沸腾的液体中? 当重新进行蒸馏时,用过的沸石能否继续使用?
(4)为什么蒸馏时最好控制馏出液的速度为1~2滴/秒?
(5)如果液体具有恒定的沸点,那么能否认为它是单纯物质?
第二篇:实验一工业乙醇的蒸馏
实验一工业乙醇的蒸馏









-
乙醇的蒸馏及沸点测定 实验报告
实验报告报告题目:乙醇的蒸馏及沸点测定专业班级:生物工程指导老师:学生姓名:学号:20##年3月30日乙醇的蒸馏及沸点测定一.实验…
-
实验一 乙醇的蒸馏
实验一乙醇的蒸馏一实验目的了解蒸馏提纯液体有机物的原理用途掌握蒸馏提纯液体有机物的操作步骤了解沸点测定的方法和意义二实验原理参照本…
-
乙醇的蒸馏实验报告
乙醇的蒸馏一实验原理二实验仪器及试剂主要仪器主要试剂三操作步骤1检验装置的气密性2取100ml95乙醇倒入250ml圆底烧瓶中加入…
-
工业乙醇的蒸馏实验报告样本
实验课题工业乙醇的蒸馏一实验目的1学习蒸馏的原理仪器装置及操作技术2了解蒸馏提纯液体有机物的原理用途及掌握其操作步骤二实验原理将液…
-
工业乙醇的蒸馏实验报告样本
实验课题工业乙醇的蒸馏一实验目的1学习蒸馏的原理仪器装置及操作技术2了解蒸馏提纯液体有机物的原理用途及掌握其操作步骤二实验原理将液…
-
蒸馏与分馏实验预习报告
蒸馏与分馏目的1掌握普通蒸馏分馏的原理和操作方法了解其意义2学习安装仪器的基本方法3学会用常量法测定液态物质的沸点原理蒸馏liqu…
-
乙醇的蒸馏及沸点测定 实验报告
实验报告报告题目:乙醇的蒸馏及沸点测定专业班级:生物工程指导老师:学生姓名:学号:20##年3月30日乙醇的蒸馏及沸点测定一.实验…
-
板式蒸馏塔实验报告
板式精馏塔实验报告学院广州大学化学化工学院班级12化工2姓名朱志豪其他组员陈啸翔毛勇冯丹艳利巧怡学号120xx00018指导老师陈…
-
工业乙醇的蒸馏实验报告样本
实验课题工业乙醇的蒸馏一实验目的1学习蒸馏的原理仪器装置及操作技术2了解蒸馏提纯液体有机物的原理用途及掌握其操作步骤二实验原理将液…
-
工业乙醇的蒸馏实验报告样本
实验课题工业乙醇的蒸馏一实验目的1学习蒸馏的原理仪器装置及操作技术2了解蒸馏提纯液体有机物的原理用途及掌握其操作步骤二实验原理将液…
-
乙醇的蒸馏实验报告
乙醇的蒸馏一实验原理二实验仪器及试剂主要仪器主要试剂三操作步骤1检验装置的气密性2取100ml95乙醇倒入250ml圆底烧瓶中加入…