乙酰二茂铁的制备及柱色谱分离预习实验报告及思考题
乙酰二茂铁的制备及柱色谱分离
一.实验目的
1. 通过乙酰二茂铁的制备,理解Friedel-Crafts酰基化反应原理。
2. 掌握机械搅拌等操作。
3. 掌握用柱色谱分离和提纯化合物的原理和技术。
二.实验原理
1.乙酰二茂铁的制备
二茂铁及其衍生物是一类很稳定的有机过渡金属络合物。二茂铁是橙色的固体,又名双环戊二烯基铁,是由两个环戊二烯负离子和一个二价铁离子键合而成,具有夹心型结构。二茂铁具有类似苯的一些芳香性,比苯更容易发生亲电取代反应。以乙酸酐为酰化剂,三氟化硼、氢氟酸或磷酸为催化剂,二茂铁可以发生Friedel-Crafts酰基化反应,主要生成一元取代物及少量1,1´-二元取代物。二茂铁及其衍生物可作为火箭燃料的添加剂、汽油的抗爆剂、硅树脂和橡胶的防老剂及紫外线吸收剂等。
二茂铁的乙酰化可以形成乙酰二茂铁,根据反应条件,可以生成单乙酰二茂铁或者双乙酰二茂铁。由于二茂铁分子中存在亚铁离子,对氧化的敏感限制了它在合成中的应用,如不能够用混酸对其消化。制备乙酰二茂铁的反应式如下:
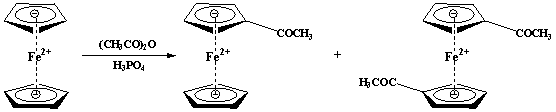 二茂铁 乙酰二茂铁 1,1´-二乙酰基二茂铁
二茂铁 乙酰二茂铁 1,1´-二乙酰基二茂铁
在上述条件下,主要生成单乙酰二茂铁,双乙酰二茂铁很少,但同时有未反应的二茂铁。
2.柱色谱分离
本实验用柱色谱分离提纯产品。柱色谱分离提纯是根据二茂铁和乙酰二茂铁对硅胶吸附能力的差异而进行分离提纯。
柱层析是在层析柱中装入作为固定相的吸附剂,把试样流经固定相而被吸附,然后利用薄层层析中探索到的能分离组分的溶剂流经层析柱,试样中的各组在固定相和溶剂间重新分配,分配比大的组分先流出,分配比小的组分后流出,对于不易流出的组分可另选择合适的溶剂再进行洗脱,这样就可以达到各组分的分离提纯。
柱色谱(柱上层析)常用的有吸附色谱和分配色谱两类。吸附色谱常用氧化铝和硅胶作固定相;而分配色谱中以硅胶、硅藻土和纤维素作为支持剂,以吸收较大量的液体作固定相,而支持剂本身不起分离作用。
吸附柱色谱通常在玻璃管中填入表面积很大经过活化的多孔性或粉状固体吸附剂。当待分离的混合物溶液流过吸附柱时,各种成分同时被吸附在柱的上端。当洗脱剂流下时,由于不同化合物吸附能力不同,往下洗脱的速度也不同,于是形成了不同层次,即溶质在柱中自上而下按对吸附剂的亲和力大小分别形成若干色带,再用溶剂洗脱时,已经分开的溶质可以从柱上分别洗出收集;或将柱吸干,挤出后按色带分割开,再用溶剂将各色带中的溶质萃取出来。
(1)吸附剂
常用的吸附剂有氧化铝、硅胶、氧化镁、碳酸钙和活性炭等。吸附剂一般要经过纯化和活性处理,颗粒大小应当均匀。对于吸附剂而言,粒度愈小表面积愈大,吸附能力就愈高,但颗粒愈小时,溶剂的流速就太慢,因此应根据实际分离需要而定。供柱色谱使用的氧化铝有酸性、中性、碱性三种:
酸性氧化铝 用1%盐酸浸泡后,用蒸馏水洗至氧化铝的悬浮液pH为4,用于分离酸性物质。
中性氧化铝 其悬浮液的pH为7.5,用于分离中性物质。 碱性氧化铝 其悬浮液的pH为10,用于胺或其它碱性物质的分离。
大多数吸附剂都能强烈地吸水,而且水分易被其它化合物置换,因此吸附剂的活性降低,通常有加热方法使吸附剂活化。氧化铝随着表面含水量的不同,而分成各种活性等级,活性等级的测定一般采用勃劳克曼(Brockmann)标准测定法。
(2)溶质的结构与吸附能力的关系
化合物的吸附性与它们的极性成正比,化合物分子中含有极性较大的基团时,吸附性也较强,各种化合物对氧化铝的吸附性按以下次序递减:
酸和碱 > 醇、胺、硫醇 > 酯、醛、酮 > 芳香族化合物 > 卤代物、醚 >烯 > 饱和烃
在本实验中,乙酰二茂铁极性大于二茂铁,因此,二茂铁首先被洗脱下来。
(3)溶剂
溶剂的选择是重要的一环,通常根据被分离物中各化合物的极性、溶解度和吸附剂的活性等来考虑。
先将要分离的样品溶于一定体积的溶剂中,选用的溶剂极性要低,体积要小。如有的样品在极性低的溶剂中溶解度很小,则可加入少量极性较大的溶剂,使溶液体积不致太大。
色层的展开首先使用极性较小的溶剂,使最容易脱附的组分分离。然后加入不同比例的极性溶剂配成的洗脱剂,将极性较大的化合物自色谱柱中洗脱下来。常用洗脱剂的极性按如下次序递增:
己烷和石油醚 < 环己烷 < 四氯化碳 < 三氯乙烯 < 二硫化碳 < 甲苯 < 苯 < 二氯甲烷 < 氯仿 < 乙醚 < 乙酸乙酯 < 丙酮 < 丙醇 < 乙醇 < 甲醇 < 水 < 吡啶 < 乙酸
所用溶剂必须纯粹和干燥,否则会影响吸附剂的活性和分离效果。
吸附剂色谱的分离效果不仅依赖于吸附剂和洗脱剂的选择,而且与制成的色谱柱有关:
(1)柱中的吸附剂用量为被分离样品量的30—40倍,若需要可增至100倍;
(2)柱高和直径之比一般是75:1
(3)装柱有湿法和干法两种,无论采用哪种方法装柱,都不用使吸附剂有裂缝或气泡。
三.实验准备
1.仪器与试剂
1. 试剂:二茂铁,乙酸酐,磷酸,碳酸钠,石油醚(60-90℃),乙酸乙酯,硅胶(100~200目),石英砂。
2. 仪器:100mL三口烧瓶,恒压滴液漏斗,球形冷凝管,二口连接管,温度计(100℃),薄层板,层析缸,色谱柱(30cm,19#),机械搅拌装置,熔点测定仪,旋转蒸发仪,红外灯。
2.相关物理性质
四.实验装置
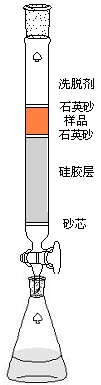
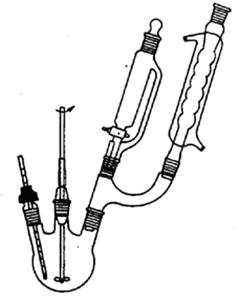
图1 柱色谱示意图 图2 合成乙酰二茂铁反应装置
五.实验步骤及注意事项
(一)乙酰二茂铁的制备
1.在100mL三口烧瓶中,加入1.5g(8.05mmol)二茂铁和10mL(10.8g,0.105mol)乙酸酐,在恒压滴液漏斗中加入2mL 85%磷酸。
2.开启搅拌,圆底烧瓶用冷水冷却,慢慢滴加磷酸
(注意:磷酸有氧化性,振摇下滴管慢慢加入,否则易产生深棕色粘稠氧化聚合物)。
滴加过程中,控制反应温度不要超过20℃。滴加完毕后,在室温下搅拌5min,再升温到55~60℃,恒温搅拌15 min。
(注意:严格控制温度在55~60℃,反应结束后,反应物呈暗红色。温度高于85℃,反应物即发黑、粘稠,甚至炭化)
3.然后将反应混合物倾入盛有40g碎冰的400mL的烧杯中,并用少量冷水刷洗三口烧瓶,将刷洗液并入烧杯。
4.在搅拌下,分批加入固体碳酸钠,到溶液呈中性为止(pH=7),约需10g碳酸钠。
(注意:用碳酸钠中和粗产物时,应小心操作,防止因加入过快产生大量泡沫而使产物溢出,并且每次加入时,要观察烧杯底部,碳酸钠是否全部溶解)。
5.将中和后的反应混合物置于冰浴中冷却,抽滤收集析出的橙黄色固体,用冰水洗涤两次,压干后在红外灯下干燥。
(注意:乙酰二茂铁在水中有一定的溶解度,用水量不可太多,洗涤次数也切忌过多)
(二)乙酰二茂铁的柱色谱分离
二茂铁黄色,乙酰二茂铁橙色,根据颜色不同可分别收集
1. 拌样
称取上述粗产品0.1g置于干燥的小烧杯中,滴加乙酸乙酯使其溶解,加入1.0g硅胶(100~200目),搅拌均匀得桔黄色浆状物,在红外灯下干燥得松散的粉末状固体。
2. 湿法装柱
将色谱柱(30cm)垂直固定在铁架台上,向柱中加入石油醚(60-90℃)至柱高的1/2。柱活塞下接一干净的锥形瓶。
在小烧杯中称取约40g硅胶(100~200目),加入石油醚(60-90℃)调匀。
打开柱下活塞,控制流出速度1~2滴/秒。将烧杯中硅胶糊状物加入柱内,硅胶自然沉降,将流下的石油醚倒入未倒完的吸附剂中,搅匀后再倒入柱中,反复多次,待所有的吸附剂全部转移完,用滴管吸取流下的石油醚,将黏在柱内壁的硅胶淋洗下去,然后用皮管轻轻敲击柱身,使柱面平整、无气泡,装填紧密而均匀,在顶部加一层约3mm厚的石英砂。
(石英砂要慢慢加入)
3.上样
当石英砂上面留有少量(粉末状样品正好浸没在其中)石油醚时,将上述拌有粗产品的粉末状固体装入柱中,轻敲柱身,使柱面平整,上层再覆以3mm厚的石英砂。
4. 洗脱
用石油醚:乙酸乙酯= 5:1(体积比)作洗脱剂(100~150mL)从柱顶沿柱内壁慢慢加入,控制洗脱剂的滴速在1~2滴/秒,逐渐展开,得到黄色、橙色分离的色谱带。待色带分离明显后,可在柱顶加压以加速分离。黄色的二茂铁色带首先流出,用干燥的锥形瓶收集洗脱溶液。当黄色色带完全洗脱下来后,用另一只已干燥的锥形瓶收集黄色与橙色之间的洗脱液。当橙色色带快要洗脱下来时,再用另一只已干燥的锥形瓶收集洗脱液。两种谱带都有比较明显的拖尾现象。
(注意:在装柱、洗脱过程中,始终保持有溶剂覆盖吸附剂。一个色带与另一个色带的洗脱液的接收不要交叉)
5. 收集产品
收集到的黄色洗脱液中有未反应完的原料二茂铁,橙色洗脱液中主要是产物乙酰二茂铁。将橙色洗脱液倒入已称重的干燥圆底烧瓶中,旋转蒸发除去溶液,烘干后称重,测定熔点。理论为为83.5~84.5℃。
(熔点参考值:二茂铁为173℃,乙酰二茂铁85℃, 1,1´-二乙酰基二茂铁为130℃)
思考题
1. 二茂铁酰化时形成二酰基二茂铁时,第二个酰基为什么不能进入第一个酰基所在的环上?
乙酰基是一个吸电子基团,对苯环上的其它位点,具有致钝作用。
2. 二茂铁比苯更容易发生亲电取代,为什么不能用混酸进行硝化?
消化用的混酸是浓硝酸和浓硫酸的混合物,是具有强氧化性的,二价铁离子很容易被氧化,这样就形不成乙酰二茂铁了。
3. 乙酰二茂铁的纯化为什么要用柱色谱法?可以用重结晶法吗?它们各有什么优缺点?
考虑到产物在温度较高时易产生氧化聚合反应,故纯化时最好采用柱色谱法。柱色谱分离效果好,不会产生氧化聚合,但需要大量溶剂,耗时长。重结晶法加热时容易导致产物氧化聚合,很难控制操作条件。
4. 本实验采用柱色谱分离二茂铁和乙酰二茂铁的原理是什么?
柱色谱分离提纯是根据二茂铁和乙酰二茂铁对硅胶吸附能力的差异而进行分离提纯。化合物的吸附性与它们的极性成正比,化合物极性越强,其吸附性越强。由于二茂铁的极性弱于乙酰二茂铁,二茂铁首先向下移动,被洗脱下来。加强洗脱剂的极性,乙酰二茂铁也被洗脱下来,从而将乙酰二茂铁和二茂铁分离开。
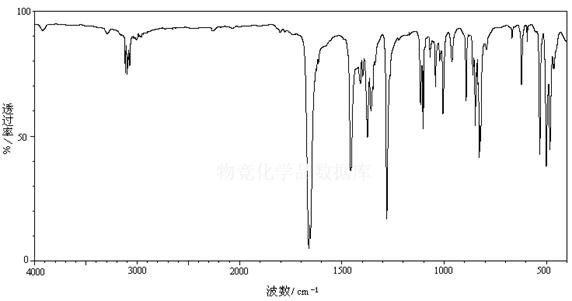
5. 解析乙酰二茂铁红外光谱图中有关吸收峰的归属。
第二篇:乙酰基二茂铁的色谱分离 实验报告
实验名称:乙酰基二茂铁的色谱分离
一. 实验目的
(1)学会用色谱分离法分离提纯目标化合物的方法。
(2)理解色谱分离法的基本原理。
二. 实验原理
硅胶层析法的分离原理是根据物质在硅胶上的吸附力不同而得到分离, 一般情况下极性较大的物质易被硅胶吸附,极性较弱的物质不易被硅胶吸附,整个层析过程即是吸附、解吸、再吸附、再解吸过程。
利用不同物质被吸附剂吸附能力的差异以及不同物质在流动相中溶解度的差异实现混合组分完全分离的过程。
三. 实验步骤
1.装柱(湿法装柱)
柱色谱管检漏干燥,在烧杯中放入适量硅胶粉用石油醚混合并搅拌,使之成可流动的粘液,倒入色谱柱直到高度达10--15cm,装柱过程尽量避免产生气泡。打开柱色谱管下方胶管,直到管中液面刚好淹没硅胶层。
2.上样(干法上样)
称取0.4g乙酰基二茂铁与一勺硅胶粉混合,用漏斗缓慢加到管中,样品表面尽量平整,再加入沸石约1cm高度,用石油醚润湿。
3.洗脱分离
配制石油醚:无水乙醚=3:1约120ml,打开柱色谱管下方胶管,由慢到快把配好的溶液加满色谱柱,下方滴液速度一秒钟一滴。会发现有淡黄色物质先被洗脱下来,接着下来的是红棕色的乙酰基二茂铁,收集此溶液。
4.产物后处理
将收集的溶液旋蒸得到棕黄色固体,放入700C烘箱内烘干,称质量得0.29g。
四. 计算产率
Fe(C5H5)2 : Fe(C5H5)C2OH3
186 228
105g x
x =1.5*228 /156 =1.84g
粗产品质量m1 =1.53g 实际产量为 m1 *0.29/0.4 =1.11 g
产率 w =1.11 /1.84 *100% =60.3 %
五. 产物的结构鉴定
红外光谱图
 图谱分析:
图谱分析:
1. 在1800cm-1 有吸收峰 ,表明有不饱和碳
2. 在3100cm-1 左右有强吸收,是环上碳氢伸缩振动
3. 在1600cm-1 ,1500cm-1附近有吸收峰,说明是碳碳双键伸缩振动
-
实验八:乙酰二茂铁的制备
实验八乙酰二茂铁的制备4学时一实验目的1通过乙酰化二茂铁的制备了解利用傅列德尔克拉夫茨FriedelCrafts酰基化反应制备芳酮…
-
二茂铁制备实验报告
华南师范大学实验报告学生姓名吴健华学号20xx2401046专业化学师范班级10化学五班课程名称化学综合实验实验类型验证设计综合实…
-
乙酰二茂铁的制备
乙酰二茂铁的制备一实验目的1学习相转移催化剂存在下合成金属有机化合物的方法2了解二茂铁及其衍生物的结构与性质3学习乙酰二茂铁的合成…
-
乙酰二茂铁的制备及柱色谱分离预习实验报告及思考题
乙酰二茂铁的制备及柱色谱分离一实验目的1通过乙酰二茂铁的制备理解FriedelCrafts酰基化反应原理2掌握机械搅拌等操作3掌握…
-
乙酰二茂铁的合成与分离实验-学生用
有机合成与制备实验实验一乙酰二茂铁的合成一实验目的1通过乙酰二茂铁的合成了解用FriendelCrafts酰基化反应制备非苯芳酮的…
-
乙酰乙酸乙酯的制备 实验报告
乙酰乙酸乙酯的制备前言乙酰乙酸乙酯无色至淡黄色的澄清液体微溶于水易溶于乙醚乙醇有刺激性和麻醉性可燃遇明火高热或接触氧化剂有发生燃烧…
-
乙酰水杨酸的制备实验报告
乙酰水杨酸阿司匹林的合成实验报告一教学要求1通过本实验了解乙酰水杨酸阿斯匹林的制备原理和方法2进一步熟悉重结晶熔点测定抽滤等基本操…
-
实验1 乙酰水杨酸的合成实验报告
实验1乙酰水杨酸的合成实验目的掌握由酸酐作为酰基化试剂和醇反应制备酯的方法巩固普通蒸馏抽滤重结晶等基本操作学习应用显微镜熔点仪测定…
-
聚醋酸乙酯乳胶漆制备的实验报告
四川大学化学工程学院本科生专业实验报告海纳百川聚醋酸乙烯酯乳液的合成和乳胶漆的制备实验报告学生姓名毛书林班级10308034学号1…
-
实验二 乙酰乙酸乙酯的制备
实验二乙酰乙酸乙酯的制备一实验目的1学习制备乙酰乙酸乙酯的原理和方法加深对Claisen酯缩合反应原理的理解和认识2熟悉在酯缩合反…
-
乙酰基二茂铁的色谱分离 实验报告
实验名称乙酰基二茂铁的色谱分离一实验目的1学会用色谱分离法分离提纯目标化合物的方法2理解色谱分离法的基本原理二实验原理硅胶层析法的…