仪器分析实验报告原子吸收铜
华南师范大学实验报告
课程名称: 仪器分析实验 实验项目:原子吸收光谱法测定水中的铜含量
原子吸收光谱法测定水中的铜含量
一、 实验目的
1. 掌握火焰原子吸收光谱仪的操作技术;
2. 优化火焰原子吸收光谱法测定水中铜的分析火焰条件;
3. 熟悉原子吸收光谱法的应用。
二、方法原理
原子吸收光谱法是一种广泛应用的测定元素的方法。它是一种基于待测元素基态原子在蒸气状态对其原子共振辐射吸收进行定量分析的方法。为了能够测定吸收值,试样需要转变成一种在适合的介质中存在的自由原子。化学火焰是产生基态气态原子的方便方法。
待测试样溶解后以气溶胶的形式引入火焰中。产生的基态原子吸收适当光源发出的辐射后被测定。原子吸收光谱中一般采用的空心阴极灯这种锐线光源。这种方法快速、选择性好、灵敏度高且有着较好的精密度。
然而,在原子光谱中,不同类型的干扰将严重影响方法的准确性。干扰一般分为四种:物理干扰、化学干扰、电离干扰和光谱干扰。物理和化学干扰改变火焰中原子的数量,而光谱干扰则影响原子吸收信号的准确测定。干扰可以通过选择适当的实验条件和对试样的预处理来减少或消除。所以,应从火焰温度和组成两方面作慎重选择。
由于试样中基本成分往往不能准确知道,或是十分复杂,不能使用标准曲线法,但可采用另一种定量方法——标准加入法,其测定过程和原理如下。
取笑体积的试液两份,分别置于相同溶剂的两只容量瓶中。其中一只加入一定量待测元素的标准溶液,分别用水稀释至刻度,摇匀,分别测定其吸光度,则:
Ax=kfx
Ao=k(fo十fx)
式中,fx,为待测液的浓度;f。为加入标准溶液后溶液浓度的增量;测量的吸光度,将以上两式整理得:Ao分别为两次
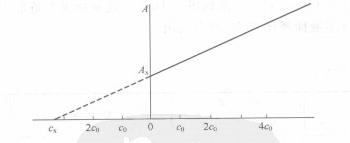
在实际测定中,采取作图法(图6—6)的结果更为准确。一般吸取四份等体积试液置于四只等容积的容量瓶中,从第二只容量瓶开始,分别按比例递增加人待测元素的标准溶液,然后用溶剂瓶稀释至刻度,摇匀,分别测定溶液fx,cx十fo,fx十2co,cx十3fo的吸光度为Ax,A1,Az,A:,然后以吸光度A对待侧元素标准溶液的加入量作图,得图6—6所示的直线,其纵轴上截距Ax为只含试样fx的吸光度,延长直线与横坐标轴相交于cX,即为所需要测定的试样中该元素的浓度。
三、仪器和试剂
1. 仪器 TAS-986火焰型原子吸收分光光度计; 铜元素空心阴极灯; 通风设备
2.试剂 100g/ml的铜标准溶液、1%的稀硝酸
四、实验内容与步骤
(1)标准溶液配制
分别取100ug/ml的铜标准溶液0.25ml、0.50ml、0.75ml、1.0ml于50ml的容量瓶中,用1%的稀硝酸定容,分别配成浓度为0.500mol/ml、1.000mol/ml、1.500mol/ml、2.000mol/ml的铜标准溶液。
(2)设置实验条件
工作电流:3.0mA
预热灯电流:2.0mA
光谱宽带:0.4nm
负电高压:300.0V
燃气流量:1800ml/min
燃烧器高度:6.0nm
燃烧器位置:-1.0nm
(3)实验步骤
分别测定铜标准溶液的吸光度等等相关数据,并用标准曲线法测得两个样品的浓度。
五数据处理
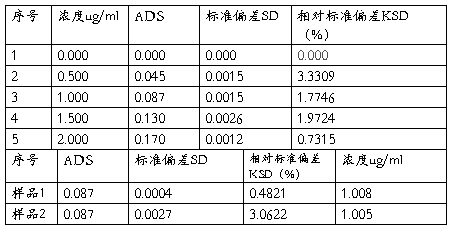
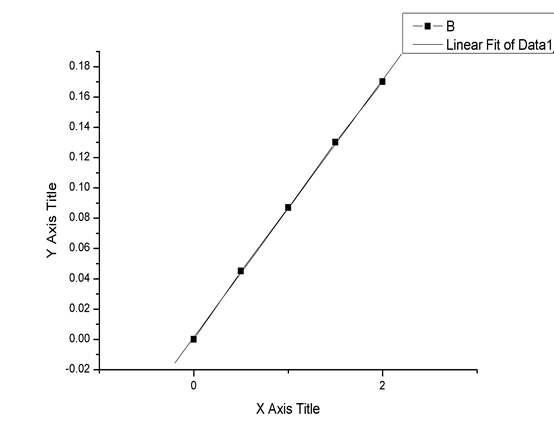
以吸光度为纵坐标,铜标准系列加入浓度为横坐标,绘制铜的工作曲线(见最后一页)
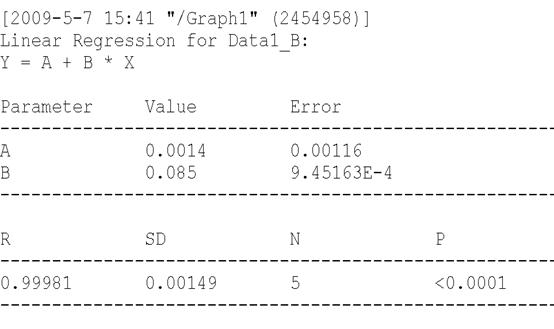
曲线方程(一次) 【A】=K1【C】+K0
相关系数:K1=0.0850, K0=0.0014
相关性:0.9998
水中的铜含量C=(C1+C2)/2=(1.008+1.005)/2=1.0065ug/ml
六、思考题
1. 当使用雾化器时,经常使用稀释硝酸作为溶剂。为什么硝酸是个较好的选择?(提示:-硝酸盐的性质是什么?)
答:用稀释硝酸作为溶剂,可以防止待测的金属离子水解。
2. 火焰原子吸收光谱法具有哪些特点 ?
答:火焰原子吸收光谱法的特点:灵敏度高、抗干扰能力强、精密度高、选择性好、仪器简单、操作方便。
3.在使用标准加入法的时候应注意哪些问题?
答:①为了得到较为准确的外推结果,以提高测量准确度;
⑦绘制的工作曲线斜率不能太小,f。与未知量cx尽量接近;’
O co 2co 4co标准加入法工作曲线至少要配制四种不同比例加入量的待测标准溶液,否则外延后将引入较大误差,为此应使一次加入量
③本法能消除基体效应带来的干扰,但不能消除背景吸收带来的干扰;
④待测元素的浓度与对应的吸光度应呈线性关系,即绘制工作曲线应呈直线,fx不存在时,工作曲线应该通过零点。而且当fx不存在时,工作曲线应该通过零点。
第二篇:原子吸收光谱测定未知溶液中的铜和镉的含量实验报告
原子吸收光谱法测定未知溶液中的铜和镉的含量
一、实验目的
1、学习原子吸收光谱分析法的基本原理;
2、了解原子吸收光谱分析仪的基本结构及使用方法;
3、掌握以标准曲线法测定未知溶液中的铜、镉含量的方法;
4、增强小组协作解决问题的能力。
二、实验原理
原子吸收光谱分析是一种动态分析方法,用校准曲线进行定量。常用的定量方法有标准曲线法、标准加入法和浓度直读法。如为多通道仪器,可用内标法定量。在这些方法中,标准曲线法是最基本的定量方法。
标准曲线法是原子吸收光谱分析中最常用的方法之一,该法是配制已知浓度的标准溶液系列,在一定的仪器条件下,依次测出它们的吸光度,以加入的标准溶液的浓度为横坐标,相应的吸光度为纵坐标,绘制标准曲线。试样经适当处理后,在与测量标准曲线吸光度相同的实验条件下测量其吸光度,根据试样溶液的吸光度,在标准曲线上即可查出试样溶液中被测元素的含量。
三、实验仪器及试剂
1、仪器
原子吸收光谱仪、空气压缩机、乙炔钢瓶、容量瓶、移液管、烧杯
2、试剂
铜、镉贮备液个100ml
四、实验步骤
1、标准溶液的配制
镉标准溶液系列:准确吸取镉贮备液(10ppm)和铜贮备液(10ppm)各0.10ml、0.30ml、0.50ml、1.00ml、2.00ml,分别置于5只10ml容量瓶中,用去离子水稀释至刻度,摇匀备用。该标准溶液系列的镉(铜)浓度分别为0.10ppm、0.30ppm、0.50ppm、1.00ppm、2.00ppm。
2、未知溶液的配制
准确移取未知溶液5ml,置于25ml容量瓶中,用去离子水稀释至刻度,摇匀,以用来测定镉的含量。再准确吸取未知溶液2.5ml,置于25ml容量瓶中,用去离子水稀释至刻度,摇匀,以用来测定铜的含量。
3、加标试样的配制
准确移取镉贮备液和铜贮备液各2.5ml,未知溶液5ml置于50ml容量瓶中,用去离子水稀释至刻度,摇匀,以用来测定镉的含量。再准确吸取镉贮备液和铜贮备液各0.63ml,未知溶液2.5ml置于50ml容量瓶中,用去离子水稀释至刻度,摇匀,以用来测定铜的含量。
4、用原子吸收光谱仪测定
根据实验条件,将原子吸收光谱仪按一定步骤进行调节,然后按照浓度由低到高的原则,依次间隔测量标准溶液,并记录吸光度。然后测定配制好的加标试样,以检验测定结果的准确性。测定结束后,清洁燃烧器,然后关闭仪器。
五、实验结果与数据处理
加标回收率:设未知样品体积为V1,浓度为C1;加标后总体积为V2,浓度为C2;加标体积为VS,浓度为CS。则加标回收率P=(V2·C2 –V1·C1)/ VS·CS 。
1、Cd含量的确定
表1. 不同含量Cd的吸光度

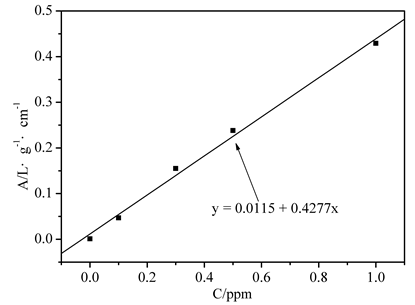
图1. Cd标准曲线及拟合
拟合常数:R = 0.9971
Cd的含量C=0.454×5=2.075 ppm
P=(0.740×50–0.415×25)/(10×2.5)=106.2%
2、Cu含量的确定
表2. 不同含量Cu的吸光度
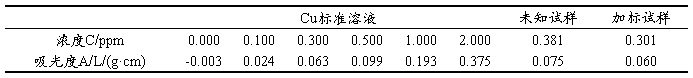
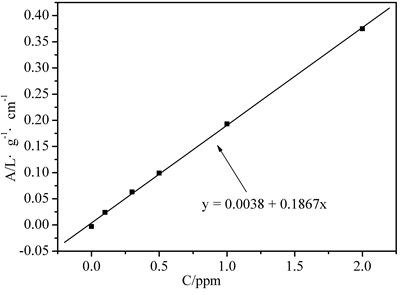
图2. Cu标准曲线及拟合
拟合常数:R = 0.9996
Cu的含量 C=0.381×10=3.81 ppm
P=(0.301×50–0.381×25)/(10×0.63)=87.7%
六、分析与讨论
1、通过绘制Cd标准曲线及拟合图时,Cd标准溶液的浓度大于1ppm时,线性关系明显降低,故在做标准曲线时舍弃Cd离子2ppm时的点,这样各吸光度均分布直线两侧,线性关系明显改变,而Cu的标准曲线与理论吻合较好,因为Cu标准溶液的线性变化范围较大可到10ppm。
2、标准曲线法常用于分析共存的基体成分较为简单的试样。如果试样中共存的基体成分比较复杂,则应在标准溶液中加入相同类型和浓度的基体成分,以消除或减少基体效应带来的干扰,必要时应采用标准加入法进行定量分析。本实验所采取的未知试样为实验室配制的,成分较为简单,试样经稀释后,即可采用标准曲线法进行测定。
3、在采用加标回收方法时:加标量一般要求加标物的浓度较高而体积较小,本实验中Cd和Cu的加标回收率都能取得较满意的效果。
4、应加强分析理论知识的学习,培养和建立分析各种复杂问题的思维能力和分析方法。
七、结论
本实验在小组成员间的互相帮助下取得了较好的结果,通过实验操作加深了对理论知识的理解,也增强团队协作意识,同时也发现了论理论知识缺乏等一系列问题,需要在以后的学习生活中加以弥补。
-
化工原理实验报告吸收实验
广西大学实验报告姓名专业月实验内容吸收实验指导教师一实验名称吸收实验二实验目的1学习填料塔的操作2测定填料塔体积吸收系数KYa三实…
- 实验报告_吸收实验
-
吸收实验实验报告
广西大学实验报告姓名专业月实验内容吸收实验指导教师一实验名称吸收实验二实验目的1学习填料塔的操作2测定填料塔体积吸收系数KYa三实…
-
填料塔吸收实验报告
实验6填料吸收塔实验报告第四组成员王锋郑义刘平吴润杰一实验名称填料吸收塔实验二实验目的1了解填料吸收塔的构造并实际操作2了解填料塔…
-
吸收实验报告
吸收实验专业环境0901学号姓名一实验目的1了解填料吸收塔德基本构造吸收过程的基本流程及操作2掌握吸收总传质系数Kya的测定方法二…
-
原子吸收光谱实验报告
原子吸收光谱定量分析实验报告班级环科101姓名王强学号20xx012127一实验目的1了解石墨炉原子吸收分光光度计的使用方法2了解…
-
(火焰)原子吸收光谱法实验报告
原子吸收光谱实验报告一实验目的1学习原子吸收光谱分析法的基本原理2了解火焰原子吸收分光光度计的基本结构并掌握其使用方法3掌握以标准…
-
原子吸收光谱实验
仪器分析实验报告实验学专班姓指导日名称原子吸收光谱实验院业化学工程与工艺级化工102班名学号教师期20xx年5月10日一实验目的1…
-
原子吸收实验报告
仪器分析实验报告学院化学工程学院专业化学工程与工艺班级姓名号指导教师日期实验名称原子吸收光谱实验一实验目的1了解AA6200的结构…
-
原子吸收光谱实验报告
仪器分析实验报告学院化学工程学院专业化学工程与工艺班级化工091班姓名学号094020xx1指导教师李颖日期20xx年5月15日实…
-
化工原理实验报告(正文)---例3吸收
南京工业大学化工原理实验报告1实验一流体流动阻力测定实验实验日期一实验目的1测定流体在圆直等径管内流动时的摩擦系数与雷诺数Re的关…