《免疫学实验技术》实验讲义修订版20xx
亲们:
曾老师发来的实验讲义,请下载打印,每次课带相应的讲义。
1.下周一实验1点开始,切记时间不要迟到哟。
2.作业:第一次(今天)的实验报告,还有“大吞噬”和"小吞噬"的图。
3.漂亮美女们要把头发扎好,为自己的健康着想哟。
实验一 小鼠腹腔巨噬细胞吞噬实验
【原理】吞噬细胞具有对异物(细菌、绵羊红细胞、鸡红细胞等)吞噬和消化的功能,在机体固有免疫中发挥重要作用。
【目的】
1. 通过对小鼠腹腔巨噬细胞吞噬鸡红细胞活动的观察,加深理解细胞吞噬作用的过程及其意义。
2.掌握小鼠腹腔注射给药和摘眼球放血及脊椎脱臼处死的方法。
【材料】小鼠、2%鸡RBC(CRBC)、尖吸管、玻片、瑞氏染液、眼科剪、弯头眼科镊、1mL注射器
【方法】10%的硫乙醇酸钠溶液腹腔注射1ml(诱导腹腔巨噬细胞大量渗出)
 (4d)
(4d)
2%CRBC腹腔注射1ml
 (45min)
(45min)
 摘眼球放血,处死小鼠
摘眼球放血,处死小鼠
 轻揉腹部1min,剪开表皮,暴露腹膜,剪一小口,取腹腔液(用尖吸管)滴于玻片一端
轻揉腹部1min,剪开表皮,暴露腹膜,剪一小口,取腹腔液(用尖吸管)滴于玻片一端
 推片(自然干燥)
推片(自然干燥)
 瑞氏染色(10min)
瑞氏染色(10min)
冲洗,印干,镜检
【注意事项】
⒈ 腹腔注射时勿注入皮下;
⒉ 染色时玻片勿互相碰触;
⒊ 观察时注意玻片正反面。
结果:吞噬百分率=吞有SRBC的吞噬细胞/100个吞噬细胞×100%
吞噬指数=所吞SRBC数/100个吞噬细胞
附:
⒈ 2%CRBC悬液的制备:吸取在阿氏液中保存的CRBC沉淀0.3mL,置于玻璃试管内,加入2mL生理盐水,混匀,2000rpm, 5min离心,此为洗涤红细胞。离心毕,观察上清,如无溶血现象,即可弃上清,取红细胞沉淀(即为压积红细胞)0.2mL,移入15mL离心管中,以10mL注射器吸取生理盐水10mL加入,混匀,即为2%CRBC悬液。若洗一次后仍可见溶血现象,则重复第一步,直至无溶血发生,方可配制实验用红细胞悬液。
⒉ 摘取胸腺,脾脏。均为重要的免疫器官,做动物实验获取免疫细胞的重要来源
示教片:
大吞噬实验:即本实验结果;
小吞噬实验: 外周血嗜中性粒细胞吞噬葡萄球菌(标本片示教)
实验二 淋巴细胞转化实验(MTT法)
一、原理:
四甲基偶氯唑盐(MTT)可作为线粒体中琥珀酸脱氢酶的底物。当有活细胞存在时,线粒体内琥珀酸脱氢酶可将淡黄色的MTT还原成紫兰色的甲臢,将结晶的甲臢溶解释放后,可根据所测的OD值反映活细胞的数量和活性,从而推知待测样品的水平。
二、材料:
小鼠、鼠板、眼科剪、眼科镊、75%乙醇湿棉球、小平皿、200目筛网、研棒(注射器针芯)、细胞计数板、盖玻片、加样器(1mL、200uL、20uL)及枪头、96孔血凝板、15mL离心管、4mL EP管、96孔板、白细胞计数液、MTT、ConA、无菌PBS、Tris-NH4Cl、完全1640(含10% FBS、1%双抗)、0.01N HCl-10%SDS、无菌针头过滤器、10mL注射器、废物(液)缸、冰浴、无菌操作台、CO2培养箱,显微镜、酶标仪,冰箱、低温离心机。
试剂的准备:
1. MTT:称取50mg的MTT,溶于10ml PBS后,终浓度为5mg/ml,过滤除菌,无菌EP管分装,1mL/管,-20℃避光保存。
2. ConA:25mg/瓶,Sigma出品。取25mg,溶于25mLPBS中,终浓度为1mg/mL,过滤除菌,无菌EP管分装,1mL/管,-20℃保存。用时取1mL,以无菌PBS稀释为100ug/mL(即稀释10倍)。
3. PBS:取市售配好的PBS粉末一袋,加1000mL蒸馏水,混匀,高压或过滤除菌,4℃保存。
4. 0.01N HCl-10%SDS:设市售浓HCl为10N(实际约为11N),取0.1mL加99.9mL蒸馏水稀释为0.01N HCl 100mL;称取10g SDS,置于100mL量筒内,以上述HCl溶解,使终体积为100mL,即得0.01N HCl-10%SDS。
5. 完全1640:取市售RPMI1640 89mL,加1mL 100×双抗、10mLFBS,即得含10%FBS的完全1640.
6. Tris-NH4Cl(红细胞裂解液):称取3.735g氯化铵、Tris(三羟甲基氨基甲烷)1.3g加水溶解并稀释至500ml。0.22μm滤膜过滤除菌,4℃保存。
无菌器械的准备:
1. 200目筛网、研棒、平皿:提前1d高压灭菌,烘干备用。
2.手术器械:临用前酒精擦拭或浸泡、酒精灯火焰灭菌。
3.冰浴:将碎冰置于一白色浅盘(或小塑料泡沫盒)内,备用。
(三)实验方法:
1、脾细胞制备:
(1)小鼠摘眼球放血、脱颈椎处死,75%乙醇湿棉球擦拭腹部,置于鼠板上固定;
(2)在小鼠腹部中间部位剪开小口,撕开皮肤,暴露腹壁,可见红色长条状脾脏;
(3)在脾脏下侧提起腹膜,剪开后上翻,暴露脾脏,用镊子提起脾脏,另一镊子分离脾脏下面的结缔组织,取出脾脏。放入盛有5ml 无菌PBS液的培养皿中;
(4)制备脾细胞悬液: 无菌取脾,将脾脏放置不锈钢网(200目)上,置于盛有适量无菌PBS的小平皿中,用注射器针芯轻轻研压脾脏,制成单细胞悬液;经200目筛网过滤,用PBS洗3次,每次离心2000r/min 5min。取出10μl,稀释后在细胞计数板上进行细胞计数,调整细胞浓度为5×106/ml。
细胞计数的方法:
①稀释脾细胞:在96孔血凝板内分别加白细胞计数液90μL/孔,根据细胞数量加2-3个孔;取脾细胞悬液10μL,依次10倍稀释。
②取最后1孔的细胞悬液10μL置于白细胞记数板槽内,待细胞不再移动,100倍镜下进行细胞计数。

③根据细胞计数结果,取适量细胞以完全1640稀释为5×106/mL
2、淋巴细胞增殖反应: 将5×106/ml脾细胞悬液加入到96孔培养板中,100ul/孔,加6个孔,再加培养液100μL/孔;前3个孔加ConA 10μL/孔(终浓度5μg/mL),另3个孔不加ConA作为对照。置5% CO2,37℃培养72h。
3. 在培养结束前4-6小时,先将各孔中培养液小心吸出100μL/孔,注意加样器枪头勿碰触细胞;于培养板各孔内加入5mg/ml MTT液,10μl/孔。37℃培养。
4. 4-6小时后,各孔内加入0.01NHCl-10%SDS 100μl, 振荡摇匀,37℃过夜。
5. 用酶标测定仪测OD值,测定波长570nm。抄录数据。
(四)实验结果
取实验组和对照组三个复孔的平均OD值。
转化值=实验组的平均OD值-对照组的平均OD值。
注意事项
(1)由于本实验需要培养3天,才能观察结果。因此,在操作时应注意无菌操作,避免细菌污染,导致实验的失败。
(2)细胞操作要轻柔、迅速,以免细胞损伤影响实验结果。
(3)为保持细胞活性,所有步骤(除破坏红细胞时)均需在低温或冰浴中进行。
实验三-1 凝集实验
原理:是颗粒性抗原与相应抗体结合所发生的凝集反应(agglutination)。细菌和红细胞等颗粒性抗原,当与相应抗体特异结合后,在适量电解质存在的条件下,两者特异性结合且进一步聚集,出现肉眼可见的凝集现象称为凝集反应。反应中的抗原称为凝集原(agglutinogen),抗体称为凝集素(agglutinin)。
分类:直接凝集试验、间接凝集试验、间接凝集抑制试验等
血球凝集试验:属直接凝集试验
材料:1%SRBC、1:20溶血素、生理盐水(NS)、24孔凹孔板、0.2mL加样器及枪头、37℃恒温箱
方法与步骤:对倍稀释法(第12孔为阴性对照,37℃,2h,4 ℃静置过夜
1 2 3 4 5。。。。。。。。。。。。11 12
生理盐水(ml) 0.2 0.2 0.2
溶血素(ml) 0.2 0.2 0.2 弃去
1:40 1:80 1:160
1%SRBC(ml) 0.2 0.2 0.2
结果判定:++++ 全部凝集,血细胞明显凝集,甚至成片卷曲,上清清亮
+++ 两者之间,血细胞凝集成片,上清发红,略不清亮
++ 一半凝集,一半沉淀,血细胞均半数凝集,周围散在颗粒,上清呈混悬
+ 两者之间,血细胞在孔底形成一圆点,周围可见少量凝集,上清更加浑浊
- 一点儿也不凝集,血细胞在孔底形成边缘整齐,光滑的点状,上清澄清
效价:即滴度,是出现明显凝集现象(++)的抗体的最大稀释度。

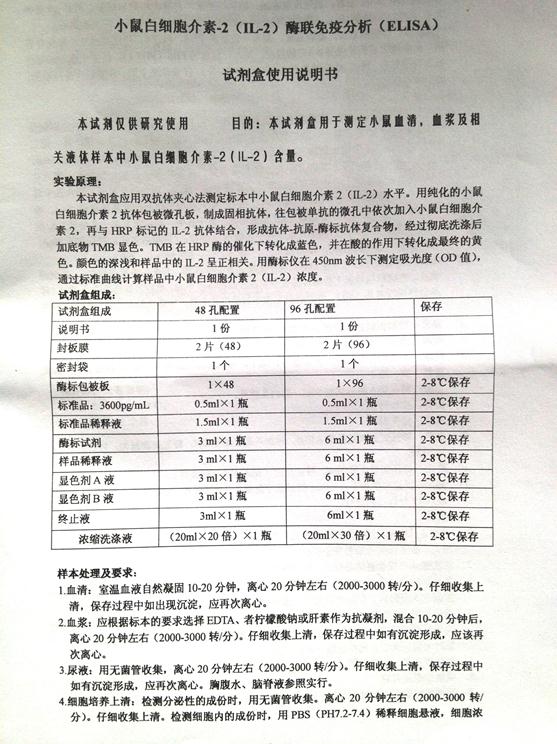
实验三-2 抗体形成细胞检测――溶血分光光度计法QHS
实验原理:定量溶血分光光度法(quantitative hemolysis spectrophotometry,QHS) 该法又称B细胞介导的红细胞定量溶血分光光度法,是根据溶血空斑试验的原理衍化而来,可用以测定由B细胞产生和分泌的抗体裂解红细胞所释放的血红蛋白(以吸光值表示),从而反映机体的体液免疫功能。试验时,将免疫的脾细胞与SRBC及新鲜豚鼠血清等体积混合,于37℃水浴1小时,离心后测上清吸光值,其与产生抗体的量成正比。
实验材料:5%SRBC、SRBC(以生理盐水稀释成1.5×108/ml)、
补体(三只豚鼠血清混合,以SRBC 4℃ 吸收 30 min,3000rpm离心15min,上清 1:10 稀释备用)
2×107/ml 小鼠脾细胞、RPMI1640培养液、白细胞计数液、Tris-NH4Cl溶液、酒精棉球
200目铜网、针芯(研棒)、冰浴(置于中号白托盘中)、眼科剪、弯头眼科镊2把、平皿(小号)、小滤器、10mL注射器、PBS、低温离心机、15mL离心管、1.5mL离心管若干、96孔血凝板(稀释细胞用)、96孔酶标板、各规格(1mL、200uL、10uL)加样器及枪头、显微镜、血球记数板、盖玻片、废物(液)缸、37℃孵箱、酶标仪
实验方法:
1. 脾细胞的制备
①5%SRBC免疫小鼠,1mL/只,4天后拉颈处死,取脾
②200目铜网上研磨脾脏,收集脾细胞悬液,2000rpm离心5min,弃上清
③Tris-NH4Cl室温作用10min,2000rpm 离心 5min,弃上清
④洗细胞2遍:加5ml PBS 液,混匀,2000rpm 离心 5min,弃上清
⑤加 1 ml PBS液计数,调整细胞浓度为2×107/ml
按下表分别向各管中加入所需材料

? 混匀,37℃ 孵育 1 h
? 3000rpm 离心 5 min,取上清,加入96孔板,0.1mL/孔,实验组和对照组各设3个复孔
? 酶标仪测定413nm处OD值(Hb量)
实验四


实验五 免疫细胞化学
实验原理: 应用免疫学基本原理——抗原抗体反应,即抗原与抗体特异性结合的原理,通过化学反应使标记抗体的显色剂(荧光素、酶、金属离子、同位素)显色来确定组织细胞内抗原(多肽和蛋白质),对其进行定位、定性及定量的研究,称为免疫组织化学技术(immunohistochemistry)或免疫细胞化学技术(immunocytochemistry)。
免疫酶标记法:以酶作为标记物与外加底物作用后产生不溶性色素,沉积于抗原和抗体反应的部位;
· 酶降解底物的量与色泽浓度成正比。可反映被测定的抗原或抗体的量。
1、常用的标记酶及其显色底物
· 辣根过氧化物酶(horseradish peroxidase, HRP)及底物
· 碱性磷酸酶(alkaline phosphatase, AP)及底物
(1) 辣根过氧化物酶(HRP)及底物
· HRP是应用最广的一种酶,来源于植物辣根,由无色的酶蛋白和深棕色的铁叶琳结合而成,分子量约40kDa,稳定性好;
· 底物为过氧化物和供氢体(DH2)
– 过氧化物:常用过氧化氢和过氧化氢尿素。
– 供氢体:多用无色的还原型染料,通过反应生成有色的氧化 型染料,最常用的供氢体是DAB。
DAB (二氨基联苯胺)
· DAB本身无色,反应后呈棕色,不溶于水,不易褪色,电子密度高,最为常用。
· 目前已经有商品化的试剂盒,使用起来非常方便。
(2) 碱性磷酸酶(AP)及底物
· AP为磷酸酯的水解酶,可通过两种反应显色:
- 偶氮偶联反应,底物为a-萘酚磷酸盐,经水解后得a-萘酚,与重氮化合物如坚牢蓝(fast blue)或坚牢红(fast red)形成不溶性沉淀,分别呈兰色或红色。
– 靛蓝-四唑反应:底物为溴氯羟吲哚磷酸盐(5-bromo-4-chloro-3-indodyl phosphate,BCIP),经酶水解并氧化形成靛蓝,而氮蓝四唑(NBT)在此氧化过程中被还原成不溶性紫兰色沉淀。
酶标抗体法
· 通过共价键将酶结合在抗体上,制成酶标抗体,与标本进行反应后,再用酶组化法将酶显色,使之生成有色的不溶性产物或具有一定电子密度的颗粒,以供光镜和电镜观察。
– 优点:切片能长期保存、反复观察,适于镜下半定量分析。
– 缺点:酶与抗体形成的共价键,可损害抗体和酶的活性;易产生非特异染色。
(1)直接法
· 将酶直接标记在一抗上,然后直接与相应抗原特异地结合。形成抗原-抗体-酶复合物,最后用底物显色剂显色。
(2)间接法
· 将酶标记在二抗上,先将一抗与相应的抗原结合,形成抗原抗体复合物,再用二抗(酶标抗体)与复合物中的特异抗体结合,形成抗原-抗体-酶标抗体复合物,最后用底物显色剂显色。
实验材料:1×107/ml 小鼠脾细胞、单抗(兔抗鼠CD3)、兔Streptavidin-HRP试剂盒(带DAB显色液)、小牛血清、淋巴细胞分层液(适用于小鼠组织)、白细胞计数液、酒精棉球、200目铜网、针芯(研棒)、冰浴(置于中号白托盘中)、眼科剪、弯头眼科镊2把、平皿(小号)、PBS、低温离心机、15mL离心管、96孔血凝板(稀释细胞用)、各规格(1mL、200uL、10uL)加样器及枪头、显微镜、血球记数板、盖玻片、废物(液)缸、37℃孵箱、湿盒
实验方法:
1. 单个脾细胞的制备
① 取健康ICR小鼠,18-22g,摘眼球放血、脱颈椎处死,取脾
② 200目铜网上研磨脾脏,收集脾细胞悬液,2000rpm离心5min,弃上清
③ 用PBS洗3次,每次以500 rpm短时低速离心除去细胞碎片,以200目不锈钢滤网过滤去除细胞团块。作细胞计数并调整细胞浓度为(2~5)×107/ml。常温下放置,分离前用小牛血清悬起细胞浓度为l×107/ml的单细胞悬液备用。
2. 分离单个核细胞
①取上述单细胞悬液1ml,小心加于2ml的细胞分离液之液面上
②以2000转/分离心(半径15cm水平转子)15分钟,此时离心管中由上至下细胞分四层。第一层;为胎牛血清液层。第二层;为环状乳白色淋巴细胞。第三层;为透明分离液层。第四层;为红细胞层。
③收集第二层细胞放入含PBS 4-5毫升的试管中,充分混匀后,以2000转/分离心5分钟。沉淀经反复洗2次即得所需细胞。

附:
1. 有关淋巴细胞分层液的注意事项:
1)启封后应置4℃保存避免微生物的污染。
2)细胞分离液从冰箱取出后,不可立即使用,需待溶液温度升至室温时,摇匀后使用。
3)整个分离过程中,温度应控制在18-28℃且在无菌环境下,避免微生物的污染,否则会影响分离质量。
2. 细胞计数要点:
1)进行细胞计数时,要求悬液中细胞数目不低于l04个/ml,如果细胞数目很少要进行离心再悬浮于少量培养液中;显微镜下计数时,遇到2个以上细胞组成的细胞团,应按单个细胞计算。如果细胞团>10%,说明细胞分散不充分;或细胞数<200个/10mm2或>500个/10 mm2时,说明稀释不当,需重新制备细胞悬液。
2)要求细胞悬液中的细胞分散良好,否则影响计数准确性。
3)取样计数前,应充分混匀细胞悬液,尤其是多次取样计数时更要注意每次取样都要混匀, 以求计数准确;
4)数细胞的原则是只数完整的细胞,若细胞聚集成团时,只按照一个细胞计算。如果细胞压在格线上时,则只计上线,不计下线,只计左线,不计右线。
5)操作时,注意盖玻片下不能有气泡,也不能让悬液流入旁边槽中,否则要重新计数。
3. 免疫细胞化学染色
1) 试剂盒组成:

2) 染色方法:
①固定细胞:取上述分离好的淋巴细胞50μL,滴于载玻片正中,以细菌接种环均匀涂于载玻片上,自然干燥后,以纯甲醇室温固定5min,再用0.01M PBS漂洗,5min×3;
②滴加适量试剂1(内源性过氧化物酶封闭液),室温孵育10分钟,PBS充分淋洗。
③滴加适量试剂2(封闭用正常羊血清工作液),室温孵育10分钟,甩干。
④滴加适量—抗工作液( PBS 1:50稀释),37℃孵育1h,然后PBS充分淋洗。
⑤滴加适量试剂3(生物素标记羊抗兔二抗工作液),室温孵育10分钟,PBS充分淋洗。
⑥滴加适量试剂4(HRP标记的链霉亲和素),室温孵育10分钟,PBS充分淋洗。
⑦DAB显色工作液配制:根据需要量,将试剂A和试剂B以1:19的体积比混匀后即为DAB显色工作液。也可选择每毫升试剂B中滴加1滴(约50μ1)试剂A,混匀即可。
⑧显色:加适量的DAB显色工作液于需要显色的组织切片或细胞爬片上即可显色,显色时间—般为1~5分钟。显微镜下观察控制显色时间,当达到最佳显色效果后,自来水冲洗终止显色。显色后的切片经复染、脱水透明,封片后可长期保存。
实验六 细胞凋亡检测(Annexin-V-FITC PI双染法)
(Assay of Cell Apoptosis)
一、实验原理
细胞凋亡或称程序性细胞死亡(Programmed Cell Death ,PCD)是细胞的生命现象之一,它在机体的胚胎发育、组织修复及自身反应性T淋巴细胞的清除等方面起着十分重要的作用。细胞凋亡调节的失控可导致临床各种疾病的发生。如老年性痴呆与神经细胞凋亡过度有关,自身免疫性疾病和肿瘤与细胞凋亡的抑制有关。细胞凋亡有别于细胞坏死,它有一系列的细胞形态学和生物化学的改变,包括出现染色质浓缩、DNA降解、凋亡小体形成等。在正常的活细胞,磷脂酰丝氨酸(phosphotidylserine, PS)位于细胞膜的内侧,但在凋亡的细胞,PS 从细胞膜的内侧翻转到细胞膜的表面,暴露在细胞外环境中。Annexin-Ⅴ(膜联蛋白-V)是一种分子量为35-36KD的Ca2+ 依赖性磷脂结合蛋白,能与PS高亲和力结合。因此将Annexin-Ⅴ进行荧光素(如FITC、PE)或生物素(Biotin)标记,以标记了的Annexin-Ⅴ作为探针,利用流式细胞仪或荧光显微镜可检测细胞凋亡的发生。

碘化丙啶(Propidium Iodine,PI)是一种核酸染料,它不能透过完整的细胞膜,但对凋亡中晚期的细胞和死细胞,PI能够透过细胞膜而使细胞核染红。因此将Annexin-Ⅴ就PI匹配使用,就可将处于不同凋亡时期的细胞区分开来。
二、实验仪器和材料
Annexin V-FITC(膜联蛋白-V-FITC)
标记缓冲液(Binding Buffe)10ml
PBS(1×)
20μl , 200μl , and 1000μl 移液器和吸头
微量离心管
可调速离心机
载玻片(用于荧光显微镜观察)
盖玻片(用于荧光显微镜观察)
去离子水
冰块
荧光显微镜
三、实验方法
1.凋亡细胞的制备:小鼠腹腔注射地塞米松25mg/kg体重,10h后解剖取胸腺,分离胸腺细胞。用PBS洗两遍,调整待测细胞的浓度为2 ×106/ml,备用。
2.将细胞重悬于200μl 标记缓冲液(binding buffer)。
3.加入10μl Annexin V-FITC,轻轻混匀,再加入5μlPI,混匀。
4. 避光室温反应15分钟。
5. 滴一滴上述染色后的细胞悬液于载玻片上,并用盖玻片盖上细胞。
6. 请在1h内,进行荧光显微镜的观察。Annexin V-FITC荧光信号呈绿色,PI荧光信号呈红色。
四、 实验结果
用荧光显微镜观察,凋亡细胞细胞膜上可见黄绿色光环。PS转移到细胞膜外不是凋亡所特有的,也可发生在细胞坏死中。以FITC标记的Annexin V, 可以同时结合使用PI(碘化丙啶)拒染法,用流式细胞仪分析可检测凋亡细胞的百分率。
五、注意事项
1.整个操作过程动作要尽量轻柔,切勿用力吹打细胞,尽量在4℃下操作。
3.反应完毕后要尽快检测,因为细胞凋亡是一个动态的过程,反应一小时后荧光强度就开始衰变。
4. Annexin V-FITC是光敏物质,在操作时要注意避光。

-
医学免疫学CDC实验报告
CDC实验一实验原理细胞表面抗原与相应的抗体IgG13或IgM特异性结合形成的免疫复合物可通过经典途径激活补体形成攻膜复合体而导致…
-
39份 医学免疫学实验报告
医学免疫学实验报告院系基础医学院专业临床医学五年制年级20xx级班级五年八班姓名学号我的大学我的同学日期20xx年星期五1实验目的…
-
《医学免疫学与微生物学》实验报告
医学免疫学与微生物学实验报告实验一实验名称沉淀反应实验目的通过单向琼脂扩散测定待测血清Ig含量实验材料离子琼脂白喉类毒素白喉抗毒素…
-
医学免疫学实验教案
医学免疫学课程实验教案实验一实验名称E玫瑰花环形成实验计划学时4学时实验目的与要求1掌握人T淋巴细胞形成E花环的实验原理和操作方法…
-
医学免疫学实验
第一章免疫学概要12机制34生长567TCRTCR即T细胞抗原受体是T细胞表面特异性识别和结合抗原的结构SIg即B细胞表面的膜免疫…
-
动物微生物及免疫学(实践教学)实验报告
四川农业大学动物微生物及免疫学实践教学实验报告组长组员二零一二年四月1一实验目的一掌握一般培养基的制备原理及要求掌握培养基酸碱度的…
-
免疫学实验指导080410
免疫学实验指导生命科学与工程学院生物工程生物技术动物医学专业用冯玉萍分组4人组实验用动物器材以每组需要量设计班级20xx生物工程生…
-
免疫学实验报告1
免疫学实验报告姓名买迪来木坎代尔学号20xx20xx1222班级20xx131实验一多克隆抗体的制备和抗体效价的检测一实验原理有了…
-
免疫学实验教案
键入公司名称免疫学实验教案研究生教育实习潘熙萍Y20xx020120xx114在此处键入文档的摘要摘要通常是对文档内容的简短总结在…
-
医学免疫学实验课程教学大纲(20xx)
课程编号课程名称学分学时开课单位撰稿人审核人河北大学课程教学大纲2420xx医学免疫学实验1学分34学时临床学院曹志然赵丽君20x…
-
染色质免疫沉淀(ChIP)实验指南及技术总结
染色质免疫沉淀(ChIP)实验指南及技术总结ChIP是一项比较流行的研究转录因子(transcriptionfactor,TF)与…