产品质量跟踪报告
医疗器械
产 品 质 量 跟 踪 报 告
本医疗器械由本公司生产。该产品的质量管理体系已经按照YY/T 0287 -2003/ ISO 13485:2003标准建立、实施,并通过了医疗器械生产企业质量体系考核。
本公司对该产品从设计更改、采购控制、来料检验、工序检验、出厂检验均建立了相应的管理制度和操作工艺文件,对各环节的质量状况定期进行质量分析并予以改进。在历次质量体系内部审核中对该产品的质量管理均进行了审查分析,从未出现重大不合格项,针对存在的问题均已及时进行整改,并记录在案以便追溯。产品质量达到了国家法规对医疗器械所提出的要求。该产品自注册以来质量一直稳定,符合国家法律法规要求和满足客户要求,未出现过任何质量问题。
公司已经制定了顾客满意度调查制度,定期对产品质量进行分析。根据分析结果,在该产品使用过程中,用户对产品质量反馈情况正常,未见重大故障。顾客对产品满意度达96%以上。
该产品经过多年生产,元器件、部件来源与技术工艺已经稳定,通过严格执行来料检验、工序检验和出厂检验,产品质量良好。在各次周期检验中均为合格。出厂检验中,合格率达98%以上。在省级以上食品药品监督管理部门的产品质量监督抽验中,合格率为100%。
公司已经确定专人负责该产品的不良事件信息收集、报告和管理工作。不良事件监测情况表明,该产品自准产以来,其安全性、有效
性在使用中从未出现任何重大问题或导致人体伤害的有害事件。
公司确定获取和利用顾客反馈信息的方法,提供质量问题的早期报警,并将此报警作为纠正和预防措施的输入。通过向顾客发放《顾客满意度调查表》、定期及不定期地对顾客进行回访,来获取顾客反馈信息,监视公司的产品和服务是否已满足顾客要求。公司制定并执行《数据分析管理程序》,确定、收集和分析适当的数据(包括来自监视和测量的结果以及其他有关来源的数据),以证实管理体系的适宜性和有效性,不断提高产品的市场竞争力。
第二篇:产品质量跟踪报告
产品质量跟踪报告
单位名称: (公章)
产品名称:
日 期:
-
产品质量跟踪报告模板
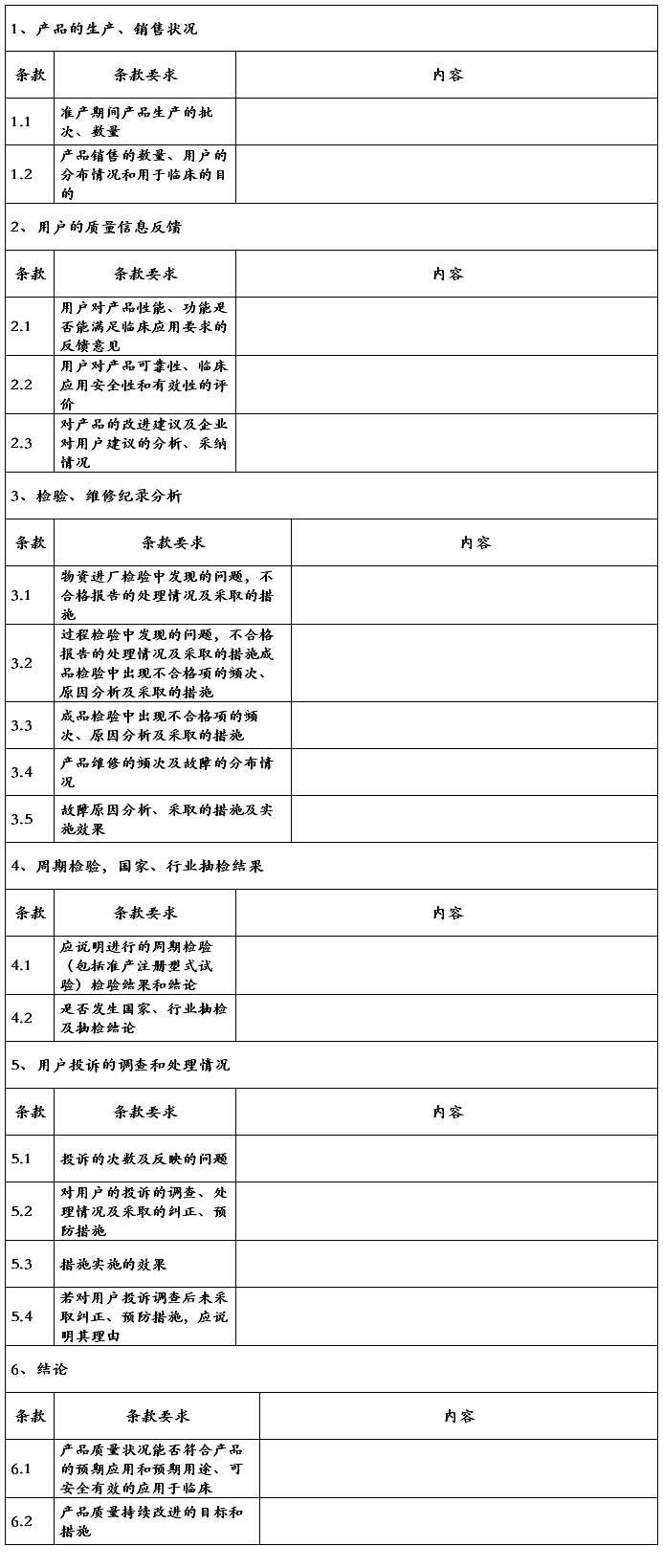
编号XXXXXXXXXXXXXXXXXX产品质量跟踪分析报告产品名称XXXXXXXXXXXX规格型号XXXXAXXXXBXXXXC…
-
产品质量跟踪报告(范文)
牙科手机产品质量跟踪报告一试产期间产品的生产销售情况1试产期间高速涡轮牙科手机产品生产的批次为2数量为2002试产期间高速涡轮牙科…
-
产品质量跟踪报告
医疗器械产品质量跟踪报告本医疗器械由本公司生产该产品的质量管理体系已经按照YYT028720xxISO1348520xx标准建立实…
-
产品质量跟踪报告 超 声
产品质量跟踪报告超声脑血管治疗仪为提高企业经营管理目标提高产品质量和技术层次完备质量体系安全运行管理增强企业在市场经济的竞争能力为…
-
产品质量跟踪报告(范本)
为了提高企业的信誉增强企业在市场经济的竞争能力公司对产品质量进行跟踪以此发现产品生产直至使用过程中存在的各种问题并及时采取纠正措施…
-
注册证有效期内产品质量的总结报告、临床应用情况总结报告、不良事件情况的总结报告.docx
有效期内总结报告一、产品质量跟踪总结1、产品的质量控制措施以及内部审核情况***生产的*****测定试剂盒(***)(以下简称**…
-
20xx年农机产品质量跟踪调查工作总结
20xx年农机产品质量跟踪调查工作总结根据农业机械质量调查办法的有关规定自治区农机局新农机科20xx33号文件的要求积极组织农机市…
-
产品质量跟踪报告(范文)
牙科手机产品质量跟踪报告一试产期间产品的生产销售情况1试产期间高速涡轮牙科手机产品生产的批次为2数量为2002试产期间高速涡轮牙科…
-
产品质量跟踪报告(范本)
为了提高企业的信誉增强企业在市场经济的竞争能力公司对产品质量进行跟踪以此发现产品生产直至使用过程中存在的各种问题并及时采取纠正措施…
-
产品质量跟踪报告模板
编号XXXXXXXXXXXXXXXXXX产品质量跟踪分析报告产品名称XXXXXXXXXXXX规格型号XXXXAXXXXBXXXXC…
-
产品质量跟踪报告 软组织
产品质量跟踪报告软组织伤痛治疗仪为提高企业经营管理目标提高产品质量和技术层次完备质量体系安全运行管理增强企业在市场经济的竞争能力为…