电导的定分析法测定未知酸实验报告
电导滴定分析法测定未知酸
实验者:曾惜 (2011222702) 合作者:曾子夜(2011222703)
日期:2013.4.3
一、实验目的和要求
1. 掌握电导率仪和测定溶液电导值的基本操作;
2. 了解电导电极的结构和使用;
3. 掌握电导滴定的基本原理和判断终点的方法。
二、实验原理
在滴定分析中,借助于滴定过程中离子浓度变化而引起的电导值的变化来判断滴定终点,这种方法称为电导滴定。属于仪器分析方法中的一种,该方法适用于稀溶液、有色溶液和无合适指示剂情况下的滴定分析。以NaOH标准溶液滴定HCl溶液的电导滴定曲线来看:
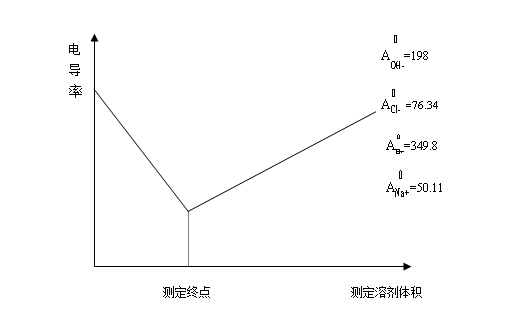
在NaOH溶液与HCl的溶液的滴定中,各种离子的极限摩尔电导值如图中所示,在滴定开始是,由于H+的极限摩尔电导值较大,测定的溶液电导值也比较大;随着滴定进行,H+和OH+不断结合生成不导电的水,在H+离子浓度不断下降的同时不断增加同等数量的Na+离子,但是由于Na+离子导电能力小于H+离子,因此溶液的电导值也是不断下降的;在化学计量点以后,随着过量的NaOH溶液不断加入,溶液中增加了具有较强导电能力的OH-离子,因为溶液的电导值也会不断增加。由此可以判断,溶液具有最小电导值是所对应的滴定剂体积为滴定终点。
三、实验仪器与试剂
1. DDS-307型电导率仪
2. DJS-1C型铂黑电导电极(电极标明:0.863)
3. 磁力搅拌器一台
4. NaOH标准溶液(0.1mol/L)
5. 未知浓度HCl溶液
6. 10ml移液管一只
7. 100ml玻璃烧杯一个
四、实验步骤
1.滴定前准备
按照滴定分析基本要求洗涤、润洗滴定管,装入0.1000 mol/L的NaOH标准溶液,调节滴定管液面至“0.00ml”处。
用移液管准确移取5.00ml未知浓度的HCl溶液于100ml玻璃烧杯中,加入50ml蒸馏水稀释被测溶液,将烧杯置于磁力搅拌器上,放入搅拌棒。
安装好仪器,将电极插入被测溶液;调节仪器“长数”旋钮至电极上标明的数值(0.863);将“测量/校正”开关置于“校正”档,调节仪器的“调正”旋钮,使仪器指针调节至100;将“测量/校正”开关置于“测量”档,将仪器“量程”开关置于合适的量程,即可从仪器表上读出被测溶液的电导值。
2.滴定过程和溶液电导值测定。
启动磁力搅拌器,按照下表依次滴加0.1000mol/L的NaOH标准溶液,将“测量/校正”开关置于“校正”档调节仪器的“调正”旋钮,使仪器指针调节至仪器表100刻度,将“测量/校正”开关拨回“测量”档,即可从仪器表盘上读出不同滴定体积时被测溶液的电导值,每次读取电导值前,必须调节仪器指针至仪器表刻度100处。
五、实验数据记录:

六、数据处理
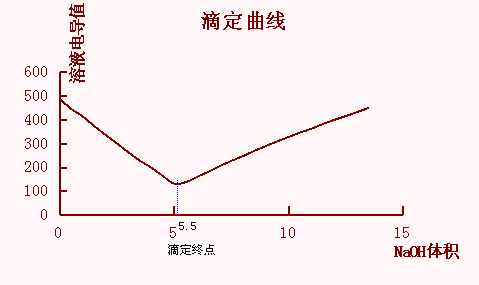
1、滴定曲线的绘制
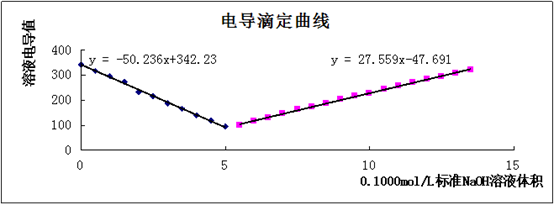
以测定的溶液浓度电导值为纵坐标,滴加的NaOH标准溶液体积为横坐标绘制电导滴定曲线,并才用作图法在滴定曲线上去出滴定终点所对应的滴定剂体积。绘图如下:
2.、未知浓度HCl溶液的浓度计算
根据NaOH标准溶液的浓度,滴定终点时滴定剂的体积,计算未知浓度HCl溶液的浓度:
V(ep)=5.50ml
CX=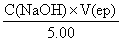 = 0.11mol/L
= 0.11mol/L
七、实验注意事项
1、 移取NaOH标准溶液一定要按照操作过程一步步来,不要出现错误操作,同样的,在滴定时也要注意这些问题,不要将溶液滴到瓶外,或者瓶壁,这些都不是标准的。
2、 同样滴定时,眼睛要时刻注意滴定管中的液面变化,而且要平视。
3、 滴定过程之,“测量/校正”要反复调节。
4、 注意磁力搅拌器的使用。
八、实验讨论
1、 本实验方法属于仪器分析方法中的一种,该方法适合于稀溶液,有色溶液和无适合指示剂的情况下的滴定分析。
2、 在滴定分析中,一般采用指示剂来判断滴定终点,但是稀溶液的滴定途越甚小,而有色溶液的颜色会影响对指示剂在终点时颜色的变化的判断,因此在稀溶液和有色溶液的滴定中,无法来判断终点。这个实验就是通过电导值的变化来判断终点,准确。
3、 采用作图法在图上求得滴定终点的读取值,这个点是图中前半部分趋势线和后半部分趋势线的理论交点的横坐标。
4、 关于这个实验的误差分析:
A:因为采用的是延长趋势线作图法求滴定终点,其中肯定会带来很大的误差,可以通过减少每次滴定量来时曲线更加趋近于真实值,从而提高准确性。
B:当有液体在滴定时不小心滴到了瓶外,那么计算值就会大于真实值;如果搅拌器将液体不小心溅到瓶外,那么计算值将小于实际值。
C:可以通过多次滴定算平均值的方法减少误差。
5、这实验方法应用广泛,可用于多种实验,结果准确易计算,但实验对人操作要求较高。
第二篇:《电导滴定分析法测定未知酸》实验报告
实验五 电导滴定分析法测定未知酸
一.实验目的
1. 掌握电导率仪结构和测定溶液电导值的基本操作;
2.了解电导电极的结构和使用;
3.掌握电导滴定的基本原理和判断终点的办法。
二.实验原理
在滴定分析中,一般采用指示剂来判断滴定终点,但是稀溶液的滴定终点突跃甚小,而有色溶液的颜色会影响对指示剂在终点时颜色变化的判断,因此在稀溶液和有色溶液的滴定分析中,无法采用指示剂来判断终点。
本实验借助于滴定过程中离子浓度变化而引起的电导值的变化来判断滴定终点,这种方法称为电导滴定。NaOH溶液与HCL溶液的滴定中,在滴定开始时,由于氢离子的极限摩尔电导值较大,测定的溶液电导值也较大;随着滴定进行,H+和OH-离子不断结合生成不导电的水,在H+浓度不断下降的同时增加同等量的Na+离子,但是Na+离子导电能力小于H+离子,因此溶液的电导值也是不断下降的;在化学计量点以后,随着过量的NaOH溶液不断加入,溶液中增加了具有较强导电能力的OH-离子,因而溶液的电导值又会不断增加。由此可以判断,溶液具有最小电导值时所对应的滴定剂体积即为滴定终点。
三:实验仪器与试剂
1.DDS-307型电导率仪 2.DJS-1C型电导电极
3.85-1磁力搅拌器一台 4.0.1000mol/L NaOH标准溶液
5.未知浓度HCL溶液 6.10ml移液管1只
7.100ml玻璃烧杯1个
四.实验步骤
1.滴定前准备
按照滴定分析基本要求洗涤,润洗滴定管,装入0.1000mol/L的NaOH标准溶液,调节滴定液面至“0.00ml”处。
用移液管准确移取5.00ml未知浓度HCL溶液于100ml玻璃烧杯中,加入50ml蒸馏水稀释被测溶液,将烧杯置于磁力搅拌器上,放入搅拌珠。
按照要求将电导电极插入被测溶液;调节仪器“常数”旋钮至1.004;将仪器的“量程”旋钮旋至检查档;将“校准”旋钮旋至100;调节“温度”旋钮至室温21℃;将“量程”旋钮置于合适的量程范围。即可开始测量。
2.滴定过程中溶液电导值测定
按照下表依次滴加0.1000mol/L的NaOH标准溶液,读取并记录电导率仪上的电导值。
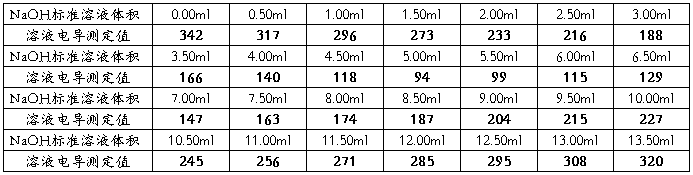
五.实验数据处理
1.滴定曲线绘制
以测定的溶液电导值为纵坐标,滴加的NaOH标准溶液体积为横坐标制图,绘制电导滴定曲线,并采用作图法在滴定曲线上求出滴定终点所对应的滴定剂体积。
2.未知浓度HCL溶液的浓度计算
根据NaOH标准溶液的浓度,滴定终点时的滴定剂的体积,采用下式计算未知浓度HCL溶液的浓度:
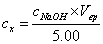 =
=
六.实验小结与讨论
1.实验前碱式滴定管必须清洗干净,并用0.1000mol/L的标准NaOH溶液润洗2-3次。
2.注意调节好磁力搅拌器的速度(注意观察搅拌珠的旋转以判断速度),不能过快而使液体飞溅,亦不能过慢而未使溶液混合均匀,而影响滴定结果。
3.将电导电极插入溶液时,要注意插入的深度及位置,既要保证搅拌珠不会损坏电极,也要保证滴定时的方便操作。
4.滴定开始前,要注意碱式滴定管的尖嘴处是否有空气,若有,一定要排空,且在后续的滴定操作中要注意控制胶管中的玻璃珠以控制差不多一次滴的滴定速度,这样即可保证不会留有空气柱。
5.一次滴定结束后,电导率仪显示的值会跳动,这是因为溶液还在混匀之中,要待其稳定后再记录电导值。
6.本次试验的误差主要来自于碱式滴定管的操作,因中途滴定中未控制好流速而使胶管中留有一段空气。
-
电导的测定及其应用实验报告wqf
宁波工程学院物理化学实验报告专业班级姓名序号同组姓名指导老师实验日期3月31号实验名称实验五电导的测定及其应用一实验目的1测量KC…
-
电导率实验报告20xx
受控编号ZHJCGL021No实验报告监测项目电导率监测分析方法便携式电导率仪法郑州市环境保护监测中心站20xx年2月1日监测科室…
-
电导的测定及应用实验报告
实验名称一实验目的1测量KCl水溶液的电导率求算它的无限稀释摩尔电导率2用电导法测量醋酸在水溶液中的解离平衡常数3掌握恒温水槽及电…
-
电导的测定及其应用实验报告
电导的测定及其应用一、实验目的1、测量KCl水溶液的电导率,求算它的无限稀释摩尔电导率。2、用电导法测量醋酸在水溶液中的解离平衡常…
-
电导的测定及其应用实验报告
电导的测定及其应用一实验目的1测量KCl水溶液的电导率求算它的无限稀释摩尔电导率2用电导法测量醋酸在水溶液中的解离平衡常数3掌握恒…
-
华师物化实验报告 电导法测定乙酸乙酯皂化反应的速率常数
华南师范大学实验报告学生姓名学号专业年级班级课程名称物理化学实验实验项目电导法测定乙酸乙酯皂化反应的速率常数实验类型验证设计综合实…
-
电解质电导测定实验报告
实验三电解质溶液的电导测定实验一测得20ml蒸馏水的电导率KH2O251213uscm公式AmKK水1000C换算单位1S1000…
-
电导的测定及应用实验报告
实验名称一实验目的1测量KCl水溶液的电导率求算它的无限稀释摩尔电导率2用电导法测量醋酸在水溶液中的解离平衡常数3掌握恒温水槽及电…
-
电导的测定及其应用实验报告wqf
宁波工程学院物理化学实验报告专业班级姓名序号同组姓名指导老师实验日期3月31号实验名称实验五电导的测定及其应用一实验目的1测量KC…
-
电导的测定及其应用实验报告
电导的测定及其应用一实验目的1测量KCl水溶液的电导率求算它的无限稀释摩尔电导率2用电导法测量醋酸在水溶液中的解离平衡常数3掌握恒…
-
滴定法实验总结报告
蒸馏后碱滴定法1原理亚硫酸盐在酸性条件下用碱中和加热亚硫酸盐被过氧化氢吸收用碱中和并滴定至终点根据消耗标液用量计算其含量H2O2H…