【实验报告】血液凝固及其影响因素
实验五:血液凝固及其影响因素
实验人:
同组人:
【实验目的】
1. 学习血液凝固的基本过程
2. 了解加速或延缓血液凝固的一些因素
【实验原理】
血液凝固是一个酶的有限水解激活过程,在此过程中有多种凝血因子参与。根据凝血过程起动时激活因子来源不同,可将血液凝固分为内源性激活途径和外源性激活途径。内源性激活途径是指参与血液凝固的所有凝血因子在血浆中,外源性激活途径是指受损的组织中的组织因子进入血管后,与血管内的凝血因子共同作用而启动的激活过程。
【实验材料和用具】
家兔
清洁小试管7个、小烧杯2个、竹签、秒表、试管架、哺乳动物手术器械一套、兔手术台、动脉夹、塑料动脉插管、线、棉花、水浴槽、冰盒
液状石蜡、肝素、草酸钾1~2mg、脑匀浆液0.1ml、生理盐水
【实验过程】
1、 动物麻醉及颈部手术(此部由助教老师操作)
取一只动物,称重。按1g/kg体重的剂量将乌拉坦(氨基甲酸乙酯)由耳缘静脉缓慢注入,观察动物肌张力、呼吸与角膜反射的变化。动物麻醉后背位固定于兔手术台上。
剪去颈部手术野的毛,沿颈正中线在喉头上一指至锁骨上一指的地方作一5~7cm的皮肤切口。分离皮下组织及肌肉。
2、 颈总动脉插管(此部由助教老师操作)
在气管两侧辨别并分离颈总动脉,颈总动脉下方穿两条线备用。在左侧颈总动脉的近心端夹一动脉夹,在动脉夹远心端距动脉夹约3cm处结扎。用小剪刀在结扎线的近侧(结扎线与动脉夹之间)沿向心方向剪一小斜口(约占管径的一半),向心脏方向插入动脉插管,由备用的线结扎固定。取血时将动脉夹松开即可。
3、 血液凝固的加速和延缓观察
1. 打开兔颈总动脉夹,血液从动脉插管流出,弃去第一份1mL动脉血后,向每个试管中注入1mL兔动脉血,并摇匀。
2. 自血液流出动脉插管开始计时。除第1管外,其他各管每隔15秒钟将试管倾斜一次,观察液面是否倾斜即血液是否流动,直到试管内血液不再流动为止,记录凝血时间。
3. 当第2管已经凝固时,再倾斜第1管看血液是否凝固,若尚未凝固则按上述方法每隔15秒钟倾斜一次,直到血液凝固为止,记录凝血时间,即为该兔血的凝固时间。
4. 以第2管为对照,各管观察其他各管中血液凝固时间。
5. 向第9管中滴加2%氯化钙2滴,观察血液是否凝固。
6. 取出第5管中的玻棒,用水洗净,观察附着在玻棒上的纤维蛋白。
注意事项:
a) 取放试管时要用拇指和食指捏住试管的上端,不要握住试管的底部,以免手的温度影响结果。
b) 每支试管口径及采血量要尽量一致,不可相差太大。
c) 记录凝血时间要准确。
d) 判断凝血的标准要前后一致。一般以倾斜试管达45°时,试管内血液不见流动为准。
【实验结果及相关讨论】
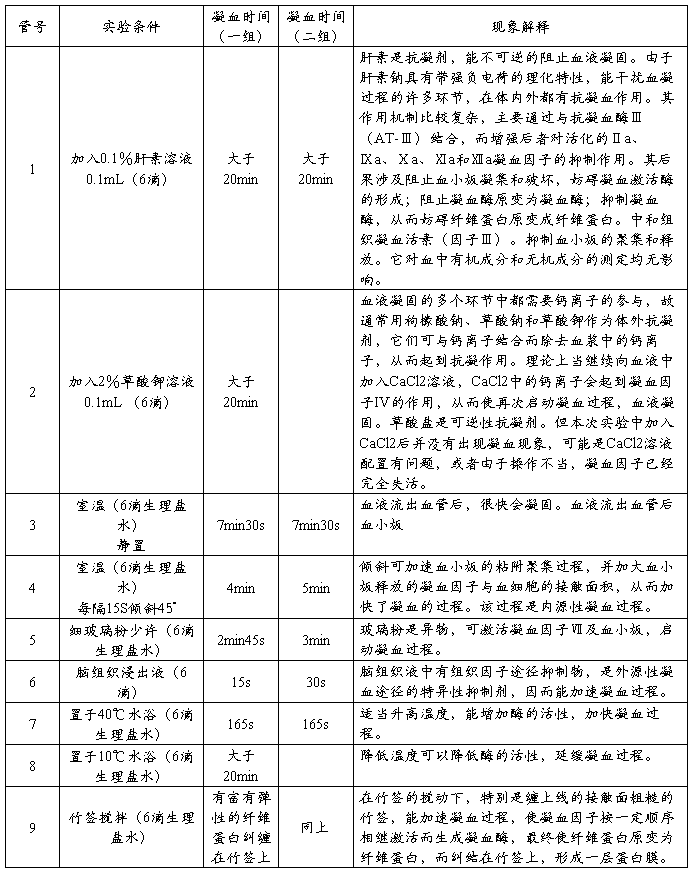
机体凝血系统包括凝血和抗凝两个方面,两者间的动态平衡是正常机体维持体内血液流动状态和防止血液丢失的关键。机体的正常止凝血,主要依赖于完整的血管壁结构和功能,有效的血小板质量和数量,正常的血浆凝血因子活性。其中,血小板和凝血因子是生理性止凝血的重要成分,(见图1)。抗凝系统不仅包括抗凝因子,还包括纤溶系统。

血小板的作用:
在正常的血液循环中,血小板并不与内皮细胞表面或其他细胞发生作用,而是沿着毛细血管内壁排列,维持其完整性,血管局部受损伤时,血小板的止血兼有机械性的堵塞伤口和生物化学性粘附聚集作用。止血时,首先是受损的血管壁发生收缩,使局部血液流动变慢或减少。血液中的血小板在vWF因子存在下迅速粘附于暴露的胶原纤维,此时血小板被激活,血小板形态发生改变,由正常的圆盘状态变为圆球形,伪足突起,血小板发生聚集(血小板膜糖蛋白IIb/IIIa由纤维蛋白原介导发生互相粘附、聚集),此为血小板第一相聚集,激活的血小板便发生释放反应和花生四烯酸代谢,其中许多物质,如血小板的ADP等,可加速血小板的聚集、变性成为不可逆的“第二相聚集”,形成白色血栓,构成了初期止血的屏障。与此同时,由血小释放和激活许多促凝物质参与血液凝固反应。血小板膜磷脂表面提供了凝血反应的场所,血小板第3因子在凝血过程多个环节中发挥重要作用,血小板合成释放的TXA2和5-HT促使进一步收缩,血小板收缩蛋白则最终可使纤维蛋白收缩(血块收缩),使血栓更为坚固,止血更加彻底。
凝血过程:
血液凝固简称凝血,是血液由流动状态变为凝胶状态的过程,它是止血功能的重要组成部分。凝血过程是一系列凝血因子被相继酶解激活的过程,最终生成凝血酶,形成纤维蛋白凝块。迄今为止,参与凝血的因子共有14个。其中用罗马数字编号的有12个(从Ⅰ-Ⅷ,其中因子Ⅵ并不存在)。习惯上,前4个凝血因子常分别称为纤维蛋白原(因子Ⅰ)、凝血酶(因子Ⅱ)、组织因子(因子Ⅲ)和钙离子(因子Ⅳ)。凝血因子VI已知是血清中活化的凝血因子V,故不再视为一独立的凝血因子。
1.内源性凝血途径
内源性凝血途径是指参加的凝血因子全部来自血液(内源性)。临床上常以活化部分凝血活酶时间(APTT)来反映体内内源性凝血途径的状况。内源性凝血途径是指从因子Ⅻ激活,到因子X激活的过程。当血管壁发生损伤,内皮下组织暴露,带负电荷的内皮下胶原纤维与凝血因子接触,因子Ⅻ即与之结合,在HK和PK的参与下被活化为Ⅻa。在不依赖钙离子的条件下,因子Ⅻa将因子Ⅺ激活。在钙离子的存在下,活化的Ⅺa又激活了因子Ⅸ。单独的Ⅸa激活因子X的效力相当低,它要与Ⅷa结合形成1:1的复合物,又称为因子X酶复合物。这一反应还必须有Ca2+和PL共同参与。
2.外源性凝血途径
外源性凝血途径:是指参加的凝血因子并非全部存在于血液中,还有外来的凝血因子参与止血。这一过程是从组织因子暴露于血液而启动,到因子Ⅹ被激活的过程。临床上以凝血酶原时间测定来反映外源性凝血途径的状况。组织因子是存在于多种细胞质膜中的一种特异性跨膜蛋白。当组织损伤后,释放该因子,在钙离子的参与下,它与因子Ⅶ一起形成1:1复合物。一般认为,单独的因子Ⅶ或组织因子均无促凝活性。但因子Ⅶ与组织因子结合会很快被活化的因子Ⅹ激活为Ⅶa,从而形成Ⅶa组织因子复合物,后者比Ⅶa单独激活因子Ⅹ增强16000倍。外源性凝血所需的时间短,反应迅速。外源性凝血途径主要受组织因子途径抑制物(TFPI)调节。TFPI是存在于正常人血浆及血小板和血管内皮细胞中的一种糖蛋白。它通过与因子Ⅹa或因子Ⅶa-组织因子-因子Ⅹa结合形成复合物来抑制因子Ⅹa或因子Ⅶa-组织因子的活性。另外,研究表明,内源凝血和外源凝血途径可以相互活化。
3.凝血的共同途径
从因子X被激活至纤维蛋白形成,是内源、外源凝血的共同凝血途径。主要包括凝血酶生成和纤维蛋白形成两个阶段。
(1) 凝血酶的生成:即因子Ⅹa、因子Ⅴa在钙离子和磷脂膜的存在下组成凝血酶原复合物,即凝血活酶,将凝血酶原转变为凝血酶。
(2) 纤维蛋白形成:纤维蛋白原被凝血酶酶解为纤维蛋白单体,并交联形成稳定的纤维蛋白凝块,这一过程可分为三个阶段,纤维蛋白单体的生成,纤维蛋白单体的聚合,纤维蛋白的交联。纤维蛋白原含有三对多肽链,其中纤维蛋白肽A(FPA)和B(FPB)带较多负电荷,凝血酶将带负电荷多的纤维蛋白肽A和肽B水解后除去,转变成纤维蛋白单体。从纤维蛋白分子中释放出的FPA和FPB可以反映凝血酶的活化程度,因此FPA和FPB的浓度测定也可用于临床高凝状态的预测。纤维蛋白单体生成后,即以非共价键结合,形成能溶于尿素或氯醋酸中的纤维蛋白多聚体,又称为可溶性纤维蛋白。纤维蛋白生成后,可促使凝血酶对因子ⅩⅢ的激活,在ⅩⅢa 与钙离子的参与下,相邻的纤维蛋白发生快速共价交联,形成不溶的稳定的纤维蛋白凝块。纤维蛋白与凝血酶有高亲和力,因此纤维蛋白生成后即能吸附凝血酶,这样不仅有助于局部血凝块的形成,而且可以避免凝血酶向循环中扩散。
在凝血共同途径中有两步重要的正反馈反应,有效地放大了内外源凝血途径的作用。
一是Xa形成后,可反馈激活因子Ⅴ、Ⅶ、Ⅷ、Ⅸ;
二是凝血酶形成后,可反馈激活因子Ⅴ、Ⅶ、Ⅷ、Ⅹ、Ⅺ、以及凝血酶原。凝血酶还可促使血小板发生聚集和释放反应,刺激血小板收缩蛋白引起血块退缩。但大量凝血的产生却反过来破坏因子Ⅷ、和因子Ⅴ,这是正常凝血的负反馈调节,以防止不适当的过度凝血。
抗凝剂的选择:
(1) 草酸钾:常用于尿素、肌酐、纤维蛋白原等测定,不能用钾、钙等测定,对LDH、丙酮酸激酶、AKP和淀粉酶有抑制作用。
(2) 肝素:常用于电解质、血气分析、血氨等测定。抗凝剂比例为50~61u肝素/5ml血。注意钠盐可使淀粉酶升高。
(3) 氟化钠:常用氟化钠—草酸钠混合抗凝剂作血糖测定的抗凝剂,氟化钠可以抑止烯醇化酶,它可避免血细胞葡萄糖酵解酶的作用,延长标本的保存时间。
(4) 二乙胺四乙酸钠盐(EDTA-Na2):生化常用的抗凝剂,但不能用于钙、钠、及含氮物质的测定,对淀粉酶、肌酸激酶、AKP、ALP、5’-核苷酸酶等可抑制,对丙酮酸激酶有明显升高的作用。
(5) 枸橼酸钠,测定血沉用3.8%枸橼酸钠抗凝,抗凝剂与血液比例为1:4,凝血试验需用3.2%枸橼酸钠抗凝,比例为1:9。
(6) 实验室使用抗凝剂种类较多,血细胞分析及红细胞比积测定宜用EDTA·K2抗凝,保证室温下6小时RBC体积不变,抗凝剂比例为1.0~2.0mg/1ml血。
【参考文献】
生理学 姚泰 人民卫生出版社
动物生理学实验 魏香 清华大学出版社
第二篇:实验性高钾血症及其治疗 实验报告 (2)
实验性高钾血症及其治疗
【实验目的】
1. 观察高钾血症时家兔心电图变化的特征。
2. 了解血钾进行性升高的不同阶段,高血钾对心肌细胞的毒性作用。
3. 了解高钾血症的基本治疗方法和抢救。
【实验原理】
血清钾高于5.5mmol/L为高钾血症(正常值:3.5~5.5mmol/L)。高钾血症对机体的危害主要表现在心脏,可使心肌动作电位和有效不应期缩短,传导性、自律性、收缩性降低,兴奋性则呈双相变化:轻度高钾血症使心肌兴奋性增高,急性重度高钾血症可使心肌兴奋性降低甚至消失,心脏停搏。高钾血症时的心电图表现为:①P波和QRS波波幅降低,间期增宽,可出现宽而深的S波;②T波高尖:高钾血症早期即可出现,严重高钾血症时可出现正弦波,此时,已迫近室颤或心室停搏;③多种类型的心律失常。高钾血症的抢救可采用:①注射Na+,Ca2+溶液对抗高血钾的心肌毒性;②注射胰岛素、葡萄糖,以促进K+移入细胞。
本实验通过静脉滴注氯化钾,使血钾浓度短时间内快速升高造成急性高钾血症,观察心电图变化,测定血钾浓度,了解高钾血症对心脏的毒性作用以及对高钾血症的抢救治疗措施。
【实验对象】
家兔,体重2~3kg,雌雄不限。
【实验药品与器材】
20%氨基甲酸乙酯(或3%戊巴比妥钠),2%、10%氯化钾溶液、10%氯化钙溶液、4%碳酸氢钠溶液,葡萄糖-胰岛素溶液(50%葡萄糖4ml加1U胰岛素),肝素生理盐水溶液(125单位肝素/ml生理盐水),手术器械、注射器、头皮针、取血器、生物信号采集处理仪、电解质测定仪。
【实验观察指标】
血钾浓度、心电图变化、呼吸频率、幅度和节律。
【实验方法与步骤】
1. 称重、麻醉和固定动物 家兔称重后,用20%氨基甲酸乙酯5ml/kg或3%戊巴比妥钠溶液1ml/kg从耳缘静脉缓慢注入。麻醉后,将动物仰卧位固定在实验台上,颈前部备皮。
2. 分离颈总动脉 按家兔血管常规分离方法分离颈总动脉,插入导管取血0.5~1ml测定实验前的血钾浓度。
3. 心电描记 将针型电极分别插入家兔四肢皮下。导联线按左前肢(黄),右前肢(红),左后肢(绿) ,右后肢(黑)的顺序连接,依生物信号记录仪使用方法描记实验前的心电图波形存盘,待实验结束后打印分析。
用头胸导联可描记出比普通导联更为高大清晰的心电图波形。方法是将右前肢电极插在下颏部皮下,左前肢的电极插在胸壁上相当于心尖部位的皮下。这样可较早发现高血钾家兔的心电图异常波形。
4. 氯化钾溶液注入方法 从耳缘静脉滴入2%氯化钾(15~20滴/min)。
5. 观察记录心电图 在静脉滴注氯化钾的过程中,观察生物信号采集处理仪显示器上心电图波形的变化。出现P波低压增宽、QRS 波群低压变宽和高尖T波时,描记存盘。同时取血0.5~1ml测定血钾浓度。
6. 实施抢救 当出现心室扑动或颤动波形后,立即停止滴注氯化钾,并迅速准确地由另外一侧耳缘静脉注入已预先准备好的抢救药物(10%氯化钙2m1/kg,或4%碳酸氢钠5m1/kg,或葡萄糖-胰岛素溶液7m1/kg)。如果短时间内无法快速输入抢救的药物,救治效果不佳。
待心室扑动或颤动波消失,心电图基本恢复正常时,再由颈总动脉采血测定救治后的血钾浓度。
7. 注入致死剂量的l0%氯化钾(8m1/kg),开胸观察心肌纤颤及心脏停搏时的状态。
【实验结果】
在静脉滴注氯化钾的过程中,出现P波低压增宽、QRS 波群低压变宽和高尖T波,如实验图所示。当出现心室扑动或颤动波形时,注入已预先准备好的抢救药物后,兔子开始平稳。如实验图所示。
【 实验结果与讨论】
1. 氯化钙、碳酸氢钠和葡萄糖-胰岛素溶液救治高钾血症的机制。
( 1)造成药物性碱血症,促使K+进入细胞内;
(2)Na+对抗K+对心脏的的抑制作用;
(3)可提高远端肾小管中钠含量,增加Na+-K+交换,增加尿钾排出量;
(4)Na+升高血浆渗透压、扩容,起到稀释性降低血钾作用;
(5)Na+有抗迷走神经作用,有利于提高HR。
2. 高钾血症的EGC表现。
ECG是诊断高钾血症程度的重要参考指标(快速而准确的方法)。
1.血清钾﹥6mmol/L时出现基底窄而高尖的T波。
2.血清钾7-10mmol/L时P-R间期延长,P波渐消失,QRS渐变宽;R波渐低,S波渐深,ST段与T波融合,Q-T间期缩短。
3.血清钾﹥7-10mmol/L时,以上改变综合后可使ECG呈正弦波形。
4.进而心室颤动。
5.由于许多高钾血症常用时合并代酸,低钙及低钠等,也对ECG改变有影响,因此有时必须仔细加以分析,始能确诊。
3. .心肌动作电位形成的离子基础
心肌复极复杂,时间长。
0期:除极 Na+快速内流 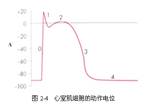
1期:复极 快速复极初期 K+外流
2期:平台期 K+外流与Ca2+内流相平衡
3期:快速复极末期 Ca2+通道失活,外向K+流随时间递增。(正反馈:膜内电位越负,K+外流越快,直至复极完成。)
4期:膜电位基本稳定于静息电位水平。自律细胞自动除极产生新的动作电位。
4. 高钾血症对心肌生理特性的影响。
1. 细胞膜对K+通透性
2.快反应细胞K+通道(Ik+2)
通透性↑, 钾外流↑
净内向电流↓ [K+]e↑—干扰Ca2+内流,
Ca2+内流延缓, Ca 2+内流↓
5. 室颤等心律失常的原因。
传导性↓----传导阻滞----诱发异位起搏点出现,异位心律,同时有效不应期↓
兴奋折返----室颤------血钾进一步升高-----严重阻滞------心跳停止。
【实验注意事项】
1. 保持动、静脉导管的通畅 每次由颈总动脉取血后,均用肝素生理盐水溶液2m1冲洗管道内的余血,防止导管内血液凝固。
2. 正确记录心电图波型 有时家免T波高出正常值0.5mV或融合在S-T段中而不呈现正向波,这与动物个体差异有关,此时要变换导联。若在头胸导联、肢体标Ⅱ导联及avF导联上描记出正向T波就可进行实验,否则需更换动物。
【实验结论】
1. 静脉补钾过多可造成家兔高钾血症。
2. CaCl2可拮抗高K+毒性。
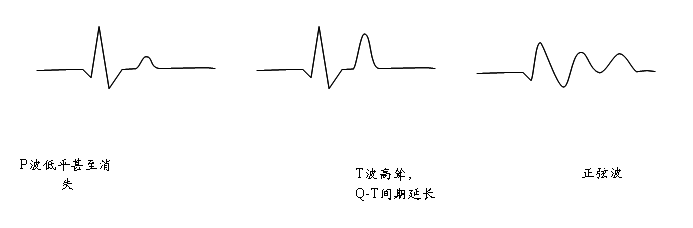
3. 高血钾心电图表现为P波低平甚至消失;QRS波增宽幅度减小;ST段抬高、延长;T波高尖。
附:高钾血症的影响
1对神经肌肉的影响
急性轻度高钾血症,由于细胞内外钾浓度差减小,静息电位负值变小与阈电位距离接近兴奋性升高。主要表现为感觉异常、肌肉痛疼、肌束震颤等症状。
急性重度高钾血症,随着细胞外钾浓度急剧升高,细胞内、外钾浓度差更小,静息期细胞内钾外流更少,静息电位接近阈电位,细胞膜快钠通道失活,神经肌肉兴奋性降低甚至消失。出现四肢软弱无力,甚至发生弛缓性麻痹。
2.2对心脏的影响
①对心肌生理特性的影响
Ø 心肌兴奋性先↑后↓:急性轻度高钾血症心肌兴奋性增高,急性重度高钾血症兴奋性降低,即先增高后降低。
Ø 心肌自律性↓:高钾血症心肌细胞膜对钾的通透性增强、舒张期(复极4相)钾外流增加钠内流相对缓慢,自律细胞自动去极化减慢自律性降低。
Ø 心肌传导性↓:静息膜电位的绝对值减少,0相去极化的速度降低,传导性降低。
Ø 心肌收缩性↓:高血钾,复极2相钙内流减少,心肌细胞内钙减少,兴奋-收缩偶联减弱心肌收缩性降低。
心肌自律性降低,可出现窦性心动过缓,窦性停博;传导性降低,出现各种类型的传导阻滞以及因传导性、兴奋性降低出现心脏停博。
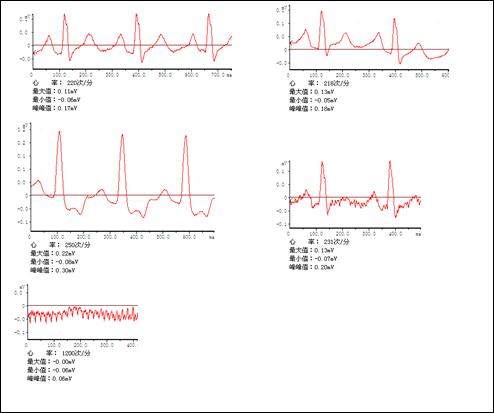
②心电图显示:P波压低、R波低、QRS综合波增宽、T波狭窄、高耸、Q-T间期缩短等,(见下图)
③对酸碱平衡的影响
高钾血症时,细胞外K+进入细胞内,细胞内的H+移至细胞外,导致代谢性酸中毒。由于细胞内的H+降低,肾脏远曲小管上皮排泌H+减少,使细胞外液的H+进一步增高。
附2:
-
细胞凝集反应实验报告
20xx年4月16日姓名班级13级生命基地班学号同组者科目细胞生物学实验实验题目细胞凝集反应实验题目细胞凝集反应实验目的1了解细胞…
-
细胞凝集反应实验报告
细胞生物学实验报告一二实验名称细胞凝集反应实验原理细胞膜是双层脂镶嵌蛋白质结构脂和蛋白质又能与糖分子结合为细胞表面的分支状糖外被目…
-
细胞凝集反应实验报告 山东大学
20xx年9月30日科目细胞生物学实验题目细胞凝集反应细胞凝集反应实验目的1了解细胞膜的表面结构2掌握凝集素促使细胞凝集的原理3学…
-
细胞凝集反应 实验报告
姓名董朔晖系年级生命科学院20xx级学号20xx00230164科目细胞生物学实验实验题目细胞凝集反应日期20xx223实验一细胞…
-
直接凝集反应实验报告
免疫学直接凝集反应实验报告实验一玻片凝集实验1实验原理颗粒性抗原细菌红细胞等与相应的抗体结合在适量电解质通常是085NaCl存在的…
-
影响血液凝固的因素实验报告书写
影响血液凝固的因素一实验目的通过本实验来了解血液凝固的基本过程及了解影响血液凝固的一些因素二实验对象家兔三实验步骤略四实验结果1观…