蔗糖水解报告
课程名称: 应用物化实验
实验项目: 均相酸催化蔗糖水解反应
【实验目的】
1. 根据物质的光学性质研究蔗糖水解反应,测量其反应速率常数。
2. 了解旋光仪的基本原理,掌握使用方法。
3. 研究不同种类酸催化对蔗糖水解反应反应速率常数的影响,验证Brfnsted 定律。
4. 研究不同浓度酸对蔗糖水解反应反应速率常数的影响,了解催化剂的比活性概念。
【实验原理】
1、蔗糖的水解反应和利用旋光法测水解速率常数的原理
参见华南师范大学实验中心编写《基础物理化学实验》p108实验14:旋光法测定蔗糖转化反应的速率常数。
蔗糖在水中转化为葡萄糖和果糖:
H+
C12H22O11 + H2O —→ C6H12O6 + C6H12O6
(蔗糖) (葡萄糖) (果糖)
其中,蔗糖和葡萄糖是右旋的,果糖是左旋的,但果糖的比旋光度比葡萄糖大,反应过程中,溶液的旋光度将由右旋逐渐变为左旋。
蔗糖水解反应是一个二级反应,但由于水是大量存在的,在反应过程中可以认为浓度不变,在反应过程中的氢离子是一种催化剂,也可以认为浓度不变,由此,蔗糖水解反应可作为准一级反应来处理,称为“准一级反应”。
如果以 c 表示到达 t 时刻的反应物浓度,k 表示反应速率常数,则一级反应的速率方程为:
- dc / dt = kt
对此式积分可得:
ln c = - kt + ln c 0
式中 c 为反应过程中的浓度,c 0为反应开始时的浓度。当 c = c 0 / 2 时,时间为 t 1/2,称为半衰期。代入上式,得:
t 1/2 = ln 2 / k = 0.693 / k
测定反应过程中的反应物浓度,以 ln c 对 t 作图,就可以求出反应的速率常数 k。在这个反应中,利用体系在反应进程中的旋光度不同,来度量反应的进程。
用旋光仪测出的旋光度值,与溶液中旋光物质的旋光能力、溶剂的性质、溶液的浓度、温度等因素有关,固定其它条件,可认为旋光度α与反应物浓度c成线性关系。物质的旋光能力用比旋光度来度量:

蔗糖的比旋光度[α]D20=66.6°,葡萄糖的比旋光度[α]D20=52.5°,果糖是左旋性物质,它的比旋光度为[α]D20=-91.9°。因此,在反应过程中,溶液的旋光度先是右旋的,随着反应的进行右旋角度不断减小,过零后再变成左旋,直至蔗糖完全转化,左旋角度达到最大。
当t=0时,蔗糖尚未开始转化,溶液的旋光度为:
α0 = β反应物c 0 ...... 1
当蔗糖已完全转化时,体系的旋光度为:
α∞ = β生成物c 0 ...... 2
此处,β 为旋光度与反应物浓度关系中的比例系数。
时间 t 时,蔗糖浓度为 c,旋光度应为:
αt = β反应物c + β生成物(c 0 - c) ...... 3
由1、2式:
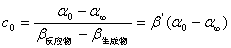
由2、3式:

代入 ln c = - kt + ln c 0 式,可得:
ln (αt -α∞) = - kt + ln ( α0-α∞)
根据实验测得的反应过程中的旋光度值计算 ln (αt -α∞),再对时间作图,可得一条直线,根据直线斜率可求得反应速率常数k。
2、均相酸催化Brfnsted 定律
参见傅献彩主编《物理化学》下册 P287-289。
催化活性与催化剂的酸、碱强度有关,存在如下关系式:


若以水为溶剂, 则

其中,GA,GB、a和b与溶剂,温度和催化反应的种类有关,a和b值在0与1之间.上述关系首先为Brfnsted等在研究硝酰胺的分解时所建立,故一般被称为Brfnsted 定律.
3、催化剂的比活性
催化活性是指催化剂催化物质发生反应的能力,是催化剂的重要性质之一。物质的催化活性是针对给定的化学反应而言的。通常,催化剂并不按照化学方程式计量关系进行作用,其用量可以是任意的。在相同条件下,反应速率与催化剂用量成正比,在均相催化中可以用生成中间化合物来解释。为了描述不同物质催化活性的差异,工业生产上常以每单位容积(或质量)催化剂在单位时间内转化原料反应物的数量来表示,如每立方米催化剂在每小时内能使原料转化的千克数。对于液相催化反应,通常用速率常数与催化剂浓度之比来表示比催化剂活性。比催化活性表明,催化剂的催化作用取决于其本性,而与用量无关。
【仪器与药品】
旋光仪 1 台; 停表 1 块
容量瓶(250 ml) 2 个; 天平(0.001g) 1 台
锥形瓶(100 ml) 2 个; 移液管(25 ml) 2 支
蔗糖(分析纯);HCl 溶液(6M);HAC(4 M);磷酸(4 M);硫酸(4M);甲酸(4M)
【实验步骤】
1.测定不同浓度盐酸(6M和3M) 催化蔗糖水解的速率常数,计算盐酸的比催化活性。
 2.测定不同种类酸对催化速率常数的影响,包括HAC(4 M)、磷酸(4 M)、硫酸(4M)、甲酸(4M), 验证Brfnsted 定律: 。
2.测定不同种类酸对催化速率常数的影响,包括HAC(4 M)、磷酸(4 M)、硫酸(4M)、甲酸(4M), 验证Brfnsted 定律: 。
具体步骤如下:
①校正旋光度仪零点。
打开旋光度仪器预热几分钟,旋光管内注满蒸馏水,旋紧套盖,用纸擦净两端玻璃片,放入旋光仪内,盖上槽盖。调节目镜使视野清晰。然后旋转检偏镜能观察到明暗相等的三分视野为止,记下刻度盘读数,重复操作三次,取其平均值,此即为旋光仪零点。测毕取出旋光管,倒出蒸馏水。
②蔗糖水解过程中 的测定
的测定
用量筒量取30mL蔗糖溶液和30mL6 mol/L HCI溶液分别注人两个100mL干燥的带塞三角瓶中,并将此同时置于室温中恒温5~10分钟。待恒温后将HCI溶液迅速加到蔗糖溶液的锥形瓶中混合,来回倒三次使之充分混合,并在HCI溶液加入时开动计时作为反应的开始时刻,迅速取适量混合液清洗旋光管2~3次,然后将此混合液注满旋光管,盖好玻璃片旋紧套盖(检查是否漏气和是否有气泡),擦净旋光管两端玻璃片,立刻置于旋光仪中盖上槽盖。测量各时间t时溶液的旋光度 ,测定时要迅速准确。每隔3min读一次,30min后每5min读一次。
,测定时要迅速准确。每隔3min读一次,30min后每5min读一次。
③ 的测定
的测定
将剩余的混合液置于60℃左右的水浴中温热30min,以加速水解反应,然后冷却至实验温度。按上述操作,测其旋光度,此值即可认为是 。
。
④重复上述操作,测定3M盐酸、醋酸(4 M)、磷酸(4 M)、硫酸(4M)中蔗糖水解过程中 和
和 。
。
【数据处理】
1、盐酸(6M、4M)、甲酸(4 M)、磷酸(4 M)、硫酸(4M)催化蔗糖水解中的实验数据
盐酸浓度 6 mol/L  -1.566
-1.566
表 1 盐酸(6M)催化蔗糖水解中的实验数据


图 1 盐酸(6M)催化蔗糖水解过程中ln(at-a¥)随反应时间t的变化
表 2 盐酸(6M)催化蔗糖水解中的线性拟合曲线和速率常数

盐酸浓度 3 mol/L  -1.475
-1.475
表 3 盐酸(3M)催化蔗糖水解中的实验数据


图 2 盐酸(3M)催化蔗糖水解过程中ln(at-a¥)随反应时间t的变化
表 4 盐酸(3M)催化蔗糖水解中的线性拟合曲线和速率常数


图 3 不同浓度的盐酸(6M、3M)催化蔗糖水解过程中ln(at-a¥)随反应时间t的变化
甲酸浓度 4 mol/L  -1.475
-1.475
表 5 甲酸(4M)催化蔗糖水解中的实验数据




图4 甲酸(4M)催化蔗糖水解过程中ln(at-a¥)随反应时间t的变化
表 6 甲酸(4M)催化蔗糖水解中的线性拟合曲线和速率常数

硫酸浓度 4 mol/L  -1.502
-1.502
表 7 硫酸(4M)催化蔗糖水解中的实验数据


图5 硫酸(4M)催化蔗糖水解过程中ln(at-a¥)随反应时间t的变化
表8 硫酸(4M)催化蔗糖水解中的线性拟合曲线和速率常数

磷酸浓度 4 mol/L  -1.231
-1.231
表 9 磷酸(4M)催化蔗糖水解中的实验数据

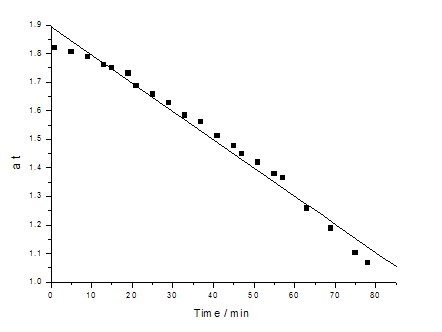
图6 磷酸(4M)催化蔗糖水解过程中ln(at-a¥)随反应时间t的变化
表10 硫酸(4M)催化蔗糖水解中的线性拟合曲线和速率常数


图7 不同浓度不同种类的酸(4M)催化蔗糖水解过程中ln(at-a¥)随反应时间t的变化
2、不同种类酸不同浓度的酸在催化蔗糖水解中的比催化活性比较
表11 不同种类酸在催化蔗糖水解中的比催化活性比较

 3、根据Brfnsted定律: ,由硫酸和磷酸的速率常数和解离平衡常数,计算出Ga和a。
3、根据Brfnsted定律: ,由硫酸和磷酸的速率常数和解离平衡常数,计算出Ga和a。
H2SO4的一级解离常数:1.0´103
H3PO4的一级解离常数:7.52´10-3
甲酸的解离常数:1.8´10-4
联立方程,计算得到:
Ga=0.0301
a=0.2277
4、不同种类酸不同浓度的酸在催化蔗糖水解中的反应速率常数k比较
表12 不同种类酸在催化蔗糖水解中的反应速率常数k比较

【结果与讨论】
1、不同种类、不同浓度的酸在催化蔗糖水解中的反应速率常数k比较。
由图3、表12可得,在同一温度下,6mol/L盐酸的k值是3mol/L盐酸的k值的7.45倍。可推断,盐酸的浓度越大,反应速率常数越大。查阅文献得知:在同一温度下, 酸度每增加0.5mol/L,速率常数约增至原来的1.5-1.6倍,说明氢离子浓度对蔗糖水解的反应常数有很大的影响。反应的速率常数是和氢离子的浓度线性相关。lgk=lgk'-pH这一公式,k'其实和比催化活性是相同的。该公式应该对同一种酸的不同浓度使用。或者对特殊酸催化体系(只与氢离子有关,与其他离子存在无关)适用。
由图7、表12可得,在同一温度下,相同浓度的硫酸、磷酸、甲酸的反应速率常数是递减的。这跟酸的电离有关。H2SO4的一级解离常数:1.0´103,H3PO4的一级解离常数:7.52´10-3 甲酸的解离常数:1.8´10-4 可见,相同浓度的酸电离出氢离子越多的,反应速率常数越大。
2、不同种类、不同浓度的酸在催化蔗糖水解中的比催化活性比较。
由表11可得,在同一温度下,6mol/L盐酸的比催化活性值是3mol/L盐酸的3.775倍。可推断,盐酸浓度大的比催化浓度大。
在同一温度下,4mol/L的硫酸和磷酸,硫酸的比催化活性比磷酸的大。H2SO4的一级解离常数:1.0´103,H3PO4的一级解离常数:7.52´10-3 这是由于氢离子的浓度不同使得比催化活性不同。
3mol/L 的盐酸的比催化活性比4mol/L的硫酸大,可推断,相同浓度的盐酸和硫酸,盐酸的比催化活性比硫酸的大。H2SO4的一级解离常数:1.0´103 盐酸是完全电离。相同浓度的盐酸和硫酸,氢离子浓度相差不大,因此酸根离子的存在对蔗糖的水解有一定的影响。
3、氢离子催化蔗糖水解反应对酸的强度敏感性分析。
 根据Brfnsted定律: ,其中a 值为0~1。a越小,表明反应对催化剂的酸强度不敏感,此时任何一种酸都是优良的催化剂,反应与催化剂酸强度无关。a接近1,表明反应对催化剂算强度很敏感,只有强酸才能催化该反应。本次实验中通过联立方程得到 a=0.2277 Ga=0.0301。a比较小,说明蔗糖反应对氢离子的酸度不敏感,因此,此时任何一种酸能算是优良的催化剂,反应与催化剂酸强度无关。
根据Brfnsted定律: ,其中a 值为0~1。a越小,表明反应对催化剂的酸强度不敏感,此时任何一种酸都是优良的催化剂,反应与催化剂酸强度无关。a接近1,表明反应对催化剂算强度很敏感,只有强酸才能催化该反应。本次实验中通过联立方程得到 a=0.2277 Ga=0.0301。a比较小,说明蔗糖反应对氢离子的酸度不敏感,因此,此时任何一种酸能算是优良的催化剂,反应与催化剂酸强度无关。
4、不同种类、不同浓度的酸在催化蔗糖水解中的 不同,所耗费的时间也不同。
不同,所耗费的时间也不同。
在同一温度下,6mol/L盐酸催化后的 比3mol/L盐酸的
比3mol/L盐酸的 小,且耗费的时间短。
小,且耗费的时间短。
在同一温度下,4mol/L的硫酸、磷酸,磷酸催化后的 比硫酸的
比硫酸的 小,但磷酸所耗费的时间比较长。这跟氢离子的浓度和不同酸的比催化活性有关。
小,但磷酸所耗费的时间比较长。这跟氢离子的浓度和不同酸的比催化活性有关。
5、误差分析
(1)温度的影响。
实验过程中,在测定αt的几十分钟内室温和反应液温度变化不大,但是钠光灯产生的热量沿旋光仪机身以导热方式逐渐向样品管方向传递,经过一定时间后,反应液温度开始上升,蔗糖转化反应速率加快,导致测得的αt值下跳,实验温度不恒定,引入误差。
(2)本实验是以 ln(at-a¥)对t作图,从拟合直线的斜率即可求出蔗糖水解反应的反应速率常数k值,拟合曲线引入误差,但是拟合曲线的相关系数均在0.98以上,可忽略不计。
【思考题】
1、为什么可以用蒸馏水校正仪器零点?
答:蒸馏水没有旋光性,旋光度为零,又因为它无色透明,方便可得,化学性质较为稳定,可以用作校正。
2、测量旋光仪为什么要进行零点校对?3、本实验可否不进行零点校正?为什么?
答:长时间使用会使得旋光仪的精度和灵敏度变差,故需要对零点进行校正。如果不校正,会使测量值的精确度变差,产生误差。
本实验数据处理时,是采用旋光度的差值进行作图和计算,仪器精度误差可以抵消,所以不进行零点较正,对结果影响不大。
4、为什么配制溶液可用天平称量?
答:蔗糖水解为准一级反应,反应物起始浓度不影响反应速度常数,又因为蔗糖浓度大用量较多,量值的有效数字位数较多,故不需要精确称量。
【参考文献】
[1] 傅献彩、沈文霞、姚天扬编.物理化学[M].第五版.北京:高等教育出版社,2006:287-289
[2] 华南师范大学化学实验教学中心组编.物理化学实验[M].北京:化学工业出版社,2007:108-111
[3] 孙尔康、徐维清、邱金恒编.物理化学实验[M].第一版.南京:南京大学出版社,2002
[4] 东北师范大学等校编.物理化学实验[M].第二版.北京:高等教育出版社,2000
[5] 北京大学化学学院物理化学实验教学组编.物理化学实验[M].第四版.北京:北京大学出版社,2002
-
蔗糖水解 实验报告
蔗糖水解一实验目的1用旋光法测定蔗糖在酸存在下的水解速率常数2掌握旋光仪的原理与使用方法二实验原理蔗糖水溶液在有氢离子存在时将发生…
-
蔗糖水解实验报告(标准版)
蔗糖水解实验报告实验人20xx1161034文昊20xx年1月1日2248于16405寝室整理蔗糖水解实验数据处理外界压力9795…
-
蔗糖水解反应 实验报告
一实验预习30分1实验装置预习10分年月日指导教师签字成绩2实验仿真预习10分年月日指导教师签字成绩3预习报告10分指导教师签字成…
-
葡萄糖性质实验报告、蔗糖的水解反应
检验葡萄糖性质实验报告一必考实验目的检验葡萄糖中是否有醛基所用仪器试管试管夹胶头滴管酒精灯所用药品10NaOH溶液CuSO4溶液葡…
-
蔗糖的转化实验报告思考题
1实验中为什么用蒸馏水来校正旋光仪的零点在蔗糖转化反应过程中所测的旋光度是否需要零点校正为什么答1因为水是非旋光性物质其旋光度为0…
-
实验八蔗糖水解反应速率常数的测定
宁波工程学院物理化学实验报告实验名称实验八蔗糖水解反应速率常数的测定一实验目的1了解蔗糖水解反应体系中各物质浓度与旋光度之间的关系…
-
旋光法测定蔗糖转化反应的速率常数实验报告。。
旋光法测定蔗糖转化反应的速率常数一实验目的1了解反应的反应物浓度与旋光度之间的关系2了解旋光仪的基本原理掌握其基本使用方法3利用旋…
-
旋光法测定蔗糖转化反应的速率常数-实验报告
六旋光法测定蔗糖转化反应的速率常数一目的要求1测定蔗糖转化反应的速率常数和半衰期2了解该反应的反应物浓度与旋光度之间的关系3了解旋…
-
实验报告蔗糖水解反应速率常数的测定
蔗糖水解反应速度常数的测定一实验目的1根据物质的光学性质研究蔗糖水解反应测定其反应速度常数2了解旋光仪的基本原理掌握使用方法3学习…
-
蔗糖水解反应 实验报告
一实验预习30分1实验装置预习10分年月日指导教师签字成绩2实验仿真预习10分年月日指导教师签字成绩3预习报告10分指导教师签字成…