染色体标本制作与观察 实验报告
【实验题目】
染色体标本制作与观察
【实验目的】
1、掌握小鼠睾丸细胞染色体标本的基本制作过程和Giemsa染色法,了解各操作步骤的原理。
2、了解常用实验动物染色体的数目及特点。
3、认识不同生物染色体的特征,学会做染色体组型图。
【实验材料与用品】
1. 器材:显微镜、载玻片、盖玻片、镊子、手术剪、解剖盘、胶头滴管、离心管、离心机、
小烧杯、冰箱、酒精灯、小烧杯等
2. 材料:小鼠
3. 试剂:蒸馏水、0.9% NaCl溶液、0.3% KCl溶液,固定液(甲醇:冰醋酸=3:1)、
秋水仙素
【实验原理】
一、制作染色体标本的先决条件
? 细胞具有旺盛的分裂能力:选择活跃的组织,如胸腺、骨髓、睾丸、小肠;或施加药物使
细胞分裂(PHA)
? 设法得到大量的分裂中期细胞:利用秋水仙素
二、染色体
染色体是基因的载体。真核细胞染色体的数目和结构是重要的遗传特性之一。制备染色体标本是细胞学最基本的技术之一,优良的染色体制片是进行染色体显带、组型分析、原位杂交等的先决条件。
染色体的制备在原则上可以从所有发生有丝分裂的组织和细胞悬浮液中得到。最常用的途径是从骨髓细胞、血淋巴细胞、、和组织培养的细胞中制备染色体。本实验采用的方法是从小鼠的睾丸细胞中获取。
染色体的形态结构在细胞增殖周期中是不断的运动变化的,一般在有丝分裂中期,染色体形态最典型、最易辨认和区分。因此,制备染色体标本获取的是中期细胞。
染色体特征:数目、长度(绝对长度、相对长度)、着丝粒位置(M/SM/ST/T)、随体与次缢痕的数目大小和位置、带型分析
描述染色体的四个参数:
① 相对长度=(每条染色体的长度)/(单倍常染色体之和+X染色体)*100,相对长度可以
用来表示每条染色体的长度。
② 臂指数=(长臂的长度)/(短臂的长度),臂指数可以用来确定臂的长度。
③ 着丝粒指数=(断臂长度)/(染色体全长)*100,着丝粒指数可以决定着丝粒的相对位
置 。
④ 染色体臂数(NF),根据着丝粒的位置来确定。
三、操作原理
小型动物的染色体制片最好最有效的材料就是骨髓组织(由于分裂活动旺盛,睾丸也可)利用睾丸细胞的制片技术虽然需要离心以及细致的操作,但基本程序并不复杂。在小鼠睾丸中,细胞有丝分裂和减数分裂比较旺盛,因此不需要体外培养就可以直接得到分裂中期细胞。通过小鼠睾丸得到染色体比较简便,一般不需要无菌操作。用秋水仙素作为有丝分裂的抑制剂,将其注入到小鼠腹腔中,可以阻止分裂细胞纺锤体的形成。
由于小鼠睾丸细胞分裂活动旺盛,具有高度的分裂能力,本次实验通过前处理、低渗、固定、制片染色等步骤制得染色体标本,可观察到许多处于分裂中期的染色体,可以进行染色体组型分析。
Giemsa染色法的染色结果:细胞核染成紫红色、细胞质和核仁染成蓝紫色
四、制作染色体标本的意义
了解染色体的特征(形态、大小、数目)——绘制染色体组型图
染色体组型:把真核动物一个体细胞各染色体按长度、形状、着丝粒位置排列成一定顺序。
染色体核型:某一物种特有的一组或一套染色体的形态特征。
染色体组型图的应用
① 鉴别生物种类:兔44条;小鼠40条;大鼠42条;鸡78条;猫38条;狗78条;马64
② 遗传病的诊断和研究:三体综合征(含三条21号染色体)、卵巢退化症(含45条染色体,比正常人缺少一条性染色体)、睾丸退化症(含47条染色体,比正常人多一条X或Y染色体)等。因此,我们可以给孕妇抽取羊水检查器胎儿的染色体,做遗传病早期诊断。
染色体标本的制作
1)PHA:促细胞分裂,使淋巴细胞返幼,变为淋巴母细胞
2)秋水仙素:破坏微管装配,使纺锤体不能形成,大量细胞停止在分裂中期
3)低渗作用:水进入细胞内,细胞内容空间变大,染色体间距拉大,易于分散开
4)空气干燥:使细胞和染色体展开
5)固定:用carnoy’s solution(甲醇:冰醋酸=3:1)作用使蛋白质变性,对于染色体内的组蛋白来讲,变性后硬度增加,保持了染色体的即时形态,对细胞膜蛋白来讲,变性使细胞膜硬度增强。形成屏障作用,防止了细胞内物质外溢和丢失。
6)视野中染色体可能是20或40条左右,因为细胞可能处于减数第一次分裂和减数第二期分
裂时期。
【实验步骤】
一、小白鼠染色体标本制作步骤
(1) 取雄性小鼠,以每克体重4ug注射秋水仙素,14-16h后,用断头法处死小鼠,取出睾
丸用生理盐水(0.9% NaCl溶液)洗去血污。
(2) 将睾丸放入装有1mL 0.3% KCl溶液的小烧杯中剪碎至液体呈乳白色。
(3)用铜网过滤到刻度离心管中,再加0.3% KCl溶液至4mL。
(4)37℃静置30min,低渗处理。
(5)以800-1000r/min离心8分钟。
(6) 弃上清液,加入2mL甲醇.冰醋酸固定液(3:1),并用吸管至管底吹气,轻轻打散细
胞,固定8min。
(7) 再以800-1000r/min离心8分钟。
(8) 弃上清液,加入1mL甲醇·冰醋酸固定液制成细胞悬液,固定5min。
(9) 取去洁净的低温预冷载片,取出后立即用吸好细胞悬液的滴管在距载玻片10-15cm的
高度滴下2-3滴细胞悬液,从载玻片一边向另一边轻轻吹气,同时轻轻敲打载玻片,以
使细胞均匀分布,促使染色体展开。
(10) 用滤纸擦去载片上的多余液体,空气干燥。
(11)用Giemsa染色20-30分钟,细水流反面冲洗载玻片以洗去多余染液,自然晾干。
(12)镜检。低倍镜下寻找分散良好,染色适中的分裂相,高倍镜或油镜下观察染色体形态,
找到处于细胞分裂中期的染色体。
【实验结果与分析】
I.实验结果
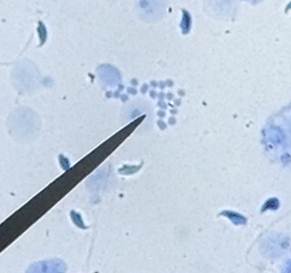
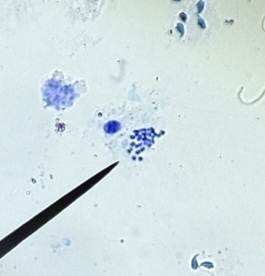
图1:40倍镜下观察染色体组 图2:40倍镜下观察结果
II.实验分析
结果分析:
本实验采用的是小鼠的睾丸细胞,在40倍镜下观察,视野中可见许多未成熟的精子(如图1),另外能够找到很多处于分裂间期和前期的染色体,其凝集程度不是很高;分析可知,处于减数第一次分裂的中期的细胞是二倍体,可观察到20对即40条染色体,有些在进行减数第二次分裂中期,这样的细胞是单倍体,应有20条染色体。
观察中会出现少于20条染色体的情况,或者多于20条少于40条的情况,可能原因:
1)在制备细胞悬液过程中有染色体的丢失。如用吸管吹散细胞时用力过大造成细胞破裂,
使得染色体弥散在溶液中,在随后的离心中将会丢失。
2)在距离载玻片一定高度滴片时因高度过高,使得染色体过于分散而导致丢失。
3)滴完片在敲打载玻片的过程中导致染色体的丢失。
4)染色时,由于在染液中染了30min,部分染色体可能会随染液丢失。
实验中没有观察到完全展开好的染色体,染色体大多呈棒状而不是V字形,这说明在对染色体展平的步骤没有做好,以后应改进。
做好本次实验的关键步骤:
1)低渗处理过程。低渗溶液的量、处理时间均与细胞的数量有关。低渗过度,细胞会破裂;低渗不足则染色体聚在一起分散不开。
2)离心速度以及离心时间也能影响染色体标本的制备。离心速度过大或离心时间过长,则会引起细胞破裂;反之,离心速度过小或离心时间过短,则细胞沉降不下来,则会引起大量细胞的丢失。
3)固定液要随用随配。固定彻底后再打散细胞团块,否则细胞容易破碎,染色体分散亦受到影响。
4)用吸管吹散细胞时用力必须尽量轻柔。用力过大则会造成细胞破裂,而染色体也会弥散在溶液中,在随后的离心中将会丢失。
5) 载玻片要预冷。拿出预先冰好的载玻片后要立即滴加细胞悬液,这就需要在拿载玻片之前先用滴管吸好液体,若玻片的冷却温度不够,则会影响染色体的附着和铺展。
6) 滴片时的高度很重要。高度过低细胞不会破裂,过高则染色体过于分散甚至丢失,无法辨别出染色体的准确数量。
在观察中还发现,视野中细胞不是很分散,存在大量细胞团,这可以归结为多方面原因。首先,如果在剪碎组织时没有剪好,则会导致细胞匀浆中含有大量细胞团,由于这些细胞聚集在一起,就有一定的组织强度,十几厘米的高度很难摔碎。其次,如果低渗不完全,细胞可能膨胀程度不够,很难摔碎。再次,如果混匀细胞时没有完全混匀,则会导致细胞聚集在一起,敲细胞时很难敲碎,同样观察不到理想的效果;如果吹得太用力,则会导致细胞被吹碎,视野中有大量细胞碎片,影响观察。最后,如果滴片时的高度不够,细胞分散不好,也很能破碎,染色体也就不能很好地展开。
【注意事项】
1、注射秋水仙素:应选择腹腔注射,如果观察到小鼠被注射后皮肤隆起,则表明注射到皮下,应重新注射;如果在拔出针时观察到有血珠溢出,则是因为注射时损伤了部分器官或血管,秋水仙素会随血液传递到全身,其传递速度会加快,其死亡时间可能小于15-16h,应随时观察小鼠,以防其突然死亡。即使注射到小鼠的腹腔中,也很有可能注射到起脂肪组织中,使小鼠的死亡时间变慢。因此应根据具体实验,适当调整注射时间和等待时间。
2、处死小鼠:最好选择在小鼠将要死亡时处死小鼠,因为此时,秋水仙素的作用发挥到最大,分裂期中期的细胞最多;如果等小鼠死亡后处死小鼠,小鼠尸体可能已僵硬,难以取到精巢。
3、剪碎组织:可以取少于1mL0.3% KCl溶液,没过杯底即可,如果液体太多则很难剪到组织,比较浪费时间。
4、铜网过滤:应把组织尽量剪碎后再用铜网过滤;如果烧杯中仍有较大颗粒,则小心不要把那些颗粒倒出,在烧杯中再加入少量0.3% KCl溶液,继续剪;如果铜网上还有很多比较大的颗粒,先用少量0.3% KCl溶液将其冲入烧杯,再进行剪碎。
5、实验步骤中的(4)所提到的30min包括(5)中的离心配平时间,因此,真正的静置时间应少于30mins,细胞与0.3% KCl接触的总时间应为45mins左右。
6、离心:离心的转速是800-1000r/min,这样低的转速是为了防止细胞破裂。
7、再次离心和固定:这样做是因为第一次离心之前细胞经过了低渗处理,虽然抽去了上清液,但是不可能抽干净,因此,再次离心保证细胞离开低渗环境。
8、吹散细胞:应该轻轻地吹细胞,如果太用力会导致细胞破裂。
9、摔碎细胞:摔碎细胞时应注意滴管与载玻片的距离,如果距离太小,则细胞很难摔碎,不会观察到染色体;但如果距离太大,会使细胞完全的碎开,染色体布满视野,虽然观察到染色体,但不能明确分出哪些是同一个细胞的,会给计数造成一定的难度。
10、染色:染色之后应冲去染液并晾干,注意使用小水流并从背面冲洗,这样可以避免冲去细胞。
第二篇:实验四 植物染色体标本的制备与观察
实验四 植物染色体标本的制备与观察
一、实验目的
1、掌握常规压片法制备植物染色体标本。
2、了解中期染色体的形态和结构以及染色体的生物学意义。
二、实验原理
染色体是细胞分裂时期遗传物质存在的特定形式,是染色质紧密包装的结果,对染色体的观察在研究生物进化、发育、遗传和异变中有十分重要的作用。
植物染色体标本的制备,常用分生组织如根尖、茎尖和嫩叶做材料。常规压片法仍是当今观察植物染色体常见的方法,其程序包括取材、预处理、固定、解离、染色和压片等步骤,简单易操作,但是染色体易变形、难分散开。
三、实验仪器、材料和试剂
(一)仪器、用具:显微镜、剪刀、镊子、刀片、培养皿、滤纸、吸水纸、青霉素瓶、染色缸、载玻片、盖玻片、玻璃板、酒精灯。
(二)材料:蚕豆(Vicia faba, 2n=2x=12)、黑麦(Secale cereale, 2n=2x=14)、大麦(Hordeum sativum, 2n=2x=14)、普通小麦(Triticum aestivum, 2n=2x=42)、玉米(Zea mays, 2n=2x=20)、豌豆(Pisum sativum, 2n=2x=14)、洋葱(Aillum cepa,2n=16)等根尖。
(三)试剂
1、 Carnoy固定液、1%秋水仙素(或对二氯苯)。
2、苯酚品红染色液。
四、实验方法与步骤压片法制备染色体标本:
(1) 取材:把蚕豆种子预先浸泡12h,然后转入垫有湿润滤纸的培养皿中上面蒙上湿纱布,置25℃温箱中暗培养发根,经过48h后幼根长至1—2cm左右,于上午9—11时剪下根尖。
(2) 预处理:将剪下的根尖置于对二氯苯饱和水溶液或0.1%秋水仙素溶液中,浸泡处理2-4 h。
(3) 固定:用水洗净处理过的根尖,经Carnoy固定液中固定2-4h,转入70%乙醇中,4℃保存备用。
(4) 解离:取出根尖,用蒸馏水洗净,放入l M HCl中60℃解离8-10min,再用蒸馏水洗净。
(5) 染色:改良苯酚品红 染色5—10min。
(6) 压片:把根尖放在载玻片上、切取分生区部分、加一滴45 %醋酸,盖上盖玻片,用力垂直猛压,盖玻片上放上一滤纸,用铅笔上的橡皮头轻轻敲打盖片,使细胞和染色体分散。
(7)镜检
 五、实验结果
五、实验结果
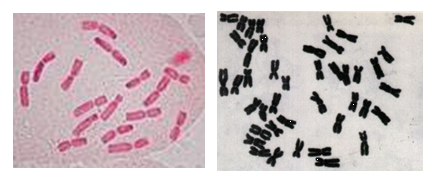
六、作业:绘制出中期染色体图。

-
染色体报告单样式
附件4染色体报告单样式长沙市产前诊断中心染色体检查报告单孕妇姓名年龄岁孕周周标本类型羊水脐血外周血标本编号产前诊断适应症1众数分析…
-
染色体 实验报告
染色体标本的制备及组型实验生命科学学院张瀛实验目的1掌握染色体标本的制作方法2认识不同生物染色体的特征学会做染色体组型图实验用品小…
-
小鼠骨髓染色体实验报告
生命与环境科学学院实验报告实验课名称遗传学实验实验名称小鼠骨髓细胞染色体的制备与观察成绩姓名王大锤实验报告系列年级学号组别时间温度
-
人类染色体组型分析 实验报告
20xx年6月10日姓名班级13级生命基地班学号同组者科目细胞生物学实验实验题目染色体组型分析实验题目染色体组型分析实验目的1掌握…
-
植物染色体制片与观察实验报告
植物染色体制片与观察实验报告洋葱组姓名蔡梦雅1230170010同组成员曹鉴云陈锦容刘艳马彦霞一中文摘要染色体Chromosome…
-
性染色体检查的类型
全国体检预约平台性染色体检查的类型染色体是我们遗传基因的重要载体如果性染色体出现异常的话那么孩子就可能出现一些遗传疾病所以为胎宝宝…
-
教你简单看懂羊水穿刺报告单
羊水穿刺虽然不是孕期必须检查的产检项目但是如果有些孕妈唐氏结果为高危或者高龄产妇等特殊的情况医生则会建议做羊水穿刺检查那羊水穿刺能…
-
三种常见的染色体检查结果
全国体检预约平台三种常见的染色体检查结果在我们生活体检当中经常会看到染色体检查项目而很多人则不知道染色体检查是做什么的染色体检查的…
-
染色体检查的常见结果有哪些
染色体检查的常见结果有哪些染色体检查是抽血取静脉血05ml接种于特定的培养基中6872小时后收获细胞经显带染色在镜下放大1000倍…
-
染色体标本的制备及组型观察 实验报告
细胞生物学实验报告染色体标本的制备及组型观察1实验目的掌握染色体标本制作的基本方法认识不同生物的染色体的状态学会做染色体组型图2实…
-
染色体工程项目可行性研究报告方案(可用于发改委立项及银行贷款+20xx详细案例范文)
染色体工程项目可行性研究报告方案可用于发改委立项及银行贷款20xx详细案例范文编制机构博思远略咨询公司360投资情报研究中心研究思…