蛋白酶k实验检测报告
重组蛋白酶K质量检测报告
实验检测报告一 :蛋白酶k消化荧光素酶
实验原理:荧光素酶在荧光素和ATP等物质存在的条件下可以发出荧光,当荧光素和ATP都过量时,发光强度与荧光素酶的活性有关,用绿邦产的ATP检测仪可测其发光度RLU,蛋白酶K消化荧光素酶后其活性降低,相应的RLU会降低,因此可以根据发光度比较蛋白酶K的活性。
实验目的:通过不同品牌的蛋白酶K消化荧光素酶,对两种蛋白酶K的活性做出比较。
实验方法:取10个1.5ml的离心管分为两组,一组为绿邦的重组蛋白酶K,另一组为Sigma公司的蛋白酶K,均加入400ul的荧光素酶,再分别向两组加入1㎎/ml的蛋白酶10ul,20 ul, 30 ul, 40 ul, 50 ul,置于室温15min后用ATP荧光检测仪测RLU,结果如下:

注:不加酶K 测该荧光素酶RLU为9999
做出折线图如下:

结果分析:荧光素酶在不加蛋白酶K的情况下,用ATP检测仪测得的RLU为9999,加入绿邦的酶K后为304,加入Sigma公司的酶K为1216,同样的体积同样的荧光素酶,在其他条件都相同的情况下,绿邦的酶K消化后的RLU下降值比Sigma的大,说明绿邦产的酶K活性较好。
实验检测报告二 :蛋白酶K消化酪蛋白
实验原理:
酪蛋白在A280与A650有紫外吸收峰,由分光光度计测吸光值可检测酪蛋白被酶消化的量,进而比较两种不同品牌蛋白酶K的活性。
实验方法:
⒈配制10㎎∕ml的酪蛋白溶液
⒉将绿邦公司的蛋白酶K和Sigma公司的蛋白酶K配成1.5㎎∕ml用于检检测实验:
⒊取十个1.5 ml的离心管分为两组,一组为绿邦的酶K(zk),一组为Sigma公司的酶K(sk),分别向离心管中加入以下试剂:
800ul酪蛋白+100ul K+250ul水
800ul酪蛋白+150ul K+200ul水
800ul酪蛋白+200ul K+150ul水
800ul酪蛋白+250ul K+100ul水
800ul酪蛋白+300ul K+50ul水
⒋室温条件下,吸混匀后的混合液稀释10倍测OD650,结果如下:

5.室温条件下,吸混匀后的混合液稀释10倍测OD280,结果如下:

通过A280与A650紫外吸收值的不同时间变化比较,发现绿邦的蛋白酶K的消化能力要稍微好于Sigma的蛋白酶K。
分析总结:通过两种实验方法,比较了绿邦蛋白酶K和Sigma的蛋白酶K的活性,发现绿邦的活性要高于Sigma的。
第二篇:实验四 蛋白酶活力的测定




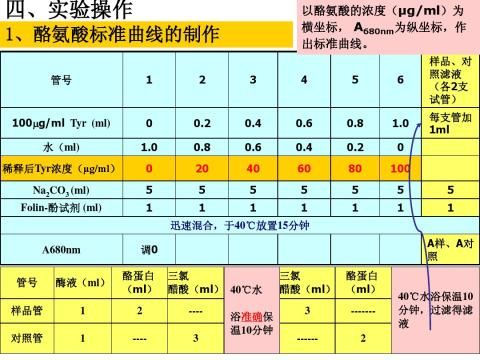
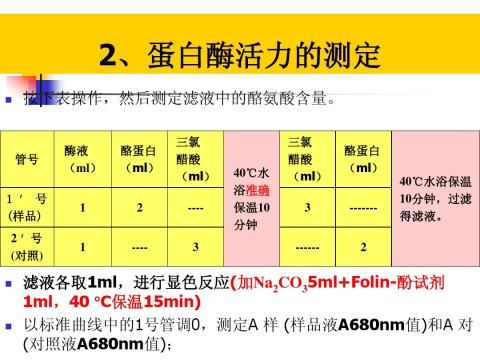



-
检验报告编制规定
检验报告编制规定XZTJZCA1006B11目的对本所检验检测原始记录检验检测报告证书的编制审核批准存档发放等作出规定以确保本所的…
-
检验报告范本
检验报告INSPECTIONCERTIFICATE石中20xx质检字第7577631号受检单位Applicant产品名称Sampi…
-
厂内机动车辆检验检测报告
附录1No检验报告编号厂内机动车辆监督检验报告注册代码使用单位车辆牌号检验机构公章检验日期国家质量监督检验检疫总局制注意事项1本报…
-
检测报告管理程序
检测报告管理程序编写人审核人批准人日期日期日期1目的对检测报告的内容格式编制修改签发存档等过程进行控制确保为客户提供准确可靠的检测…
- 安全和功能检验检测报告
-
信访工作总结
做好信访稳定工作,是化解基层矛盾促进连队经济社会协调发展的实际行动,是密切党群干群关系的有效途径,是构建和谐社会推动科学发展的现实…
-
县交通质监站半年工作总结
20xx年质监站上半年工作总结20xx年上半年,我站在县交通局的正确领导下,坚持以科学的发展观为指导,以交通工程建设质量和安全生产…
-
xx年设备物资部工作总结
20xx年设备物资部工作总结本年度是项目部大干快上的一年,施工重点从车站土建作业逐步转向盾构施工作业。设备物资部的现场工作重点,从…
-
学生会劳卫部工作总结
xx大学法学院团总支学生会劳卫部20xx-20xx学年度工作总结光阴似箭,转眼间,一个学期的工作又将接近尾声,在学院老师的统筹安排…
-
镇城乡统筹上半年工作总结
****镇城乡统筹20xx年上半年工作总结今年以来,在区委、区政府的正确领导下,在上级主管部门的悉心指导下,我们紧扣年初工作目标,…