检验报告编制规定
检验报告编制规定
XZTJ-ZC-A1/006 B/1
1. 目的:
对本所检验检测原始记录,检验检测报告(证书)的编制、审核、批准、存档、发放等作出规定,以确保本所的检验检测报告(证书)符合国家有关的法规、标准、技术规范的要求。
2. 使用范围
适用于本所的各类检验检测报告(证书)及相应的原始记录。
3. 职责
3.1 检验检测人员负责原始记录的编制,主检人员负责原始记录的校核及报告的一级审核。
3.2 接收人员负责原始记录的接收、登记,负责报告的流转、发放。
3.3 报告输录人员负责检验检测报告的输录、校对。
3.4 检验责任师负责检验检测报告的二级审核。
3.5 所长或授权的技术负责人负责报告的批准。
3.6 资料档案管理员负责检验报告的登记、签章、存档。
4.工作程序及要求
4.1 检验检测原始记录
4.1.1 检验检测原始记录应当由检验检测人员在检验检测时完成,应当及时将应察结果、数据和计算结果填入记录,不得事后追记。每张记录应能够按照特定的任务或项目分类识别。具体内容严格按照各类原始记录填写办法填写。
4.1.2 原始记录应有该记录人员的签名和记录的日期,填写好的原始记录应经主检人员校核。记录的更改采用划改方式,更改处应有更改人的签名及更改日期。
4.1.3 定期检验原始记录必须在检验(复检)工作完成后五个工作日内交回,监督检验原始记录必须在检验(复检)工作完成后三个工作日内交回。安全阀效验原始记录必须在效验工作完成后两个工作日内交回。
4.2 原始记录的接收
4.2.1接收人员接收原始记录时应检查记录是否有缺项,符合要求后填写“原始记录接收登记表”并经交接双方签字确认。
4.2.2 原始记录的编号由接收人员按“编号规则”统一编写。
4.3报告的输录
4.3.1 输录人员按原始记录信息输录报告,所输录的报告应由输录、接收人员校对,以确保与原始记录信息相一致。
4.3.2报告输录应在原始记录接收后24小时内完成。
4.4 报告流转
4.4.1报告的流转由原始记录接收人员统一进行,原始记录、报告及流转卡同时流转,监检报告流转时还应付相应的收费回执,相关人员在流转卡上签字并签署实际日期。
4.4.2 流转完成后,流转卡与报告、原始记录及相关技术资料一并存档。
4.5一级审核
一级审核由该项目的主检人员进行。审核时应重点核实报告与原始记录信息的符合性并做好记录,审核无误后在报告相应栏目及流转卡上签字确认。
4.6 二级审核
二级审核由检验责任师负责,审核时应着重核实报告与原始记录信息的符合性、符合判断的正确性,及相关人员的签字并做好记录,审核无误后在报告相应栏目及流转卡上签字确认。
4.7 批准
报告批准由所长或授权的技术负责人负责,批准应着重核实相关人员的签字并在批准栏及流转卡上签字确认。
4.8 登记加盖签章
资料档案管理员负责批准后的报告的登记工作,登记完成后在相应部位加盖检验专用印章并同时加盖齐缝章。
4.9 存档、发放
4.9.1 检验报告加盖印章后流转至原始记录接受岗,由接收人员负责发放。发放报告时,应填写“报告发放登记表”,领取人应在登记表上签名确认。
4.9.2 存档由资料档案管理员负责,存档时应将原始记录、报告、流转卡及相应的技术文件等按国家标准进行装订存档。
4.9.3 发放报告时。应填写“报告发放登记表”领取人应在登记表上签名确认。
5.相关记录
5.1 检验原始记录接收登记表。 XZTJ-ZC-A1/006-01
5.2 检验报告审核批准流转卡。 XZTJ-ZC-A1/006-02
5.3 报告发放登记表。 XZTJ-ZC-A1/006-03
附件一:检验工作流转图
( )检验原始记录接收登记表
XZTJ-ZC-A1/006-01 序号:

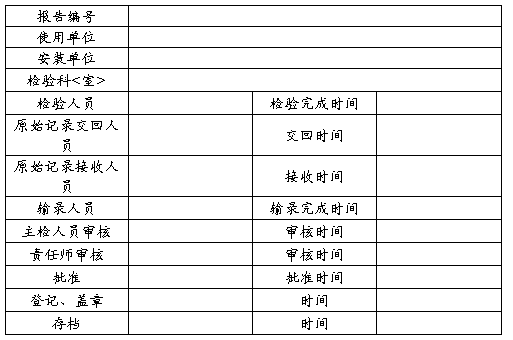
检验报告审核、批准流转卡
XZTJ-ZC-A1/006-02 序号:

报告发放登记表
XZTJ-ZC-A1/006-03

附件一:

↓

↓

↓

↓

↓

↓

↓

↓

│─────┐

A——业务室主任 B——分管所长 C——检验人员 D——接收人员
E——输录人员 F——主检检验人员 H——检验责任师
I——专业技术负责人 J——资料档案管理员 K——接收人员 L——资料档管理员
第二篇:化妆品检验报告的编制
化妆品检验报告的编制
一、 检验报告分为微生物检验报告、卫生化学检验报告、毒理学试验报告、人体安全性和功效评价检验报告四部分,每部分均应有检验结果。检验报告应加盖骑缝章。
二、 检验报告的样品受理编号为该样品的唯一编号,检验报告应包括封面、声明、检验结果三部分。
三、 样品名称应与《卫生部健康相关产品检验申请表》上填写的一致,原则上应包括商标名、通用名、属性名等。检验依据应写明标准、规范(含出版年号)等的名称与编号。
四、 检验报告中每部分检验项目的结果页应有签字、日期并加盖检验机构检验专用章,签字人为经认证/认可部门确认的检验机构授权签字人(即批准人)。
五、 封面日期应填写检验机构批准人的最终审核日期。
六、 检验机构存档的检验报告在每部分检验项目的结果下应有检验人、校核人、检验科(室)技术负责人和检验机构批准人的签字、日期并加盖检验专用章。
七、 检验报告空白处应有“以下空白”标记。
八、 检验报告顺序:微生物检验报告;卫生化学检验报告(其中包括pH值测定报告、抗UVA能力仪器测定报告);毒理学试验报告;人体安全性和功效评价检验报告。
九、 检验报告体例:检验机构可根据检验样品的实际情况及检验项目选择相应的报告体例。本报告体例应用于新类型产品时,检验报告所包含的项目和内容可能会有所变化。
十、 检验报告不得涂改增删,检验机构不得对已经出具的检验报告进行变更。
-
预算编制报告
四川开元工程项目管理咨询有限公司川开元咨字20xx022号万科金色海蓉二期总包工程预算审核报告成都一航万科滨江房地产开发有限公司我…
-
报告编制格式要求
报告编制格式要求1设计报告编制格式11格式要求111采用word编辑A4幅面页边距上下左右均为25厘米行间距采用15倍112层次划…
-
报告编制规则
石油天然气勘探开发地质成果报告编制规则1范围本规则规定了石油天然气勘探开发地质成果报告的形式构成层次描述编写的格式及印制要求本规则…
-
请求编制报告
汉开社字20xx号汉中经济开发区社会发展局关于进一步解决我区中小学幼儿园教师缺员缺编的紧急报告开发区管委会百年大计教育为本教育大计…
-
关于要求增加编制的报告
关于要求增加编制的报告县编委温宿县国有资产管理中心是县财政局下属事业单位核定编制10名现有工作人员4名5月20日温宿县20xx年人…
-
检测检验所述职报告
述职报告质量技术监督检测检验所所长:宋斌各位领导、同志们:在局党组和分管局长的正确领导下,在本所同志的共同努力下,在各科室协助下,…
-
检验科检验报告格式检查总结
检验科检验报告格式检查总结医务科在董福生院长的带领下对我院检验科检验报告格式进行了检查总结如下一检查内容1检验报告单格式规范统一有…
-
检验报告填写规则20xx0623-1
检验报告、记录填写规则(承压类)1总则1.1为了进一步统一各类检验报告、证书、记录的填写格式,使各类检验报告、记录更加规范、标准。…
-
检测报告管理程序
检测报告管理程序编写人审核人批准人日期日期日期1目的对检测报告的内容格式编制修改签发存档等过程进行控制确保为客户提供准确可靠的检测…
-
检验报告范本
检验报告INSPECTIONCERTIFICATE石中20xx质检字第7577631号受检单位Applicant产品名称Sampi…
-
产品质量检测报告(样板)
介休市昌盛煤气化有限公司产品粗苯检测报告检验部门化验室报告日期年月日介休市昌盛煤气化有限公司产品粗苯检测报告检验部门化验室报告日期…