无卤素测试
学周期表中的第 ⅶa 族元素包括氟( f )、氯 (cl) 、溴( br )、碘( i )、砹( at ),合称卤素。其中砹( at )为放射性元素,在产品中几乎不存在,前四种元素在产品@别是在聚合物材料中以有机化合物形式存在。目前应用于产品中的卤素化合物主要为阻燃剂: pbb , pbde , tbbp-a , pcb ,六溴十二烷,三溴苯酚,短链氯化石蜡;用于做冷冻剂、隔热材料的臭氧破坏物质: cfcs 、 hcfcs 、 hfcs 等。
危害:
在塑料等聚合物产品中添加卤素(氟,氯,溴,碘)用以提高燃点,其优点是:燃点比普通聚合物材料高,燃点大约在 300℃ 。燃烧时,会散发出卤化气体(氟,氯,溴,碘),迅速吸收氧气,从而使火熄灭。但其缺点是释放出的氯气浓度高时,引起的能见度下降会导致无法识别逃生路径,同时氯气具有很强的毒性,影响人的呼吸系统,此外,含卤聚合物燃烧释放出的卤素气在与水蒸汽结合时,会生成腐蚀性有害气体(卤化氢),对一些设备及建筑物造成腐蚀。
pbb , pbde , tbbpa 等溴化阻燃剂是目前使用较多的阻燃剂,主要应用在电子电器行业,包括:电路板、电脑、燃料电池、电视机和打印机等等。这些含卤阻燃剂材料在燃烧时产生二恶英,且在环境中能存在多年,甚至终身累积于生物体,无法排出。
cfcs 会遇到主要由臭氧层吸收的有害紫外线。紫外线使 cfcs 分解,释放出氯原子,将臭氧分子分离成为游离的氧分子和一氧化二氯分子,从而破坏了臭氧分子。一个氯原子就可以破坏 100 , 000 个以上的臭氧分子。臭氧层被破坏,将大大提高患皮肤癌、白内障和其它眼睛疾病的机率,会带来灾难性的后果。另外它可能还会造成粮食灾害,水生生物的减产,并形成 “ 温室效应 ” (地球大气变暖)。因此,不少国际大公司在积极推动完全废止含卤素材料,如禁止在产品中使用卤素阻燃剂等。
目前对于无卤化的要求,不同的产品有不同的限量标准:如无卤化电线电缆其中卤素指标为:所有卤素的值≦50ppm( 根据法规 pren 14582) ; 燃烧后产生卤化氢气体的含量< 100ppm( 根据法规 en 5067-2-1 ) ;燃烧后产生的卤化氢气体溶于水后的 ph 值 ≧4.3( 弱酸性 ) ( 根据法规 en-5 0267-2-2 ) ;产品在密闭容器中燃烧后透过一束光线其透光率 ≧60%( 根据法规 en-50268-2) 。无卤化 pcb ,溴、氯含量分别小于 900ppm ,(溴+氯)小于 1500ppm。 /blog/static/1227962932xxxxxxxxxxxx97/" target="_blank" rel="nofollow">/sidenis/blog/static/1227962932xxxxxxxxxxxx97/ 公司简介: 东莞北南科技有限公司(原北南电磁技术有限公司)成立于20xx年,是经中国合格评定国家实验室认可委和国际认可的第三方独立检测及认证的大型综合实验室。在广东省东莞市建有专业的安规实验室,EMC实验室,有毒有害物质方面的化学检测实验室,专业从事国际环保标准方面的对策及检测认证服务。另本公司已同 SGS,UL,TUV,ITS,CNAL 等权威认证机构建立了良好的合作关系。为您提供价格优惠,数据准确、周期快速的测试服务和检测报告证书,全面配合解决您在测试中的疑问和难题。
权威认可:北南科技已取得中国合格评定国家认可委员会( CNAS)和ISO/IEC17025:2005实验室认可证书,具备向社会出具公证数据的资格。北南科技实验室硬件完全依照 CNAS 国家认可实验室要求建设,并依据 ISO/IEC 17025:2005 进行管理。其检测报告被欧盟,美国,日本,香港几十个国家和地区承认。目前已取得部分国际国内知名品牌认可和合作:如索尼.松下,中山美的电器,三星电子,东莞伟意达,富士康,步步高,珠海格力,光宝集团,创科集团,泰科电子等!
●NS化学检测项目综合范围:
RoHS六项测试、 Toys 玩具元素迁移、 PAHs多环芳香烃、 TBBP-A 四溴双酚、
Phthalates邻苯二甲酸、 NP 壬基苯酚、 Halogen(F,Cl,Br,I)卤素氟,氯,溴,碘、
REACH&SVHC15项高度关注物质、 AZO Compounds 偶氮化合物、 Formaldehyde 甲醛、 FDA
PCBs 多氯联苯、 、 CP氯代烷烃、 O-Tin有机锡化合物、 Ni镍、
HBCDD六溴环十二烷、 94/62/EC包装材料、 PFOS/PFOA 、 HR4040(CPSIA) 。 ●NS检测地域范围:
检测客户遍布:广东省,福建省,江西省,湖南湖北省,江苏省,浙江省,河北省,陕西省,山东省,辽宁省,黑龙江省,广西省,
华南地区:东莞,中山,珠海,佛山,中山,江门,惠州,深圳,广州,汕头, 华东地区:宁波,温州,金华,泉州,昆山,苏州,厦门,上海,杭州,义乌,无锡,绍兴,嘉兴, 华中地区:南昌,九江,武汉,长沙,合肥
华北地区:北京,天津,青岛,潍坊,淄博,廊坊,郑州,内蒙古,石家庄,太原, 西北地区:西安,太原,兰州,青海,
东北地区:沈阳,大连,哈尔滨,长春
西南地区:桂林,柳州,成都,南宁,贵阳,昆明
●测试产品范围包括:影音产品、IT产品、家电产品、通信产品、灯具、无线产品、电子玩具、适配器、车用电子产品、激光产品、UPS等电子产品.纺织皮革品,塑胶五金玩具化工等等。
如有任何测试方面的问题欢迎134xxxxxxxx致电单生助企业通过联盟!
第二篇:卤素测试
第四章卤素测试卷及答案
试卷说明:本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,请将第Ⅰ卷各小题的答案选出后填涂在答题卡上,第Ⅱ卷各题答在试卷的相应位置上,满分110分,答题时间100分钟。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 F-19 Na-24 Mg-24 S-32 Cl-35.5 Ca-40 Fe-56 Br-80 Ag-108 I-127
第Ⅰ卷(选择题,共48分)
一、选择题(本题包括16个小题,每小题只有一个选项符合题意,每小题3分,共48分)。
1.化学反应常伴随着颜色变化,下列有关反应获得的颜色不正确的是 ( )
A.蛋白质遇浓硝酸——黄色
B.溴化银见光分解——白色
C.淀粉溶液遇到单质碘——蓝色
D.氢气在氯气中燃烧时的火焰——苍白色
【解析】 溴化银见光分解,有黑色物质生成,B错。
【答案】 B
2.在淀粉-碘化钾溶液中加入少量KClO溶液,一段时间后,溶液逐渐变蓝,在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失。下列判断错误的是 ( )
-2-A.氧化性:ClO>I2>SO4
B.漂白粉溶液可使淀粉-碘化钾试纸变蓝
C.向溴水中加入Na2SO3溶液,溴水褪色
D.在水溶液中,NaClO可以与Na2SO3共存
-【解析】 溶液变蓝,说明KI中I被KClO氧化成单质I2,再加入Na2SO3溶液,蓝色
-消失,说明碘被Na2SO3还原为I,则KClO氧化性强于单质碘,单质碘氧化性强于稀硫酸,
A项正确;漂白粉中含有次氯酸钙,有强氧化性,能将碘化钾氧化为单质碘,B项正确;单质溴的氧化性强于单质碘,向溴水中加入Na2SO3溶液,溴被还原为HBr,溴水褪色;NaClO能将Na2SO3氧化,故二者不能大量共存,D项不正确。
【答案】 D
3.在氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质。下列实验现象和结论一致且正确的是 ( )
A.加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在
B.溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在
-C.先加入盐酸酸化,再加入AgNO3溶液产生白色沉淀,说明有Cl存在
D.加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
【解析】 氯水使有色布条褪色是因为其中含有HClO具有强氧化性;由于加入盐酸酸
-化的过程中引入Cl,所以无法说明氯水中是否存在氯离子;又氯气、HCl、HClO均能与NaOH
溶液反应,所以加入NaOH溶液时颜色消失不能说明其中含有HClO。
【答案】 B
4.某卤素X2与热的浓NaOH溶液反应,生成A、B两种盐,往A盐的浓溶液中加入一定量的另一种卤素Y2的水溶液又可生成X2,且X2不能使淀粉溶液变蓝,则X2、Y2可能是
( )
A.Cl2、I2 B.Br2、Cl2 C.Cl2、Br2 D.I2、Cl2
【解析】 X2与热的NaOH溶液反应,生成两种盐,X2一定不是F2,A盐能与Y2反应生成X2,则氧化性Y2>X2,X2又不是I2,那只能是Br2,Y2只能是Cl2。
【答案】 B
+-5.HClO4·H2O的结构为H3OClO4,下列叙述最符合这种结构的证据是 ( )
A.是极强酸 B.有强氧化性
C.遇热分解 D.有4个相同的键
+--【解析】 若HClO4·H2O的结构为H3OClO4,则ClO4中4个Cl—O键完全相同,故D
+对(可与NH4进行类比)。
【答案】 D
6.下列关于卤素的叙述正确的是 ( ) ①卤素的钾盐中,最容易被氧化的是氟化钾;
②溴中溶有少量氯气,可以采取加入溴化钠溶液再用汽油萃取的方法提纯
③溴化银具有感光性,碘化银不具有感光性;
④某溶液与淀粉-碘化钾溶液反应出现蓝色,则证明该溶液是氯水或溴水;
⑤氟气跟氯化钠水溶液反应,一定有HF和O2生成;
⑥氯气跟水反应时,水既不是氧化剂也不是还原剂。
A.①③⑤ B.②⑤⑥ C.②④⑥ D.①③④
-【解析】 在卤素单质中,F2的氧化性最强,对应的F的还原性最弱,①不正确;Cl2
+2NaBr===2NaCl+Br2,Br2易溶于汽油不易溶于水,②正确;AgCl、AgBr、AgI都具有感
-光性,③不正确;使淀粉变蓝色是因为有I2生成,凡可氧化I成I2的氧化剂皆有此现象,④
不正确;显然⑤正确;由Cl2+H2O===HCl+HClO知反应前后H、O元素价态不变,⑥正确。
【答案】 B
+++---2-7.在一含Na的澄清溶液中,可能还存在NH4、Fe2、I、Br、CO23、SO3六种离子
中的几种。①在原溶液中滴加足量的饱和氯水后,有气泡生成,溶液呈橙黄色;②向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成;③橙黄色溶液不能使淀粉溶液变蓝色。根据上述实验事实推断,下列说法不正确的是 ( )
-2-A.溶液中一定存在Br、CO3
+B.溶液中可能存在NH4
+--C.溶液中一定不存在Fe2、I、SO23
D.溶液一定呈碱性
【解析】 饱和氯水中存在着许多种粒子,具有多重性质,在原溶液中加入足量氯水后
-2-2-有气泡产生,再加入BaCl2溶液无沉淀生成,说明一定有CO23,一定没有SO3(若有SO3,
-2+加入过量氯水会有SO24生成),则一定没有Fe,溶液呈橙黄色,不能使溶液变蓝色,说明
--+-+一定有Br,一定不存在I;NH4可能有。CO23水解呈碱性,NH4水解呈酸性,所以溶液不
一定呈碱性。
【答案】 D
8.浓盐酸和次氯酸钙能发生下列反应:Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O,用贮存很久的漂白粉与浓盐酸反应制得的氯气中,可能含有的杂质气体是 ( )
①HCl ②O2 ③CO2 ④H2O(气)
A.①②③ B.②③④ C.①③④ D.②③
【解析】 贮存很久的漂白粉会部分变质:Ca(ClO)2+H2O+CO2===CaCO3↓+2HClO,当和浓盐酸作用时:CaCO3+2HCl===CaCl2+H2O+CO2↑。
【答案】 C
9.19世纪中叶时,德国著名化学家李比希曾误将溴认为是氯化碘(ICl)。事实上都是深红棕色液体的氯化碘与溴也极为相似,下列有关它们结构与性质的比较中,不正确的是( )
A.它们的固体都属于分子晶体
B.它们熔、沸点相近
C.等物质的量的ICl和Br2可氧化等量的SO2
D.它们与水的反应,均为自身氧化还原反应
【解析】 ICl与水反应的化学方程式为ICl+H2O===HIO+HCl,是非氧化还原反应。
【答案】 D
10.由于碘是卤素中原子半径较大的元素,可能呈现金属性。下列事实能够说明这个结论的是 ( )
A.已经制得了IBr、ICl等卤素互化物
B.已经制得了I2O5等碘的氧化物
+C.已经制得了I(NO3)3、I(ClO4)3·2H2O等含I3的化合物
-D.碘(I2)易溶于KI等碘化物溶液,形成I3
【解析】 解答本题时,应抓住“可能呈现金属性”这一信息,选项C中的I(NO3)3、I(ClO4)3·2H2O等化合物中,碘都呈正价,体现了金属性。
【答案】 C
11.下列实验过程中,不会产生气体的是 ( )
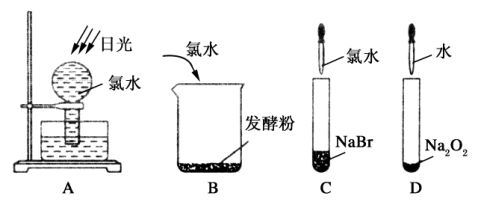
【解析】 A项,氯水经光照会放出氧气;B项,氯水与发酵粉反应有二氧化碳气体产生;C项,氯水与NaBr反应:Cl2+2NaBr===2NaCl+Br2,而Br2在常温下是液体;D项,过氧化钠与水反应产生氧气。故选C。
【答案】 C
--12.测定固体样品中Br的质量分数,可用0.2mol·L1AgNO3溶液,当样品的质量为某
-数据时,消耗的硝酸银溶液为VmL,V恰好等于样品中Br的质量分数的100倍,则该样品
的质量为 ( )
A.0.8g B.1.6g C.3.2g D.6.4g
-+-【解析】 设样品的质量为m,样品中Br的质量分数为x,由Ag+Br===AgBr↓知
mx+----n(Ag)=n(Br),即0.2mol·L1×100xmL×103L·mL1=-m=1.6g。 80g·mol【答案】 B
-----13.甲、乙、丙三种溶液中各含有一种X(X为Cl、Br或I),向甲加入淀粉和氯水,
则溶液变为橙色,再加丙溶液,颜色无明显变化。则甲、乙、丙分别是 ( )
------A.Br、Cl、I B.Br、I、Cl
------C.I、Br、Cl D.Cl、I、Br
---【解析】 ①卤素单质的氧化性为Cl2>Br2>I2,对应阴离子的还原性为I>Br>Cl。②
碘单质可使淀粉溶液变蓝;溴水颜色为橙色。甲中加入氯水和淀粉溶液后溶液变为橙色,说
--明甲中含有Br;再加入丙溶液无明显变化,则说明丙中无I。
【答案】 B
14.某学生鉴定甲盐的实验过程如图所示:
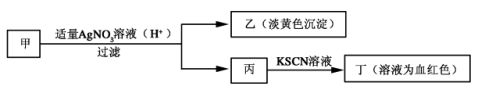
下列结论正确的是 ( )
+A.甲中一定有Fe3
+B.丙中一定有Fe3
C.乙为AgI沉淀
D.甲一定为FeBr2溶液
-【解析】 加入酸性硝酸银溶液,NO3具有强氧化性,能氧化亚铁离子,故甲的溶质可
能是溴化亚铁或溴化铁。碘化银呈黄色。
【答案】 B
15.把含有某一种氯化物杂质的MgCl2粉末47.5mg溶于水后,与足量的AgNO3溶液反应,生成AgCl沉淀150mg,则该MgCl2中的杂质可能是 ( )
A.AlCl3 B.NaCl C.KCl D.CaCl2
【解析】 47.5mg MgCl2,生成AgCl 143.5mg,小于150mg,含有1mol氯元素的氯化物中,各金属元素的质量分别为:铝为9g,钠为23g,钾为39g,钙为20g,镁为12g,含氯量高于MgCl2的只有AlCl3,A正确。
【答案】 A
16.某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,
--经测定ClO与ClO3的浓度之比为1∶3,则Cl2与NaOH溶液反应时,被还原的氯原子与被
氧化的氯原子的物质的量之比为 ( )
A.21∶5 B.11∶3 C.3∶1 D.4∶1
【解析】 假设反应中生成1mol NaClO和3mol NaClO3,则有1mol+3mol×5=16mol电子发生转移。由电子守恒知,必有16mol氯原子被还原。
【答案】 D
第Ⅱ卷(非选择题,共62分)
二、填空题(本题包括4个小题,共36分)
---17.(6分)已知氧化性ClO3>BrO3>Cl2>IO3>I2。现将饱和氯水逐滴滴入KI-淀粉溶液中
至过量。
(1)可观察到的现象是:_______________________________________________________。
(2)写出有关的离子方程式:
________________________________________________________________________、 ________________________________________________________________________。
-【解析】 由题意知,KI-淀粉溶液中滴加氯水,I被氧化为I2,溶液变为蓝色,由于
--Cl2的氧化性比IO3强,当Cl2过量后,又将I2氧化为IO3而使蓝色消失。
【答案】 (1)溶液先变蓝色后褪色
--(2)2I+Cl2===2Cl+I2
+--I2+5Cl2+6H2O===12H+2IO3+10Cl
18.(10分)氰(CN)2、硫氰(SCN)2的化学性质和卤素相似,化学上称为“拟卤素”。它们
-----阴离子的还原性强弱顺序为Cl<Br<CN<SCN<I。
(1)(CN)2与KOH的溶液反应的化学方程式为______________________。
(2)KBr和KSCN的混合溶液加入(CN)2反应的离子方程式为______________________。
(3)硫氰酸(化学式为HSCN)有两种同分异构体。目前游离酸中的这两种互变异构体尚无法分离,硫氰酸易溶于水,其水溶液有强酸性。已知:硫氰酸中的碳、氮、硫原子在一条直线上,H、S、C、N的化合价分别为+1、-2、+4、-3。则硫氰酸的可能的结构式为________或________。
(4)硫氰酸可由硫氰化钾与硫酸氢钾在一定条件下加热制得,这一事实说明硫氰酸______________________。
【解析】 (1)中反应类似于Cl2和NaOH反应,易得答案。(2)中根据题中阴离子还原性
-的强弱可知在KBr和KSCN的混合溶液中加入(CN)2后,(CN)2只能氧化SCN生成(SCN)2。
(3)可根据价键关系写出两种同分异构体。(4)中反应的化学方程式KSCN+KHSO4=====K2SO4+HSCN↑,可知HSCN是一种易挥发性酸,加热使得HSCN脱离反应体系,有利于反应的进行。
-【答案】 (1)(CN)2+2KOH===KCNO+KCN+H2O (2)2SCN+(CN)2===(SCN)2+2CN
- (3)HSCN SCNH (4)是一种低沸点酸
19.(10分)上海某造纸厂曾发生一起环境污染事故,当场有16人被送入医院抢救。事故原因是:该厂有两只贮槽,一只存放NaClO溶液,一只存放Al2(SO4)3溶液。某日送来一车Al2(SO4)3溶液,装卸工误将卸管塞进NaClO贮槽,瞬间发生化学反应,造成大量Cl2外泄。
(1)试用离子方程式分析造成Cl2外泄的原因:______________________。
(2)厂方在抢救中除了关闸、停机器外,你认为还可以用________试剂来减少Cl2的外泄量。写出离子方程式______________________。
【解析】 (1)硫酸铝溶液水解呈酸性:Al3+3H2OAl(OH)3+3H,当与次氯酸钠溶++
液混合时发生反应:H+ClOHClO,而次氯酸易分解:2HClO=====2H+2Cl+O2↑,
-+-产生的Cl与HClO发生反应:HClO+H+ClCl2↑+H2O,造成氯气外泄。
--(2)由于氯气易与碱溶液反应,故可用氢氧化钠来减少氯气的外泄量:Cl2+2OH===Cl
-+ClO+H2O。
【答案】 (1)Al3+3H2OAl(OH)H+ClOHClO,2HClO=====2H+2Cl3+3H,
-+-+O2↑,HClO+H+ClCl2↑+H2O
---(2)NaOH Cl2+2OH===Cl+ClO+H2O
20.(10分)

(1)推断华素片________(填“是”或“不是”)白色。
(2)某同学欲证实该药片中确定含有分子碘,设计并完成如下实验:
①将药片研碎、溶解、过滤,所得滤液分装于甲、乙两支试管中备用。
②在甲试管中加入下列一种试剂,振荡、静置,观察到液体分层,上层液体颜色为________色,所加试剂为下列中的________,由此说明分子碘的存在。
A.苯 B.酒精
C.四氯化碳 D.盐酸
③在乙试管中滴加________溶液,溶液变蓝色,也说明了分子碘的存在。
-(3)碘在地壳中主要以NaIO3的形式存在,在海水中主要以I的形式存在,几种粒子之间
有如下转化关系: +++-++-光+-光
①如以海水为原料制取I2,加入的Cl2要适量,如过量就会发生途径Ⅲ的副反应,在该
--反应产物中,IO3与Cl的物质的量之比为1∶6,则氧化剂和还原剂的物质的量之比为
________。
②如以途径Ⅱ在溶液中制取I2,反应后的溶液显酸性,则反应离子方程式是______________________。
【解析】 (1)碘单质是紫黑色固体。(2)I2难溶于水,易溶于苯或四氯化碳,苯的密度比
---+水小,四氯化碳的密度比水大。(3)①3Cl2+I+3H2O===6Cl+IO3+6H;②注意离子方程
-式中HSO3不可拆分。
【答案】 (1)不是
(2)②紫红(或浅紫) A(或C) ③淀粉
(3)①3∶1
---+②2IO3+5HSO3===5SO24+H2O+3H+I2
三、实验题(本题包括1小题,共12分)
21.(12分)下图是实验室制取Cl2并以Cl2为原料进行特定反应的实验:
(1)A为氯气发生装置,写出反应的化学方程式:
________________________________________________________________________
________________________________________________________________________。
(2)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C瓶后进入D。D装置内盛有碳粉,发生氧化还原反应,生成CO2和HCl(g)。试写出D装置中反应的化学方程式______________________;装置C的作用是______________________。
(3)E处石蕊试液的现象是______________________,其原因是______________________,干燥管a的作用是______________________。
(4)若将E处溶液改为石灰水,反应过程的现象是______________________。
A.有白色沉淀生成
B.无白色沉淀生成
C.先生成白色沉淀,然后沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是______________________,B的作用是______________________。
【解析】 根据题示信息,D中发生的反应为:2Cl2+C+2H2O=====4HCl+CO2,水为反应物,推知装置C的作用是提供水蒸气,又因为该反应生成HCl,为防止倒吸发生可采用干燥管a连接在E处。
【答案】 (1)MnO2+4HCl(浓)=====MnCl2+Cl2↑+2H2O
(2)2Cl2+2H2O+C=====CO2+4HCl 提供D处所需要的水蒸气
(3)石蕊试液先变红、后变无色 生成HCl使石蕊试液变红,未反应完的Cl2与H2O作用生成HClO,HClO的漂白作用使红色消失 防止E中溶液倒吸至装置D中
(4)B
(5)瓶中液面下降,长颈漏斗内液面上升 贮存少量Cl2,避免Cl2污染环境
四、推断题(本题包括1小题,共7分)
22.(7分)A、B、C、D、E、F为中学常见的六种物质,C、D为有色单质,其余化合物的焰色反应均为黄色,其中A、E的溶液呈中性,B、F的溶液呈碱性,且B的溶液可使有色布条褪色,它们之间的转化关系如图所示(下述反应均在溶液中进行)。

(1)写出A、B和C的化学式:A________,B________、C________。
(2)写出反应①的化学方程式________________________________________________。
(3)写出反应③的离子方程式______________________________________________。
【解析】 本题推断的突破口较明显,黄绿色气体C为Cl2,D可使淀粉溶液呈蓝色则是碘单质,结合题中的焰色反应及框图关系,与所学的卤素间的置换反应及与碱液的反应不难完成本题。
【答案】 (1)NaI NaClO Cl2
(2)2NaI+NaClO+H2O===I2+NaCl+2NaOH
---(3)Cl2+2OH===Cl+ClO+H2O
五、计算题(本题包括1小题,共7分)
23.(7分)为了预防碘缺乏病,国家规定每千克食盐中应含有40~50mg的碘酸钾。为检验某种食盐是否为加碘的合格食盐,某同学取食盐样品428g,设法溶解出其中全部碘酸钾,
-将溶液酸化并加入足量的KI—淀粉溶液,溶液呈蓝色,再用0.030mol·L1的硫代硫酸钠溶液
滴定,用去18.00mL时蓝色刚好褪去。试通过计算说明该加碘食盐是否为合格产品。有关反应如下:
--+IO3+5I+6H===3I2+3H2O
2I2+2S2O23===2I+S4O6
--2-【解析】 I2+2S2O23===2I+S4O6
--n(I2)=0.30mol·L1×0.018L×1/2=2.7×104mol。
--+IO3+5I+6H===3I2+3H2O
--n(KIO3)=2.7×104mol×1/3=9.0×105mol。
--214g·mol1×9.0×105mol-每千克食盐中含KIO3:1000mg·g1=45mg/kg 0.428kg
所以该加碘食盐是合格的。
【答案】 合格
---
-
无卤素测试
学周期表中的第a族元素包括氟f氯cl溴br碘i砹at合称卤素其中砹at为放射性元素在产品中几乎不存在前四种元素在产品别是在聚合物材…
-
高一化学卤素测试题含答案
卤素知识梳理一卤族元素的原子结构与自然界的存在氯元素位于周期表周期族在自然界中的主要存在形态溴碘二活泼的氯气1氯气的物理性质色有气…
-
高一化学卤素测试题
卤素知识梳理一卤族元素的原子结构与自然界的存在氯元素位于周期表周期族在自然界中的主要存在形态溴碘二活泼的氯气1氯气的物理性质色有气…
-
英国卤素测试方法
英国卤素测试方法简介硫和卤素氟氯溴碘在材料中以各种形态存在在燃烧这些材料的过程中会释放出有刺激性且有害的气体化合物通过氧气燃烧测定…
- 高温扭力测试报告
-
TQC-R033 B0 样品测试报告
样品测试报告注1此样品测试报告一式三份原件由文控保管复印件一份交IQC归档另一份复印件交采购部并通知供应商2如工程或研发确认样品合…
-
高一化学卤素测试题
卤素知识梳理一卤族元素的原子结构与自然界的存在氯元素位于周期表周期族在自然界中的主要存在形态溴碘二活泼的氯气1氯气的物理性质色有气…
-
高一化学卤素测试题含答案
卤素知识梳理一卤族元素的原子结构与自然界的存在氯元素位于周期表周期族在自然界中的主要存在形态溴碘二活泼的氯气1氯气的物理性质色有气…
-
SGS测试报告整合
ROHS整合认证流程如果您是整机厂或是成品厂您的所有部件的原材料都有相应的ROHS检测报告您可以按整合报告服务申请流程来申请产品整…
-
英国卤素测试方法
英国卤素测试方法简介硫和卤素氟氯溴碘在材料中以各种形态存在在燃烧这些材料的过程中会释放出有刺激性且有害的气体化合物通过氧气燃烧测定…
-
无卤素
11何为无卤基材按照JPCAES0120xx标准氯C1溴Br含量分别小于009Wt重量比的覆铜板定义为无卤型覆铜板同时CIBr总量…