实验七 正溴丁烷的制备
实验十 正溴丁烷的制备
【实验目的】
1.了解以正丁醇、溴化钠和浓硫酸为原料制备正溴丁烷的基本原理和方法。
2.掌握带有害气体吸收装置的加热回流操作。
3.进一步熟悉巩固洗涤、干燥和蒸馏操作。
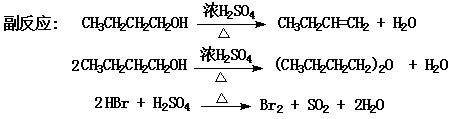
【实验原理】

【实验的准备】
仪 器:圆底烧瓶(50 ml、100 ml 各1个);冷凝管(直形、球形各1支);温度计套管(1个);短径漏斗(1个);烧杯(800 ml 1个);蒸馏头(1个);接引管(1个);水银温度计(150℃ 1支);锥形瓶(2个);分液漏斗(1个)。
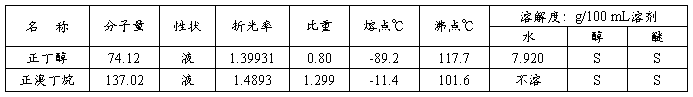
药 品: 正丁醇 5 g 6.2 ml (0.068 mol);
溴化钠(无水) 8.3 g (0.08 mol);
浓硫酸(d=1.84) 10 ml (0.18 mol);
10 % 碳酸钠溶液、 无水氯化钙。
【物理常数】

【仪器安装要点】
1.按教材p28图1.15-(3)安装仪器。
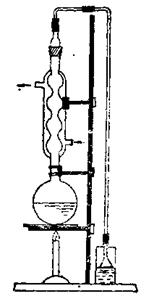
2.有害气体吸收装置的漏斗要靠近水面,但不能浸入水中,以免水倒吸。
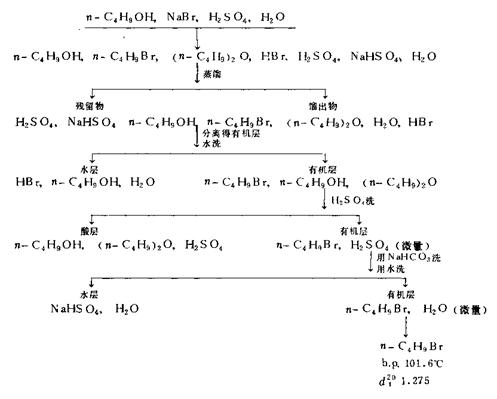
纯化过程:
【操作要点】
1.加料:
(1)溴化钠不要粘附在液面以上的烧瓶壁上。
(2)从冷凝管上口加入已充分稀释、冷却的硫酸时,每加一次都要充分振荡,混合均匀。否则,因放出大量的热而使反应物氧化,颜色变深。
2.加热回流:
开始加热不要过猛,否则回流时反应液的颜色很快变成橙色或橙红色。应小火加热至沸,并始终保持微沸状态。
反应时间约30 min 左右,反应时间太短,反应液中残留的正丁醇较多(即反应不完全);但反应时间过长,也不会因时间增长而增加产率。
本实验在操作正常的情况下,反应液中油层呈淡黄色,冷凝管顶端亦无溴化氢逸出。
3.粗蒸馏终点的判断:
(1)看蒸馏烧瓶中正溴丁烷层(即油层)是否完全消失,若完全消失,说明蒸馏已达终点。
(2)看冷凝管的管壁是否透明,若透明则表明蒸馏已达终点。
(3)用盛有清水的试管检查馏出液,看是否有油珠下沉,若没有,表明蒸馏已达终点。
4.用浓硫酸洗涤粗产物时,一定先将油层与水层彻底分开,否则浓硫酸会被稀释而降低洗涤效果。
【本实验的成败关键】
反应终点和粗蒸馏终点的判断。
【本实验的问题】
1、什么时候用气体吸收装置?如何选择吸收剂?
答:反应中生成的有毒和刺激性气体(如卤化氢、二氧化硫)或反应时通入反应体系而没有完全转化的有毒气体(如氯气),进入空气中会污染环境,此时要用气体吸收装置吸收有害气体。选择吸收剂要根据被吸收气体的物理、化学性质来决定。可以用物理吸收剂,如用水吸收卤化氢;也可以用化学吸收剂,如用氢氧化钠溶液吸收氯和其它酸性气体。
2、在正溴丁烷的合成实验中,蒸馏出的馏出液中正溴丁烷通常应在下层,但有时可能出现在上层,为什么?若遇此现象如何处理?
答:若未反应的正丁醇较多,或因蒸镏过久而蒸出一些氢溴酸恒沸液,则液层的相对密度发生变化,正溴丁烷就可能悬浮或变为上层。遇此现象可加清水稀释,使油层(正溴丁烷)下沉。
3、粗产品正溴丁烷经水洗后油层呈红棕色是什么原因?应如何处理?
答:油层若呈红棕色,说明含有游离的溴。可用少量亚硫酸氢钠水溶液洗涤以除去游离溴。
反应方程式为:
Br 2 + NaHSO3 + H2O → 2HBr + NaHSO4
第二篇:8实验七 正溴丁烷的制备
实验七正溴丁烷的制备
Experiment 7 Preparation of n-bromobutane
计划学时:6学时
[实验目的]
1、学习以溴化钠、浓硫酸和正丁醇反应制备正溴丁烷的原理与方法。
2、掌握回流反应及气体吸收装置的安装和使用。
[实验重点] 卤代烃的制备方法
[实验难点] 正溴丁烷粗产物的提纯:即分步多次洗涤和简单蒸馏。
[教学内容]
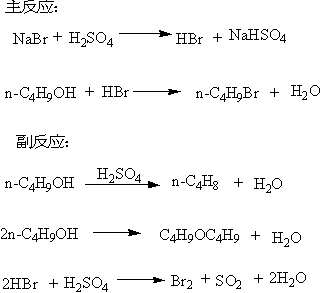
一、实验原理
卤代烷制备中的一个重要方法是由醇和氢卤酸发生亲核取代(nucleophilic substitution reaction)来制备。反应一般在酸性介质中进行。实验室制备正溴丁烷是用正丁醇与氢溴酸反应制备,由于氢溴酸是一种极易挥发的无机酸,因此在制备时采用溴化钠与硫酸作用产生氢溴酸直接参与反应。在该反应过程中,常常伴随消除反应和重排反应的发生。
该反应方程式为:(插入讲解反应机理)
二、实验仪器及药品
仪器:100 mL 的圆底烧瓶、球形冷凝管、长颈玻璃漏斗、烧杯等
所需药品:7.4 g(9.2 mL,0.10 mol)正丁醇 (M = 74.12),13 g(约0.13 mol)无水溴化钠(M = 102.89),浓硫酸,饱和碳酸氢钠溶液,无水氯化钙
三、实验步骤
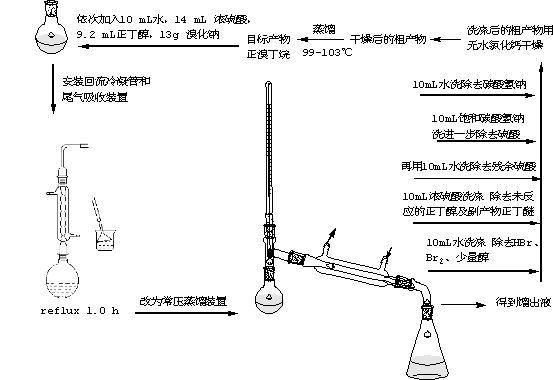
1、投料
在圆底烧瓶中加入10 mL水,再慢慢加入14 mL浓硫酸,混合均匀并冷至室温后,再依次加入9.2 mL正丁醇和13 g溴化钠,充分振荡后加入几粒沸石。(硫酸在反应中与溴化钠作用生成氢溴酸,氢溴酸与正丁醇作用发生取代反应生成正溴丁烷。硫酸用量和浓度过大,会加大副反应进行;若硫酸用量和浓度过小,不利于主反应的发生,即氢溴酸和正溴丁烷的生成)
投料注意事项:
(1)加料顺序不能颠倒。应先加水,再加浓硫酸,依次是醇,NaBr。加水的目的是:减少HBr的挥发;防止产生泡沫;降低浓硫酸的浓度,以减少副产物的生成。
(2)在此过程中要不断的摇晃,水中加浓硫酸时振摇,是防止局部过热;加正丁醇时混匀,是防止局部炭化;加NaBr时振摇,是防止NaBr结块,影响HBr的生成。
2、加热回流
在烧瓶上装上冷凝管,并在冷凝管上接一个气体吸收装置,用电热套加热回流1 h。
注意:在回流过程中要不断的摇动烧瓶。因为是两相反应,通过摇动增加反应物分子的接触几率。
3、分离粗产物
待反应液冷却后,改回流装置为蒸馏装置(用直形冷凝管冷凝),蒸出正溴丁烷粗产品。注意:判断粗产物是否蒸完。
判断的标准:
a、 馏出液由浑浊变澄清;
b、蒸馏烧瓶内油层(上层)消失;
c、取几滴馏出液,加少量水摇动,如无油珠,表示已蒸馏完毕。
4、粗产物的洗涤和干燥
将馏出液移至分液漏斗中,加入等体积的水洗涤(由于正溴丁烷的密度大于水,固产物在下层),静置分层后,将产物转入另一干燥的分液漏斗中,用等体积的浓硫酸洗涤(除去粗产物中的少量未反应的正丁醇及副产物正丁醚、1-丁烯、2-丁烯。尽量分去硫酸层(下层)。有机相依次用等体积的水(除硫酸)、饱和碳酸氢钠溶液(中和未除尽的硫酸)和水(除残留的碱)洗涤后,转入干燥的锥形瓶中,加入1—2g的无水氯化钙干燥,间歇摇动锥形瓶,直到液体清亮为止。
注:(1) 正丁醇和正溴丁烷可形成共沸物(bp.98.6℃,含正丁醇13%),故必须除净正丁醇。(2) 无水氯化钙干燥时,不仅可除去水分,还可除去醇类,因为醇类化合物(特别是低级醇)可与氯化钙作用生成结晶醇而不溶于有机溶剂。
本步注意事项:
(1)蒸馏粗品正溴丁烷后,残余物应趁热倒出后洗涤,以防止结块后难以洗涤。
(2)馏出液要充分洗涤,分液时要干净彻底(分除水相),注意产物是在上层还是在下层。各步洗涤顺序不能颠倒,应正确判断产物相。
5、收集产物
将干燥好的产物移至小蒸馏瓶中,在石棉网上加热蒸馏,收集99—103℃的馏分。
四、实验步骤流程图
五、为了提高产率,所采取的措施有:
1、浓硫酸过量,其作用有:
(1)吸收反应中生成的水,使HBr保持较高的浓度,加速反应的进行;
(2)使醇羟基质子化,容易离去;
(3)使反应中生成的水质子化,阻止卤代烷通过水的亲核进攻变回原来的醇;
(4)但是硫酸的存在易使醇生成烯或醚等副产品,因而要控制硫酸的加量。
2、增加NaBr的用量,使平衡右移。
3、通过回流,使反应完全。
4、加少量水,降低浓硫酸浓度,以减少副产物。
六、主要试剂及产品的物理常数(文献值)
七、实验结束后计算该合成反应的产率
八、思考题
1酯化反应有什么特点?
2为什么要慢慢分批加入浓硫酸?
3为什么开始反应时反应液分为三层,每一层是什么物质?
4洗涤时,各步产品在哪层?
5为什么在昆明,产品的收集温度是92—94℃?
6 p641, 2, 3
7预习p71乙酸乙酯的制备
参考文献:
1、有机化学实验,兰州大学、复旦大学化学系有机化学教研室编著,高等教育出版社。
2、基础有机化学实验,李明、李国强,杨丰科主编,化学工业出版社。
3、曾昭琼主编《有机化学实验》(第二版)
4、周科衍 吕俊民主编《有机化学实验》(第二版)
5、黄涛主编《有机化学实验》(第一版)
6、谷亨杰主编《有机化学实验》(第一版)
微波辐射合成正溴丁烷
Synthesis of n-bromobutane under microwave
[教学目的]
(1)了解微波辐射下合成正溴丁烷的原理;
(2)学习微波加热技术合成正溴丁烷的实验操作方法。
[教学内容]
一、实验原理
卤代烷可通过多种方法和试剂进行制备,如烷烃的自由基卤代和烯烃与氢卤酸的亲电加成反应等,但因产生的异构体混合物难以分离。实验室制备卤代烷最常用的方法是将结构对应的醇通过亲核取代反应转变为卤代物,常用试剂有卤化氢,三卤化磷,氯化亚砜。
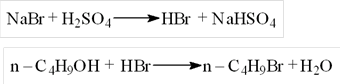
本实验是微波加热条件下利用正丁醇与溴化氢反应制备正溴丁烷,反应式如下:
微波的作用可以在两方面给出解释:(1) 极性分子在微波辐射作用下,分子按照电磁波的方向做调整,但其速度慢,导致分子间的摩擦,能快速达到高温。(2) 极性的改变引起电子云分布的改变,对有些反应能起到降低能垒的作用。
所以,微波加热具有三个特点:(1)在大量离子存在时能快速加热;(2)快速到达反应温度;(3)分子水平意义上的搅拌、耗时短、能耗低而效率高。
二、实验仪器及试剂
仪器:烧杯200 mL 1个、100 mL 1个、25 mL 圆底烧瓶、微型直型冷凝管、球型冷凝管,1000 w家用微波炉
药品:1.5 mL 浓硫酸、4.6 mL乙醇、2.9 mL冰醋酸、饱和碳酸氢钠、无水氯化钙、饱和氯化钠
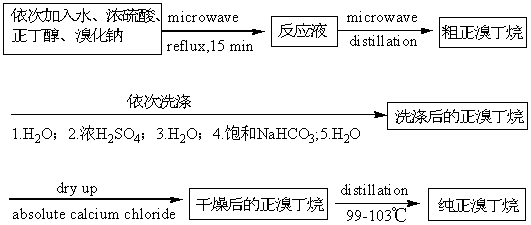
三、实验基本流程
四、将微波合成法的实验结果与常规法合成正溴丁烷的结果进行对比,并说明微波法的优点。
- 正溴丁烷的制备实验报告
-
1-溴丁烷的制备 实验报告
广东工业大学学院专业班组学号姓名协作者教师评定实验题目1溴丁烷的制备一实验目的学习由丁醇溴代制1溴丁烷的原理和方法练习带有吸收有害…
-
实验七_正溴丁烷的制备
正溴丁烷的制备实验目的1了解以正丁醇溴化钠和浓硫酸为原料制备正溴丁烷的基本原理和方法2掌握带有害气体吸收装臵的加热回流操作3进一步…
-
有机化学实验报告--1-溴丁烷的制备
1溴丁烷的制备一实验目的1学习由醇制备溴代烃的原理及方法2练习回流及有害气体吸收装置的安装与操作3进一步练习液体产品的纯化方法洗涤…
-
1-溴丁烷的制备实验报告
1溴丁烷的制备课程名称化学化工软件应用与操作姓名学号班级指导教师化学工程系目录一实验目的1二实验原理121主反应122副反应1三实…
- 正溴丁烷的制备实验报告
-
实验七_正溴丁烷的制备
正溴丁烷的制备实验目的1了解以正丁醇溴化钠和浓硫酸为原料制备正溴丁烷的基本原理和方法2掌握带有害气体吸收装臵的加热回流操作3进一步…
-
有机化学实验报告--1-溴丁烷的制备
1溴丁烷的制备一实验目的1学习由醇制备溴代烃的原理及方法2练习回流及有害气体吸收装置的安装与操作3进一步练习液体产品的纯化方法洗涤…
-
1-溴丁烷的制备 实验报告
广东工业大学学院专业班组学号姓名协作者教师评定实验题目1溴丁烷的制备一实验目的学习由丁醇溴代制1溴丁烷的原理和方法练习带有吸收有害…
-
1-溴丁烷的制备(实验报告)
1溴丁烷的制备实验报告一实验目的1学习用溴化钠浓硫酸和正丁醇制备1溴丁烷的原理和方法2学习有害气体吸收装置的安装巩固加热回流的操作…
-
1-溴丁烷的制备实验报告
1溴丁烷的制备课程名称化学化工软件应用与操作姓名学号班级指导教师化学工程系目录一实验目的1二实验原理121主反应122副反应1三实…