正溴丁烷的制备实验报告

第二篇:正溴丁烷的制备
实验一 1-溴丁烷的制备
计划学时:5学时
一、实验目的:
1、学习以溴化钠、浓硫酸和正丁醇制备正溴丁烷的原理与方法;
2、练习带有吸收有害气体装置的回流加热操作。
二、实验原理:本实验中正溴丁烷是由正丁醇与溴化钠、浓硫酸共热而制得:
【反应式】
主反应:
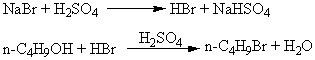
可能的副反应:
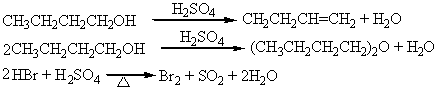
三、主要原料、产品和副产物的物理常数

【试剂】
7.5ml(0.08mol)正丁醇,10g(0.10mol)溴化钠,浓硫酸,饱和碳酸氢钠溶液,无水氯化钙
四、实验装置:图1

五、实验步骤:
1、投料
在圆底烧瓶中加入10ml水,再慢慢加入12ml浓硫酸,混合均匀并冷至室温后,再依次加入7.5ml正丁醇和10g溴化钠,充分振荡后加入几粒沸石。(硫酸在反应中与溴化钠作用生成氢溴酸,氢溴酸与正丁醇作用发生取代反应生成正溴丁烷。硫酸用量和浓度过大,会加大副反应进行;若硫酸用量和浓度过小,不利于主反应的发生,即氢溴酸和正溴丁烷的生成)
2、以电热套为热源,按图1安装回流装置(含气体吸收部分)。(注意防止碱液被倒吸)
3、加热回流
在石棉网上加热至沸,调整加热速度,以保持沸腾而又平稳回流,并不时摇动烧瓶促使反应完成。反应约30—40min。
4、分离粗产物
待反应液冷却后,改回流装置为蒸馏装置(用直形冷凝管冷凝),蒸出粗
产物。(注意判断粗产物是否蒸完)。见【注释】(2)
5、洗涤粗产物
将馏出液移至分液漏斗中,加入10ml的水洗涤(产物在下层),静置分层后,将产物转入另一干燥的分液漏斗中,用5ml的浓硫酸洗涤(除去粗产物中的少量未反应的正丁醇及副产物正丁醚、1—丁烯、2—丁烯。尽量分去硫酸层(下层)。有机相依次用10ml的水(除硫酸)、饱和碳酸氢钠溶液(中和未除尽的硫酸)和水(除残留的碱)洗涤后,转入干燥的锥形瓶中,加入1—2g的无水氯化钙干燥,间歇摇动锥形瓶,直到液体清亮为止。
6、收集产物
将干燥好的产物移至小蒸馏瓶中,蒸馏,收集99—103℃的馏分。
六、实验注意事项:
1、投料时应严格按教材上的顺序;投料后,一定要混合均匀。
2、反应时,保持回流平稳进行,防止导气管发生倒吸。
3、洗涤粗产物时,注意正确判断产物的上下层关系。
4、干燥剂用量合理。
七、思考题:
1.1— 溴丁烷制备实验为什么用回流反应装置?
2.1—溴丁烷制备实验为什么用球型而不用直型冷凝管做回流冷凝管?
3.1—溴丁烷制备实验采用1:1的硫酸有什么好处?
4.什么时候用气体吸收装置?怎样选择吸收剂?
5.1—溴丁烷制备实验中,加入浓硫酸到粗产物中的目的是什么?
6.1—溴丁烷制备实验中,粗产物用75度弯管连接冷凝管和蒸馏瓶进行蒸馏,能否改成一般蒸馏装置进行粗蒸馏?这时如何控制蒸馏终点?
7.在1—溴丁烷制备实验中,硫酸浓度太高或太低会带来什么结果?
习题:
1、实验报告 2、P.93【思考题】(1)(2)(3)
预习:P.105-106 正丁醚的制备
思考题答案:
1.此反应较慢,需要在较高的温度下、长时间反应,而玻璃反应装置可达到的最高反应温度是回流温度,所以采用回流反应装置。
2.因为球型冷凝管冷凝面积大,各处截面积不同,冷凝物易回流下来。
3.减少硫酸的氧化性,减少有机物碳化;水的存在增加HBr溶解量,不易逃出反应体系,减少HBr损失和环境污染。
4.有污染环境的气体放出时或产物为气体时,常用气体吸收装置。吸收剂应该是价格便宜、本身不污染环境,对被吸收的气体有大的溶解度。如果气体为产物,吸收剂还应容易与产物分离。
5.除去粗产物中未反应的原料丁醇或溶解的副产物丁烯等。
6.可用一般蒸馏装置进行粗蒸馏,馏出物的温度达到100℃时,即为蒸馏的终点,因为1-溴丁烷/水共沸点低于100℃,而粗产物中有大量水,只要共沸物都蒸出后即可停止蒸馏。
7.硫酸浓度太高:
(1)会使NaBr氧化成Br2,而Br2不是亲核试剂。
2 NaBr + 3 H2SO4(浓) →Br2 + SO2 + 2 H2O +2 NaHSO4
(2)加热回流时可能有大量HBr气体从冷凝管顶端逸出形成酸雾。
硫酸浓度太低:
生成的HBr量不足,使反应难以进行。
P.93(2)
用硫酸洗涤:除去未反应的正丁醇及副产物1-丁烯和正丁醚。
第一次水洗:除去部分硫酸及水溶性杂质。
碱洗(Na2CO3):中和残余的硫酸。
第二次水洗:除去残留的碱、硫酸盐及水溶性杂质。
- 正溴丁烷的制备实验报告
-
1-溴丁烷的制备 实验报告
广东工业大学学院专业班组学号姓名协作者教师评定实验题目1溴丁烷的制备一实验目的学习由丁醇溴代制1溴丁烷的原理和方法练习带有吸收有害…
-
实验七_正溴丁烷的制备
正溴丁烷的制备实验目的1了解以正丁醇溴化钠和浓硫酸为原料制备正溴丁烷的基本原理和方法2掌握带有害气体吸收装臵的加热回流操作3进一步…
-
有机化学实验报告--1-溴丁烷的制备
1溴丁烷的制备一实验目的1学习由醇制备溴代烃的原理及方法2练习回流及有害气体吸收装置的安装与操作3进一步练习液体产品的纯化方法洗涤…
-
1-溴丁烷的制备实验报告
1溴丁烷的制备课程名称化学化工软件应用与操作姓名学号班级指导教师化学工程系目录一实验目的1二实验原理121主反应122副反应1三实…
-
实验七_正溴丁烷的制备
正溴丁烷的制备实验目的1了解以正丁醇溴化钠和浓硫酸为原料制备正溴丁烷的基本原理和方法2掌握带有害气体吸收装臵的加热回流操作3进一步…
-
有机化学实验报告--1-溴丁烷的制备
1溴丁烷的制备一实验目的1学习由醇制备溴代烃的原理及方法2练习回流及有害气体吸收装置的安装与操作3进一步练习液体产品的纯化方法洗涤…
-
1-溴丁烷的制备 实验报告
广东工业大学学院专业班组学号姓名协作者教师评定实验题目1溴丁烷的制备一实验目的学习由丁醇溴代制1溴丁烷的原理和方法练习带有吸收有害…
-
实验七 正溴丁烷的制备
实验十正溴丁烷的制备实验目的1了解以正丁醇溴化钠和浓硫酸为原料制备正溴丁烷的基本原理和方法2掌握带有害气体吸收装置的加热回流操作3…
-
1-溴丁烷的制备(实验报告)
1溴丁烷的制备实验报告一实验目的1学习用溴化钠浓硫酸和正丁醇制备1溴丁烷的原理和方法2学习有害气体吸收装置的安装巩固加热回流的操作…
-
1-溴丁烷的制备实验报告
1溴丁烷的制备课程名称化学化工软件应用与操作姓名学号班级指导教师化学工程系目录一实验目的1二实验原理121主反应122副反应1三实…