湖南大学材料化学电化学实验报告
实验一 线性极化法测定金属Fe在稀H2SO4中的腐蚀速度
一、基本要求
1. 掌握动电位扫描法测定电极极化曲线的原理和实验技术。通过测定Fe在0.1M 硫酸溶液中的极化曲线,求算Fe的自腐蚀电位,自腐蚀电流。
2. 讨论极化曲线在金属腐蚀与防护中的应用。
二、实验原理
当金属浸于腐蚀介质时,如果金属的平衡电极电位低于介质中去极化剂(如H+或氧分子)的平衡电极电位,则金属和介质构成一个腐蚀体系,称为共轭体系。此时,金属发生阳极溶解,去极化剂发生还原。以金属铁在盐酸体系中为例:
阳极反应: Fe-2e=Fe2+
阴极反应: H++2e=H2
阳极反应的电流密度以 ia 表示, 阴极反应的速度以 ik表示, 当体系达到稳定时,即金属处于自腐蚀状态时,ia=ik=icorr(icorr为腐蚀电流),体系不会有净的电流积累,体系处于一稳定电位 。根据法拉第定律,体系通过的电流和电极上发生反应的物质的量存在严格的一一对应关系,故可阴阳极反应的电流密度代表阴阳极反应的腐蚀速度。金属自腐蚀状态的腐蚀电流密度即代表了金属的腐蚀速度。因此求得金属腐蚀电流即代表了金属的腐蚀速度。
。根据法拉第定律,体系通过的电流和电极上发生反应的物质的量存在严格的一一对应关系,故可阴阳极反应的电流密度代表阴阳极反应的腐蚀速度。金属自腐蚀状态的腐蚀电流密度即代表了金属的腐蚀速度。因此求得金属腐蚀电流即代表了金属的腐蚀速度。
金属处于自腐蚀状态时,外测电流为零。
极化电位与极化电流或极化电流密度之间的关系曲线称为极化曲线。极化曲线在金属腐蚀研究中有重要的意义。测量腐蚀体系的阴阳极极化曲线可以揭示腐蚀的控制因素及缓蚀剂的作用机理。在腐蚀点位附近积弱极化区的举行集会测量可以可以快速求得腐蚀速度。还可以通过极化曲线的测量获得阴极保护和阳极保护的主要参数。
在活化极化控制下,金属腐蚀速度的一般方程式为:
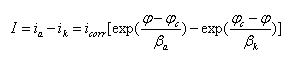
其中 I为外测电流密度,ia为金属阳极溶解的速度,ik为去极化剂还原的速度,βa、βk分别为金属阳极溶解的自然对数塔菲尔斜率和去极化剂还原的自然对数塔菲尔斜率。若以十为底的对数,则表示为ba、bk。
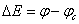 这就是腐蚀金属电极的极化曲线方程式,令
这就是腐蚀金属电极的极化曲线方程式,令
?E称为腐蚀金属电极的极化值,?E=0时,I=0;?E>0时,是阳极极化,I>0,体系通过阳极电流。?E<0时,I<0, 体系通过的是阴极电流,此时是对腐蚀金属电极进行阴极极化。因此外测电流密度也称为极化电流密度
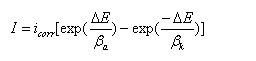
测定腐蚀速度的塔菲尔直线外推法
当对电极进行阳极极化,在强极化区,
阴极分支电流ik=0,
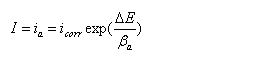
改写为对数形式:
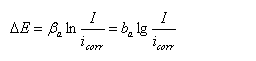
当对电极进行阴极极化,?E <0, 在强极化区,阳极分支电流ia=0
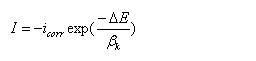
改写成对数形式:
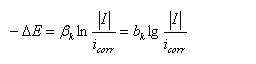
强极化区,极化值与外测电流满足塔菲尔关系式,如果将极化曲线上的塔菲尔区外推到腐蚀电位处,得到的交点坐标就是腐蚀电流。
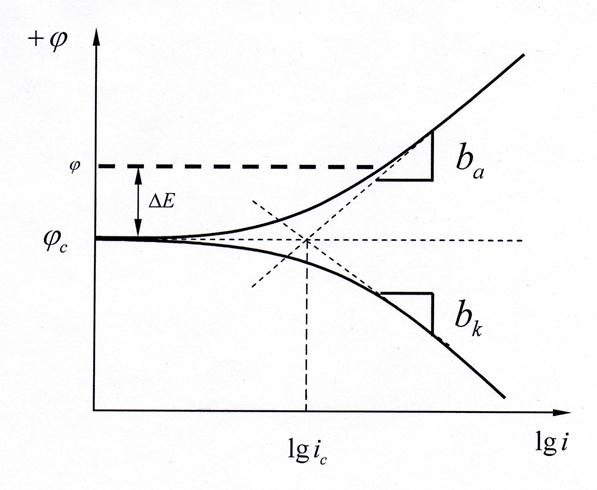
图 1 塔菲尔外推法求金属腐蚀电流的基本原理
三、实验仪器及药品
CHI660C电化学工作站1台;
烧杯一个;
汞/硫酸亚汞(参比电极)1支
Pt片电极(辅助电极)1支。
45号钢(圆柱体)电极
0.1M H2SO4溶液
蒸馏水,金相砂纸
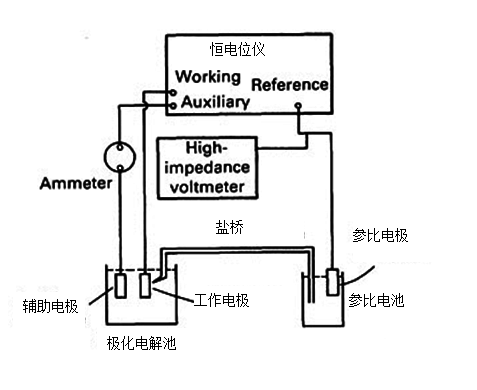
图2 极化曲线测量示意图
四、实验步骤
1. 电极处理:用金相砂纸将45号钢电极表面打磨平整光亮,测量试样的直径,计算工作面的面积。
2.将打磨光亮的电极用蒸馏水清洗、酒精去油。
3.测量极化曲线:
(1)打开CHI660C工作站的窗口。
(2)将三电极分别插入电极夹的三个小孔中,使电极进入电解质溶液中。将CHI工 作站的绿色夹头夹Fe电极,红色夹头夹Pt片电极,白色夹头夹参比电极。
(3)测定开路电位。点击“T”(Technique)选中对话框中“Open Circuit Potential-Time”实验技术,点击“OK”。点击“?”(parameters)选择参数,可用仪器默认值,点击“OK”。点击“?”开始实验,测得的开路电位即为电极的自腐蚀电势Ecorr。
(4)开路电位稳定后,测电极极化曲线。点击“T”选中对话框中“Tafel”实验技术,点击“OK”初始电位(Init E)设为比Ecorr低“-0.5V”,终态电位(Final E)设为比Ecorr高“1.25V”,扫描速率(Scan Rate)设为“0.0025V/s”灵敏度(sensivitivty)设为“自动”,其它可用仪器默认值,极化曲线自动画出。
(5)自腐蚀电流的拟合,打开CHI660C的控制软件,利用自带的软件求得自腐蚀电流密度。也可将实验数据考贝回去,用origin软件作图,用tafel外推法求的自腐蚀电流。将两者互相比较。
4. 实验完毕,清洗电极、电解池,将仪器恢复原位,桌面擦拭干净。
五、注意事项
不能将电极线接错。
六、实验报告内容
利用塔菲尔外推法求腐蚀电流。
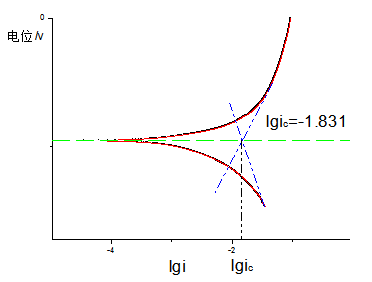
从Fe在0.1M 硫酸溶液中的极化曲线图中可以看出,
Fe的自腐蚀电位: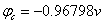
因为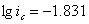 ,所以自腐蚀电流:
,所以自腐蚀电流: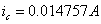
七、思考题
(1)平衡电极电位、自腐蚀电位有何不同。
答:平衡电极电位是指腐蚀电池开路时未发生极化时的阴极反应和阳极反应的平衡电位;而自腐蚀电位腐蚀体系的混合电位,由同时发生的两个电极过程共同决定,是不可逆的非平衡电位。
平衡电位不是自腐蚀电位。电极位于不用介质中,会有一个电极电位,比如管道在土壤中通常电极电位为0.55-065V.CSE,那么给管道加上一个极化电位,管道就不会有腐蚀电流流出,这时的电位叫平衡电位。也就是腐蚀电流为零的电位就是平衡电位。
(2)为什么可以用自腐蚀电流icorr来代表金属的腐蚀速度?
答:金属的腐蚀是金属被氧化,可以理解成铁失去电子,就是被氧化的过程。根据法拉第定律,即在电解过程中,阴极上还原物质析出的量与所通过的电流强度和通电时间成正比。自腐蚀电流Icorr越大,自腐蚀电位越负,说明腐蚀严重,腐蚀速度越快,腐蚀电流密度越大。即金属自腐蚀状态的腐蚀电流密度即代表了金属的腐蚀速度。故可阴阳极反应的电流密度代表阴阳极反应的腐蚀速度。
实验二 铁的钝化曲线
一、基本要求
1. 掌握有钝化行为的金属阳极过程的极化曲线特征
2. 求得Fe的自腐蚀电位,致钝电位、钝化电流密度、过钝化电位等参数。
3. 讨论极化曲线在金属腐蚀与防护中的应用。
二、实验原理
铁的钝化曲线(图1):
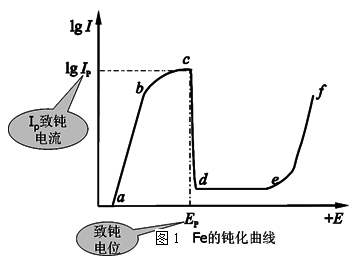
abc段是Fe的正常溶解,生成Fe2+,称为活化区。cd段称为活化钝化过渡区。
de段的电流称为维钝电流,此段电极处于比较稳定的钝化区, Fe2+离子与溶液中的离子形成FeSO4沉淀层,阻滞了阳极反应,由于H+不易达到FeSO4层内部,使Fe表面的pH增大,Fe2O3、Fe3O4开始在Fe表面生成,形成了致密的氧化膜,极大地阻滞了Fe的溶解,因而出现钝化现象。ef段称为过钝化区。
测得铁的钝化曲线可采用恒电位法(静态法)或动电位扫描法(动态法)。
静态法:将电极电势较长时间地维持在某一恒定值,同时测量电流密度随时间的变化,直到电流基本上达到某一稳定值。如此逐点地测量在各个电极电势下的稳定电流密度值,以获得完整的极化曲线的方法。
动态法:控制电极电势以较慢的速度连续地改变(扫描),并测量对应电势下的瞬时电流密度,并以瞬时电流密度值与对应的电势作图就得到整个极化曲线。所采用的扫描速度(即电势变化的速度)需要根据研究体系的性质选定。一般说来,电极表面建立稳态的速度越慢,则扫描也应越慢,这样才能使测得的极化曲线与采用静态法测得的结果接近。
三、实验仪器及药品
仪器 CHI660C电化学工作站(上海辰华公司)1台;电解池1个;硫酸亚汞电极(参比电极)、Fe电极(研究电极)、Pt片电极(辅助电极)各1支;
试剂 1mol/LH2SO4溶液
四、实验步骤
1、 电极处理:用金相砂纸将铁电极表面打磨平整光亮,用蒸馏水清洗后滤纸吸干。每次测量前都需要重复此步骤,电极处理得好坏对测量结果影响很大。
2、测量极化曲线:
(1)打开电化学工作站的窗口;
(2)安装电极,使电极进入电解质溶液中,将绿色夹头夹Fe电极,红色夹头夹Pt片电极,黄色夹头夹参比电极;
(3)测定开路电位。选中恒电位技术中的“开路电位—时间”实验技术,双击选择参数,可用仪器默认值,点击“确认”。点击“?”开始实验,测得的开路电位即为电极的自腐蚀电势Ecorr;
(4)开路电位稳定后,测电极极化曲线。选中“线性扫描技术”中的“塔菲尔曲线”实验技术,双击。为使Fe电极的阴极极化、阳极极化、钝化、过钝化全部表示出来,初始电位设为比Ecorr负500mV,终止电位设为“2.0V”,扫描速度设为“0.0025V/s”, 灵敏度(sensivitivty)设为“自动”。其它可用仪器默认值,极化曲线自动画出。
3、实验完毕,清洗电极、电解池,将仪器恢复原位,桌面擦拭干净。
五、注意事项
1、测定前仔细了解仪器的使用方法。
2、电极表面一定要处理平整、光亮、干净,不能有点蚀孔。
六、实验报告内容
从极化曲线上求出Fe电极的自腐蚀电位、钝化电流密度及钝化电位范围,对比上一实验,分析H2SO4浓度对Fe钝化的影响。
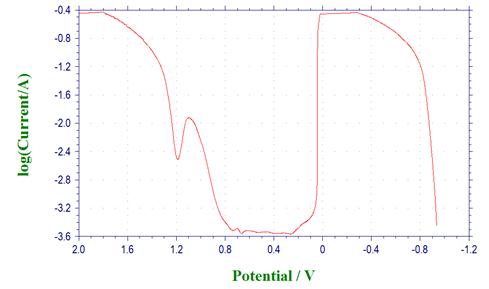
利用origin软件进行数据处理,得到电位E与lgI之间的关系图,即极化曲线如下:
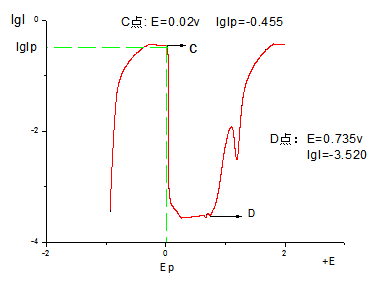
C点对应的是致钝电位(横坐标: )和致钝电流(
)和致钝电流(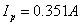 )
)
D点对应的是过钝化电位(横坐标: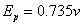 )
)
那么,钝化电位范围就是0.020v—0.735v
七、思考题
(1)分析H2SO4浓度对Fe钝化在影响。
答:常温下,硫酸浓度越大,对Fe的钝化作用越明显,而稀硫酸不能使铁钝化,因为浓硫酸是强氧化性酸,能把铁氧化成特殊价态的四氧化三铁(薄而致密),这种铁的氧化物不溶于浓硫酸和浓硝酸。而稀硫酸没有强氧化性,不能使金属表面生成致密的氧化膜,只能与金属发生置换反应,产生氢气。
(2)Fe在盐酸中能否钝化,为什么?
答:不能。因为铁经强氧化剂如浓硫酸或浓硝酸处理后,由活泼态转变为钝化态,由于钝化后表面生成了致密的氧化膜,起保护作用,不易被腐蚀,而盐酸是还原性酸,其酸根具有强还原性,是浓度高的氯离子的还原性,其中的氢离子的氧化性没有含氧酸根的氧化性强,不能使铁钝化。
(3)测定钝化曲线为什么不采用恒电流法?
答: 金属钝化指的是阳极电势超过一定值后发生的溶解速度迅速减小的现象,电势变化给了电子不同的运动力。而恒电流法只是给了恒定数量的电荷,并不是给了不同的活跃度,没法得到变化参数,所以不采用恒电流法。
实验三 铁氰化钾在玻碳电极上的氧化还原
一、基本要求
1. 掌握用循环伏安法判断电极反应过程的可逆性
2. 学会使用伏安极谱仪
3. 学会测量峰电流和峰电位
二、实验原理
循环伏安法是用途最广泛的研究电活性物质的电化学分析方法,在电化学、无机化学、有机化学、生物化学等领域得到了广泛的应用。由于它能在很宽的电位范围内迅速观察研究对象的氧化还原行为,因此电化学研究中常常首先进行的是循环伏安行为研究。
循环伏安是在工作电极上施加一个线性变化的循环电压,记录工作电极上得到的电流与施加电压的关系曲线,对溶液中的电活性物质进行分析。由于施加的电压为三角波,这种方法也称为三角波线性扫描极谱法。
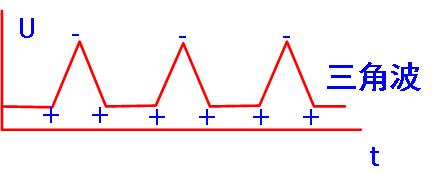
典型的循环伏安图如图所示:
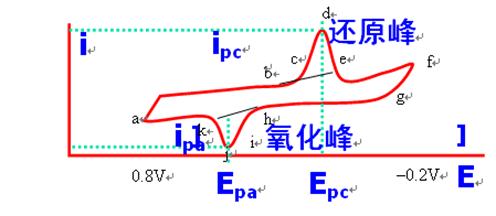
选择施加在a点的起始电位Ei,然后沿负的电位即正向扫描,当电位负到能够将Ox还原时,在工作电极上发生还原反应:Ox + Ze = Red,阴极电流迅速增加(b-d),电流在d点达到最高峰,此后由于电极附近溶液中的Ox转变为Red而耗尽,电流迅速衰减(d-e);在f点电压沿正的方向扫描,当电位正到能够将Red氧化时,在工作电极表面聚集的Red将发生氧化反应:Red = Ox + Ze,阳极电流迅速增加(i-j),电流在j点达到最高峰,此后由于电极附近溶液中的Red转变为Ox而耗尽,电流迅速衰减(j-k);当电压达到a点的起始电位Ei时便完成了一个循环。
循环伏安图的几个重要参数为:阳极峰电流(ipa)、阴极峰电流(ipc)、阳极峰电位(Epa)、阴极峰电位(Epc)。对于可逆反应,阴阳极峰电位的差值,即 △E=Epa-Epc ≈56 mV/Z,峰电位与扫描速度无关。
而峰电流ip=2.69×105n3/2AD1/2V1/2C,ip为峰电流(A),n为电子转移数,A为电极面积(cm2),D为扩散系数(cm2/s),V为扫描速度(V/s),C为浓度(mol/L)。由此可见,ip与V1/2和C都是直线关系。对于可逆的电极反应,ipa ≈ ipc。
三、实验仪器及药品
1.电化学工作站,三电极系统(玻碳电极为工作电极、饱和甘汞电极为参比电极、铂丝电极为辅助电极)
2. 铁氰化钾标准溶液(6.0×10-3 mol/L,含KNO3溶液1.0 mol/L),10 mL电解杯,10 mL容量瓶
四、实验步骤
1. 打开仪器预热20分钟,打开电脑,打开电化学工作站操作界面。
2. 电极抛光:用Al2O3粉将玻碳电极表面抛光,然后用蒸馏水清洗,待用。
3. 将铁氰化钾标准溶液转移至10 mL电解池中,插入三支电极,在“实验”菜单中选择“实验方法”,选择“循环伏安法”,点“确定”,设置实验参数:起始电位(+0.6 V);终止电位(-0.2 V);静止时间(2 s);扫描时间(任意扫速);扫描速度(0.1 V/s);灵敏度(1.0×e-3);循环次数(1);是否敲击(不敲击);通氮时间(0);氮气(不保持),点“确定”。从“实验”菜单中选择“开始实验”,观察循环伏安图,记录峰电流和峰电位。
4. 考察峰电流与扫描速度的关系,使用上述溶液,分别以不同的扫描速度:0.1、0.2、0.5 V/s(其他实验条件同上)分别记录从+0.6V~ -0.2V扫描的循环伏安图,记录峰电流。
5. 考察峰电流与浓度的关系,分别准确移取上述溶液1.00、2.00、5.00 mL,置于3只10 mL容量瓶中,分别用去离子水定容,摇匀,以0.1 V/s的扫描速度(灵敏度调为1.0×e-4,其他实验条件同上)分别记录从+0.6V~ -0.2V扫描的循环伏安图,记录峰电流。
五、注意事项
六、实验结果与处理
1. 计算阳极峰电位与阴极峰电位的差△E。
2. 计算相同实验条件下阳极峰电流与阴极峰电流的比值ipa / ipc。
3. 相同K3Fe(CN)6浓度下,以阴极峰电流或阳极峰电流对扫描速度的平方根作图,说明二者之间的关系。
4. 相同扫描速度下,以阴极峰电流或阳极峰电流对K3Fe(CN)6的浓度作图,说明二者之间的关系。
5. 根据实验结果说明K3Fe(CN)6在KNO3溶液中电极反应过程的可逆性。
A. 所得不同扫描速度下的循环伏安图如下:
1.扫描速度为 0.1 V/s

Epa=0.336 Epc=0.097 Ipa= -2.769*10-5 Ipc= 5.545*10-5
(1) 阳极峰电位与阴极峰电位的差△E=0.239V
(2) 阳极峰电流与阴极峰电流比值Ipa/Ipc=-0.499
2.扫描速度为0.2v/s
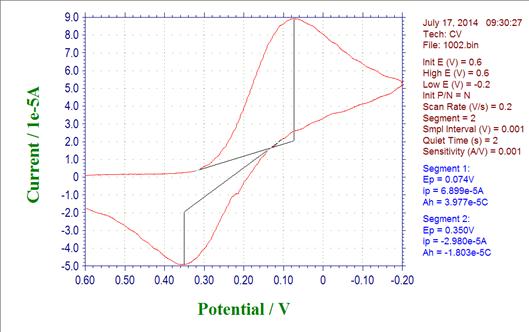
Epa= 0.350 Epc= 0.074 Ipa= -2.980*10-5 Ipc= 6.899*10-5
(1)阳极峰电位与阴极峰电位的差△E=0.276V
(2)阳极峰电流与阴极峰电流比值Ipa/Ipc= -0.432
3.扫描速度为0.5v/s
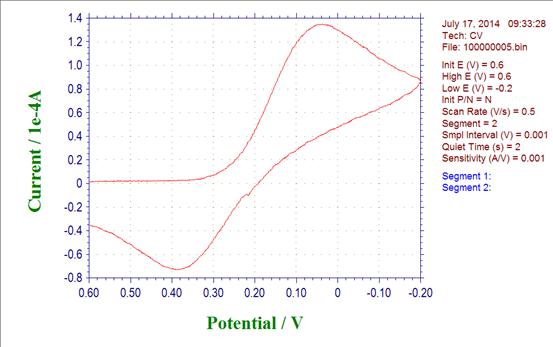
Up:EPc:0.0395 Ipc:1.349*10*-4 Down:Epa:0.3859 Ipa: -7.30*10-5
(1) 阳极峰电位与阴极峰电位的差△E=0.3464V
(2) 阳极峰电流与阴极峰电流比值Ipa/Ipc= -0.541
B. 所得不同浓度下的循环伏安图如示:
1.铁氰化钾标准溶液(6.0×10-5mol/L)
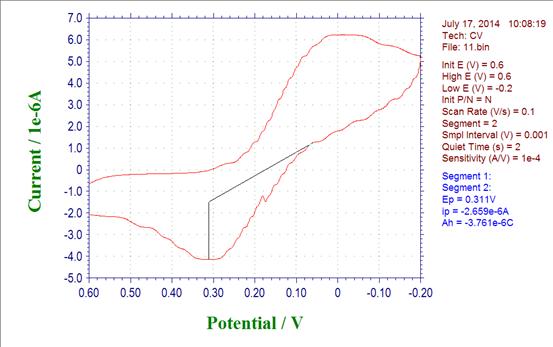
Epa= 0.311 Ipa= -2.695*10-6 Epc= 0.0228 Ipc=6.222*10-6
(1) 阳极峰电位与阴极峰电位的差△E=0.283V
(2) 阳极峰电流与阴极峰电流比值Ipa/Ipc= -0.433
2.铁氰化钾标准溶液(1.2×10-5mol/L)
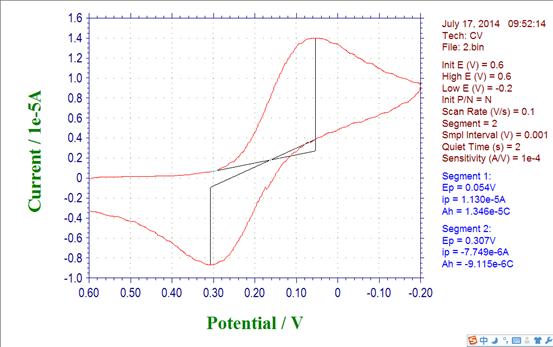
Epa= 0.307 Ipa= -7.749*10-6 Epc= 0.054 Ipc= 1.130*10-5
(1) 阳极峰电位与阴极峰电位的差△E=0.253V
(2) 阳极峰电流与阴极峰电流比值Ipa/Ipc= -0.686
2.铁氰化钾标准溶液(3×10-5mol/L)
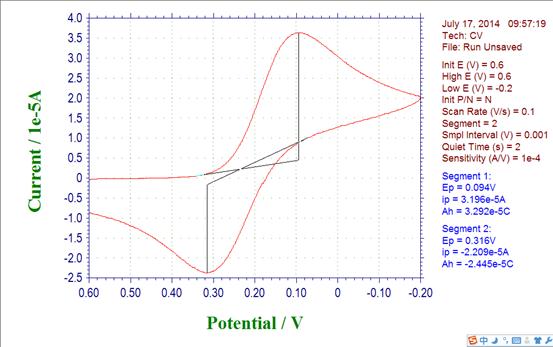
Epa = 0.316 Ipa= -2.209*10-5 Epc= 0.094 Ipc= 3.196*10-5
(1) 阳极峰电位与阴极峰电位的差△E=0.222V
(2) 阳极峰电流与阴极峰电流比值Ipa/Ipc=-0.691
C. 相同K3Fe(CN)6浓度下,以阴极峰电流或阳极峰电流对扫描速度的平方根作图,说明二者之间的关系。

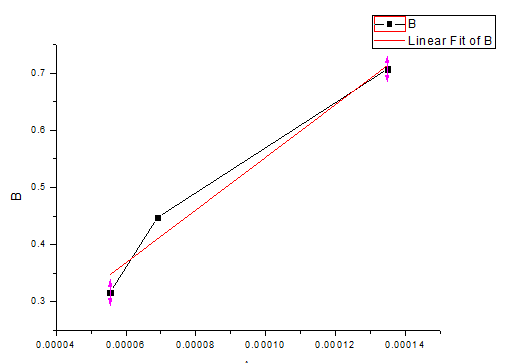

由下图可得,在同K3Fe(CN)6浓度下,阴极峰电流与扫描速度的平方根成直线性关系,且斜率为4608.81279。
D.相同扫描速度下,以阴极峰电流或对K3Fe(CN)6的浓度作图
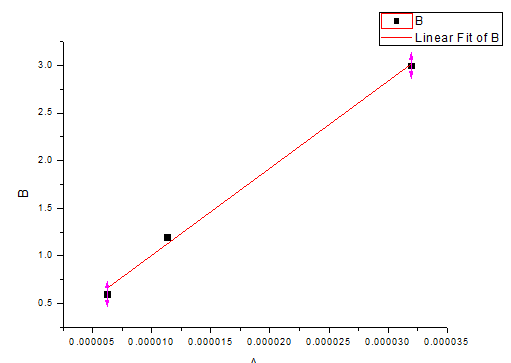
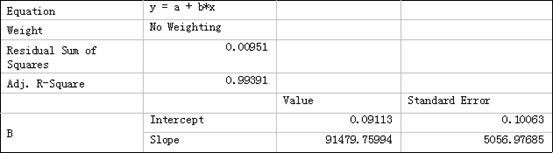
由下图可得,在相同扫描速度下,阳极峰电流与不同K3Fe(CN)6浓度下近似直线性关系,且斜率大约为91479.75994。
对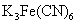 (内含0.20mol/L
(内含0.20mol/L 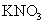 )溶液的循环伏安曲线进行数据处理,选取曲线的第二圈,即第三和第四段曲线,根据循环伏安曲线特点,用半峰法进行峰测量,测量结果如图:由测量结果可知,氧化峰电位为Ep2=244mV,峰电流为ip2=4.6983×10
)溶液的循环伏安曲线进行数据处理,选取曲线的第二圈,即第三和第四段曲线,根据循环伏安曲线特点,用半峰法进行峰测量,测量结果如图:由测量结果可知,氧化峰电位为Ep2=244mV,峰电流为ip2=4.6983×10 A;还原峰电位是Ep1=310mV,峰电流是ip1=4.666×10
A;还原峰电位是Ep1=310mV,峰电流是ip1=4.666×10 A。氧化峰还原峰电位差为66mV,峰电流的比值为:ip1/ip2=0.95≈1。由此可知,铁氰化钾体系(Fe(CN)63-/4-)在中性水溶液中的电化学反应是一个可逆过程。(注:由于该体系的稳定,电化学工作者常用此体系作为电极探针,用于鉴别电极的优劣。)
A。氧化峰还原峰电位差为66mV,峰电流的比值为:ip1/ip2=0.95≈1。由此可知,铁氰化钾体系(Fe(CN)63-/4-)在中性水溶液中的电化学反应是一个可逆过程。(注:由于该体系的稳定,电化学工作者常用此体系作为电极探针,用于鉴别电极的优劣。)
实验四 金属的电镀实验
一、基本要求
1. 了解电镀的基本概念
2. 了解电镀溶液中添加剂的作用。
二、实验原理
电镀是一个普遍的工业流程。使用电流,可以将一层金属如铜或镍镀在一有导电性的物体上。传统电镀的主要目的通常是改变基体表面的特性,改善基体材料的外观、耐腐蚀性和耐磨性。现在,电镀技术在制备半导体、催化材料、纳米材料等功能性材料和微机电加工领域正日益发挥着重要作用。国内期刊“电镀与环保”、“电镀与精饰”、“材料保护”等刊登这方面的研究。
把化学能转化为电能的过程称为电解。电镀属于电解,是一种电化学沉积过程,是指在含有欲镀金属的盐类溶液中,在直流电的作用下,以欲镀金属或其它惰性导体为阳极,通过电解作用,阴极镀件表面上沉积出金属,获得牢固的金属膜的过程。
根据法拉弟定律,在电镀镍时,通过电镀槽的电量若为l F(96500 C),则应得镍镀层0.5 mol(58.69/2 g)。而实际上沉积的镍不到0.5 mol,这是由于在电镀过程中,阴极上进行的反应不只是Ni2++2e-= Ni,还有2H++2e-= H2副反应的存在,使得用于沉积金属的电流只是通过总电流的一部分,而其余部分消耗在副反应上,所以电流效率达不到100%。电流效率计算公式如下:
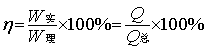
电镀前要对金属片进行打磨,其目的是为了处理、清洁被镀金属的表面,从而得到结合力好的镀层。镀层质量的好坏要考虑的因素有很多,主要有:被镀金属的特性、镀层特性、合适的前处理、合适的电镀溶液、合适的操作条件(电流密度、镀液浓度和各组分比例、镀液温度、时间、后处理)、合适的电镀设备和器具、环境条件等。
1.添加剂对电镀效果的影响
在电镀溶液中加添加剂:糖精、1,4-丁炔二醇、香豆素等可以明显的提高镀层的光亮度。加入光亮剂的镀镍溶液称光亮镀液。
2.杂质对镀层质量的影响
在电镀液中如果含有一定量的金属杂质,会影响渡层的质量,如镀镍溶液中含有Fe离子就会使镀层的质量下降。
3. 镀件的表面状态对镀层的影响
镀件的表面状态对镀层的光洁度,亮度,镀层的附着力等都有很大的影响。所以为了得到合格的镀层,镀件的表面必须经过合格的酸洗除锈、碱洗(或有机溶剂清洗)除油,机械或电化学抛光等。
三、实验仪器及药品
CHI660C电化学工作站;铜电极;普通镍镀液(成分见表1);NaOH,Na3PO4,Na2CO3,盐酸,金相砂纸
表1普通镀镍液成分
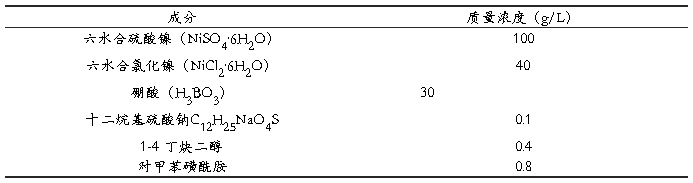
实验中所用的试剂均为分析纯试剂,并用蒸馏水配制。
四、实验步骤
(一)具体操作方法
1. 配制电镀溶液(按表1)
2. 电极的处理
黄铜电极为工作电极,尺寸为1cm×1cm,其中Cu/Zn的质量分数分别为59.65%和40.35%,大面积的镍片为对电极。实验开始前,工作电极依次用型号为50、600、2000的砂纸打磨,然后用丙酮擦洗,并用蒸馏水冲洗,再放入碱性洗液取出后用蒸馏水清洗,最后放入酸性洗液中,取出再用蒸馏水冲洗,在空气中晾干,备用。
3. 碱性洗液的配置
在80℃的条件下,用180g/L的NaOH和20g/Na3PO4+Na2CO3溶液清洗2~3s。
4. 酸性洗液的配置
在室温下,用稀盐酸溶液清洗2~3s。
5. 电镀实验
将铜阴极和镍阳极均用金相砂纸打磨光亮,用水冲洗干净。铜阴极经过碱洗、酸洗后,放入烧杯作阴极,镍片做阳极。
(1)打开CHI660C工作站的窗口。
(2)将CHI工作站的绿色夹头夹铜电极,红色和白色夹头同时夹镍片电极。
(3)测定开路电位。点击“T”(Technique)选中对话框中“多电流阶跃测量(如为英文界面则为 Multi-current steps”实验技术,点击“OK”。点击“?”(parameters)选择参数,在阶跃1 栏目下,设置电流为 0.02 A,时间根据设置10min,点击“OK”。点击“?”开始实验。
(4)在另一不加添加剂(十二烷基硫酸钠、1-4丁炔二醇、对甲苯磺酰胺)的电镀液中进行相同的操作,观察两次镀层表面的不同。
五、注意事项
1. 电解液化学品有一定的腐蚀和污染,实验和观察过程中应避免手、皮肤直接接触。
2. 实验完成后,镀液必须倒回原瓶中回收重复使用。
六、实验报告内容
1.记录恒实验过程电位随时间的变化,并讨论。
(1)电镀液中含有添加剂时,实验过程中电位随时间变化的曲线图如下:
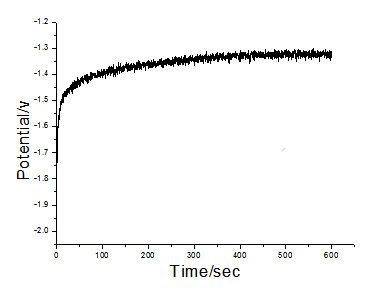
由origin图像可知,在0s—600s时间范围内,电位在刚开始从-1.30V迅速变化到2.08V然后又迅速变化到-1.50V,之后随着时间推移电位变化较为稳定,电位曲线呈现缓慢上升状态。
(2)电镀液中不含有添加剂时,实验过程中电位随时间变化的曲线图如下:
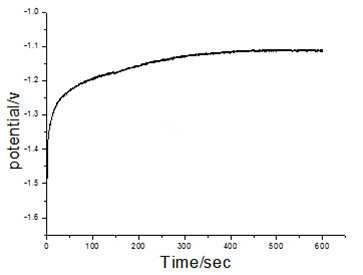
由origin图像可知,在0s—600s时间范围内,电位在刚开始从-1.06V迅速变化到-1.60V,之后随着时间推移电位变化较为稳定,电位曲线呈现缓慢上升状态。和含有添加剂的电镀液相比,不含添加剂的电镀液的电位曲线随时间变化较为缓慢。
2.通过电极系统通过的电量估算镀层的厚度。
通过电极系统的恒电流为0.02A,通电时间为600s,所以可得在这段时间内通过电极系统的电量为:
Q=It=0.02A×600s=12C (1)
所以通过电极系统的电子的物质的量为:
N=Q/F=12C/96500=1.2435×10-4mol (2)
而Ni每一次反应得失电子数为2,所以可得所镀的镍的物质的量为:
n=N/2=6.2176×10-5mol (3)
查得Ni的摩尔质量为58.7g/mol,Ni的密度为8.9g/cm3,所以可得所镀得的镍的质量及体积为:
m=nM=6.2176×10-5mol×58.7g/mol=3.6497×10-3g (4)
V=m/ρ=3.6497×10-3g/8.9g/cm3=4.1008×10-4cm3 (5)
已知被镀的铜片底面积为1cm2,所以可得理论上镀层的厚度为:
L=V/S=4.1008×10-4cm=4.1008μm (6)
而在实验结束后使用测厚仪测得的镀层厚度均在20μm以上,所以由此可以判断使用测厚仪测金属镀层厚度误差太大,所以测得的数据不足为信,故全部舍去。
3. 讨论添加剂对镀层表面的影响。
1) 光亮剂
它的加入可以使镀层光亮。如镀镍中的糖精及1,4-丁炔二醇;氯化物镀锌中的苄*丙酮等。当在镀液中含有几种光亮剂或将几种物质配制成复合光亮剂时,常根据光亮剂的集团及其在镀液中的作用、性能和对镀层的影响等,又将它们分为初级光亮剂、次级光亮剂、载体光亮剂和辅助光亮剂等。
2) 整平剂
具有使镀层将基体表面细微不平处填平的物质。如镀镍溶液中的香豆素,酸性光亮镀铜溶液中的四氢噻唑硫酮、甲基紫等。
3) 润湿剂
它们的主要作用是降低溶液与阴极间的界面张力,使氢气泡容易脱离阴极表面,从而防止镀层产生针孔。这类物质多为表面活性剂,其添加量很少,对镀液和镀层的其他性能没有明显的影响。如镀镍溶液中的十二烷基硫酸钠和铵盐镀锌中的海鸥洗涤剂。
七、思考题
1.普通镀液使用一段时间后就需更换新的镀液,电镀废液可以直接倒入下水道吗?为什么?电镀废液在排放之前应如何处理?
答:电镀废液不可以直接倒入下水道,因为如果是酸性废液,下水道管道是金属铁,会被腐蚀H+ + Fe == H2 + Fe2+ ;如果是碱性,会污染河流;如果含有重金属盐,都是有毒的,用于灌溉,会污染蔬菜等食品;如果含有有机物,会使水体富营养化,导致水体恶化。现在比较常见的废液处理方法有:(1)化学沉淀法,又分为中和沉淀法和硫化物沉淀法。(2)氧化还原处理,分为化学还原法、铁氧体法和电解法。(3)溶剂萃取分离法。(4)吸附法。(5)膜分离技术。(6)离子交换法。(7)生物处理技术,包括生物絮凝法、生物吸附法、生物化学法、植物修复法。
目前电镀废水的处理方法一般采用物化法之分流—综合两段处理。前段处理多分三支水:铬水、氰水和综合水(铜镍锌水)。铬水用还原剂使之变价还原,氰水用两级氧化破氰,铜镍锌水直接与前两股水汇合而成为综合水。后段处理综合水,基本上是用碱(烧碱或石灰)、聚合氯化铝(PAC)和有机絮凝剂(PAM),具体操作是:把综合水的pH值提到10~13,碱浓度大而迫使碱与重金属的反应向生成氢氧化物的方向进行。由于pH>9,排放口又得用酸中和使pH值降到9以下。
2.通常镀液由哪几种成分构成?分析该实验普通镀镍溶液中各成分的作用。
答:电镀液通常有主盐、导电盐、缓冲剂、阳极去极化剂、综合剂、和添加剂六种成分。六水合硫酸镍(NiSO4?6H2O)为主盐,在阴极上沉积出所要求的镀层Ni;六水合氯化镍(NiCl2?6H2O)为电解盐,提高溶液的电导率,对放电金属离子不起络合作用;硼酸(H3BO3)为缓冲剂,使溶液在遇到酸或碱时,溶液的pH值变化幅度缩小;十二烷基硫酸钠C12H25NaO4S为阳极去极化剂,在电解时能使阳极电位变负、促进阳极活化;1-4 丁炔二醇为综合剂,能络合六水合硫酸镍(NiSO4?6H2O)中Ni离子;对甲苯磺酰胺为有机添加剂,改善电镀溶液性能和镀层质量。
3.分析影响镀层质量的主要因素。
答:影响镀层质量主要有以下几个方面:
(1) 镀前处理是否良好:生产实践证明造成镀层质量事故的多数是由于金属制品的镀前处理不当和欠佳所致.镀前处理的每道工序都会直接影响到镀层质量。
(2) 电镀溶液的本性:镀液的性质,组成各成分的含量以及附加盐,添加剂的含量等。
(3) 基体金属的本性:镀层金属与基体金属的结合是否良好,与基体的化学性质有密切关系.如基体金属的电位负于镀层金属电位,或对易于钝化的基体或中间层,若不采取适当的措施,很难获得结合牢固的镀层。
(4) 电镀过程:电流密度,温度,送电方式,移动和搅拌等。
(5) 析氢反应:在电镀过程中大多数镀液的阴极反映都伴随着有氢气的析出.有不少情况下氢析对镀层质量有恶劣的影响:主要有针孔或麻点,鼓泡,氢脆等.如当析出的氢气粘附在阴极表面上会产生针孔或麻点;当一部分还原的氢原子渗入基体金属或镀层中,使基体金属及镀层的韧性下降而变脆,叫”氢脆”.镀铬时吸氢量较大,最易产生”氢脆”. “氢脆”对高强度钢及弹性零件生产的危害尤其严重.为了消除” 氢脆”的不良影响,应在镀后进行高温除氢处理。
(6) 镀后处理:镀后对工件的清洗,钝化,除氢,抛光,保管方法都会继续影响镀层的质量。
(7) 电镀电源:近年来,用一般的直流电源,已经不能满足越来越高的工艺要求了,需要广泛采用脉冲电镀电源和双脉冲电镀电源提供的脉冲电流;还有换向电镀的方法,使用周期换向电流等对镀层质量产生影响。
-
大学化学实验报告模板
物理化学实验报告院系班级学号姓名实验名称姓名日期成绩实验名称姓名日期成绩实验名称姓名日期成绩实验名称姓名日期成绩实验名称姓名日期成…
-
大学化学实验报告
大学化学实验报告专业班级学号姓名基础化学实验中心实验名称实验时间年月日学生姓名同组人姓名第一部分实验预习报告一实验目的二实验原理三…
- 大学化学实验报告格式
-
大 学 化 学 实 验 报 告
大学化学实验报告综合性实验学院班级学号姓名扬州大学化学实验教学中心20xx年9月综合性实验报告班级姓名组别实验名称实验日期实验目的…
-
大学化学A实验报告
实验一硫酸亚铁铵的制备姓名班级学号指导老师实验成绩一实验目的1了解复盐的制备方法2练习简单过滤减压过滤操作方法3练习蒸发浓缩结晶等…
-
氧化还原反应实验报告
实验十二氧化还原反应一实验目的1理解电极电势与氧化还原反应的关系和介质浓度对氧化还原反应的影响2加深理解氧化态或还原态物质浓度变化…
-
电化学分析实验报告
电化学分析实验报告姓名:XXX专业:有机化学学号:时间:20XX.12.12一、实验目的1、了解电化学工作站的结构并熟悉其操作流程…
-
电化学基础实验报告 4.23
华南师范大学实验报告学号20xx0010011专业课程名称实验项目循环伏安法测定电极反应参数综合实验时间月日实验类型验证设计实验指…
-
氧化还原与电化学实验报告
氧化还原与电化学实验报告一实验目的二实验原理三预习思考题1为什么KMnO4能氧化盐酸中的Cl而不能氧化氯化钠溶液中的Cl2为什么H…
-
实验九 氧化还原与电化学
氧化还原与电化学三(一)、电极电势与氧化还原反应方向结论:(MnO4/Mn2+)(Fe3/Fe2+)(I2/I-)(Sn4+/Sn…
-
分析化学实验报告(武汉大学第五版)
分析化学实验报告陈峻贵州大学矿业学院贵州花溪550025摘要熟悉电子天平的原理和使用规则同时可以学习电子天平的基本操作和常用称量方…