TBS报告方式说明
TBS 报 告 方 式 说 明
一、 怎么样才算真正符合TBS报告方式的液基制片技术
19xx年7月全国宫颈癌防治研究协作会议制订关于细胞学涂片诊断标准的五级分类法,全国许多地区到今仍在沿用。19xx年WHO提出应用描述性报告和与CIN一致的报告系统。同年美国NCI提出Bethesda(TBS系统)报告方式,该法主要强调将涂片质量,描述性诊断及临床与细胞病理互相沟通,并引进了鳞状上皮内病变(SIC)的概念。19xx年11月全国性“宫颈/阴道细胞学诊断报告方式”研讨会建议2-3年内在全国试用TBS系统报告方式,待条件成熟后再在全国推广应用。
TBS报告核心内容:它是一种描述性诊断,包括4个部分:
? 对涂片的满意程度:满意、基本满意和不满意。
? 良性细胞改变:
1、感染:滴虫性阴道炎;霉菌性阴道炎;形态学似嗜血杆菌感
染;形态学似人乳头状瘤感染;形态学似单纯疱疹病毒感染。
2、反应性改变:炎症(包括典型修复细胞的出现);萎缩性改变
及炎症;放疗后改变;放置宫内节育器的反应及其他。
? 上皮细胞的异常改变:
1、 鳞状上皮细胞:没有明确诊断意义的不典型鳞状上皮细胞
(ASCUS);低度鳞状上皮细胞内病变(LSIL)包括CIN1;
高度鳞状上皮内病变(HSIL)包括CIN2、CIN3、原位癌;鳞
癌。
2、 腺上皮细胞:没有明确诊断意义的不典型腺上皮细胞
(SGCUS);宫颈腺癌。
? 雌性激素水平的评估:
雌性激素水平与年龄相符;雌性激素水平与年龄不相符;雌性激素水平难以评估。
TBS系统报告方式主要强调涂片的质量,对镜下所见细胞及其他有诊断价值的成分进行系统性报告及描述性诊断。现在许多商家(所谓的膜式过滤法液基细胞)为了推销自己的产品,把制片质量的优良简单地描述为只剩下上皮细胞、癌细胞、背景干净,其实这完全不符合TBS系统报告方式要求。如果在标本修理和制片过程中将中性粒细胞、淋巴细胞、霉菌等有价值的成分当成杂质统统去掉或是过滤掉,那么在TBS报告中“良性细胞改变”这项重要内容无法进行,当然由此方法制出的片子是不合格的,采用过滤膜进行工作的设备在国外已经淘汰,去掉了有诊断价值成分是方法淘汰的主要原因(滤膜微孔8微米,小于8微米的成分被过滤去除)。
标本中可以被去掉的只能是黏液、无结构的坏死退化细胞、大量红细胞、悬浮的细菌等无诊断价值的干扰成分,增加制片的清洁度。
二、改良宫颈/阴道细胞学的分类及报告细则(TBS) 巴氏涂片与TBS系统回报比较表:
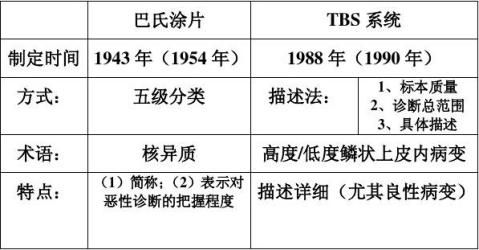
三、各种常见感染的阴道细胞学改变说明:
1. 滴虫性阴道炎:除见到典型及非典型滴虫外,还常常见到污垢状的滴虫背景、白细胞、退变细胞、细胞碎屑增多,上皮细胞核可见到核周空晕现象,细胞染色晦暗。
2. 霉菌性阴道炎:细胞学图像见到霉菌或孢子外,也可见到核黄素周晕现象,白细胞增加不明显。
3. 嗜血杆菌感染:除见到线索细胞》20%外,涂片背景中无阴道杆菌,且白细胞缺如,合并滴虫感染例外。
4. 单纯疱疹病毒感染:主要见于疱疹2病毒感染,感染的细胞增大,胞桨嗜碱性均匀不透明,呈毛玻璃外观,核大,多核,核彼此镶嵌,互不重叠。
5. 人乳头瘤病毒(HPV)感染:目前此种病毒的感染有明显上升趋势。鳞状上皮被HPV感染后,阴道细胞涂片上,可见到3种细胞构成:挖空细胞、角化不良细胞和湿疣外底层细胞。
? 挖空细胞:主要特征为表层和中层的细胞核周有较在空穴,环壁边缘锐利不规则,胞桨染色可呈蓝色、伊红色或双色。核大或双核,核居中或偏位,核染色质地致密深染。
? 角化不良细胞:常呈致密成片排列形式,胞桨嗜伊红或橘黄色。核稍大,圆形或梭形,核染色质固缩。
? 湿疣外底层细胞:常见化生性外底层细胞,胞桨呈双色,核稍大,染色质呈污垢状。
三、反应性细胞改变:
1、炎症反应性细胞学改变:无论何种原因引起的炎症,直接的宿主反应是细胞的退变及坏死。
? 细胞背景的改变:背景常常较脏,有大量白细胞或红细胞,浆细胞,淋巴细胞可较多,有时组织细胞或多核巨细胞也可出现。另外,背景中也可见到黏液及退化坏死的碎屑。
? 细胞的改变:细胞增大或形态轻度不规则;胞浆致密或晦暗不清晰,可有空泡、核周晕、异染或多彩性,甚至胞浆可消失出现裸核。胞核轻度增大,双核,多核或核致密固缩或碎裂。
? 细胞成分比例的改变:炎症时,涂片中外底层细胞增多,也可出现内底层细胞膜。
? 细胞的特殊形态改变:化生、修复和储备细胞。
1、化生细胞:化生是有一种类型的上皮转化为另一种类型上皮的过程。从化生组织脱落下来的上皮细胞,称为化生细胞。它分为未成熟化生细胞的成熟化生细胞。所谓未成熟化生细胞指形态多为圆形或卵圆形,与外底层细胞相似,胞浆常有小突起,胞核较大,核染色质匀细。所谓成熟化生细胞指形态多为多角形,胞浆丰富多突起,如蜘蛛状。
2、修复细胞:它是指组织在修复过程中,从再生上皮脱落下来的细胞。形态特征为细胞常以片状或团状,似合胞体式排列形式出现。细胞的排列方向一致,但不规则,胞浆边缘常有裂隙。细胞增大,胞浆丰富,可有空泡,嗜碱性染色。胞核增大,核仁明显,核膜增厚,
染色质呈细颗粒状。
3、储备细胞:在柱状上皮的底层,有一层具有分化潜能的幼稚细胞,称为储备细胞。形态特征为细胞很小,呈卵圆形或低柱状,常成群排列,边界不清,胞浆少呈多角形,嗜碱,含细小空泡。泡核大,可有皱褶或纵沟,染色质匀细。
? 萎缩性改变及炎症:绝经后卵巢功能的减退因人而异,宫颈细胞学涂片不一定表现为萎缩性改变。典型的萎缩性图像以嗜碱性外底层细胞多见。也可见到嗜酸性外底层细胞。合并炎症时,背景中伴有大量白细胞、组织细胞及黏液和杂菌。核呈退性改变,核增大,核固缩,核碎裂,核溶解均可出现。
? 放置宫内节育器后的改变:在子宫内可产生异物效应,导致子宫内膜腺上皮及子宫颈管柱状上皮细胞膜的反应性改变。细胞学涂片常见的表现为特异性炎症。有时可见到不典型的腺上皮细胞及怪异状细胞,需与腺癌相区别。
? 放疗后的细胞学改变:放射线对良性细胞及恶性细胞,均能产生明显的影响,其改变基本相似。主要有下形态改变:细胞明显增大,核浆比正常,胞浆及胞核呈比例增大;可出现怪异细胞;胞浆内空泡可很大也可很小,有时染多彩性;核黄素大小不一,多核或双核多见。
四、鳞状上皮细胞的异常改变
? 没有明确诊断意义的不典型鳞状上皮细胞(ASCUS)的形态改变:细胞没有典型的良性结构或恶性结构改变;细胞形态多样,或大
或小,或呈片或散在;胞浆以嗜碱性为主,也可嗜酸性;核大。比正常中层细胞膜核大2--2.5倍,核浆比轻度增加;核轮廓光滑规则,可见双核,核轻度深染,染色质分布均匀。
另外ASCUS也可包括以下几种不典型的细胞:诊断HPV证据不足,但不能排除者;不典型化生细胞;不典型修复细胞;角化不良细胞;不典型萎缩细胞。
ASCUS的临床意义:可能与炎症有关(3-6个月复查);与化学刺激有关(3-6个月复查);与宫内节育器有关(3-6个月复查);与抹片采取固定不好有关(3-6个月复查);可能有癌前病变,但异常细胞程度不够标准。
? 宫颈上皮内瘤变(CIN):由于中度不典型增生和原位癌无明显界限,所以有学者将不同程度的不典型增生和原位癌统称为宫颈上皮内瘤变(CIN)。分1级(轻度)不典型增生,为CIN1;2级(中度)不典型增生,为CIN2;3级(重度)不典型增生及原位癌,为CIN3。CIN作为子宫颈鳞状上上以病变相互交流的名称,CIN的概念表明病人子宫颈上皮有异常,但一般不能根据临床症状分级。
CIN与非典型增生、原位癌的替代关系:
LSIL CIN1:轻度不典型增生
HSIL CIN2:中度不典型增生
CIN3:重度不典型增生----原位癌。
1、低度鳞状上皮内病变(LSIL//CIN1)的细胞学改变:
形态描述如下:细胞单个散在或片状排列,细胞边界清楚可见;以中表层细胞为主,胞浆嗜酸性;核增大,比正常中层细胞核至少大3倍;核大小形态中度不一致,双核或多核常见;核膜清晰可见或模糊不清;核深染,染色质均匀;核仁少见或不明显。核周空穴细胞,不典型空穴细胞,细胞改变符合HPV感染,包括在LSIL内。
2、高度鳞状上皮内病变(HSIL//CIN2//CIN3//原位癌):
形态描述如下:细胞大小比LSIL小,常常单个散在或成片或像合胞体样排列;大多胞浆嗜碱性,偶见嗜酸性;核大,核浆比明显增大;见有不规则核轮廓;核深染明显,染色质细颗粒状或块状,但分布均匀;核仁常常不明显。
? 鳞状细胞癌:细胞学分型标准介绍如下:
1、非角化型鳞状细胞癌:
形态描述如下:细胞单个散在,或成团,成片或合胞体样排列;细胞大,以大细胞及中间细胞为主,也可见小细胞,偶尔可见到怪异状细胞;胞浆多嗜碱性,也可混有角化型细胞;胞核明显增大,染色质增多粗,颗粒状,分布不均,可出现块状;核浆比明显失比;核轮廓不规则;核仁明显。
2、角化型鳞状细胞癌:
形态描述如下:细胞多为散在或松散排列,也可有片状排列,偶可见到角化珠;癌细胞大小不一,形态多样,怪异状细胞多见;胞
浆通常嗜酸性或嗜橘红色,也可混有嗜碱性癌细胞;核大小形态多种多样,染色质呈粗颗粒状,固缩状,块状,分布不均匀;核仁较少见。
3、小细胞型鳞状细胞癌:
形态描述如下:细胞多呈松散的片状排列,很少单个孤立存在;细胞小,呈圆形或卵圆形;胞浆少,通常嗜碱性;胞核大,核浆比明显失比,核深染,有粗颗粒状染色质,核轮廓不规则;核仁不明显。
五、柱状上皮细胞的异常改变:
? 没有明确诊断意义的不典型腺上皮细胞(AGCUS)。 1、来源于宫颈管细胞的AGCUS:
形态描述为:细胞常呈片状排列,轻度大小不等;核大,比正常宫颈管细胞大3-5倍;胞核大小不一致;细胞核轻度深染;核仁常常可见。
2、来源于宫内膜的AGCUS:
形态描述为:细胞常成群或呈团出现,边界不清;细胞核轻度增大,轻度深染;核仁不明显;
? 宫颈腺癌:
形态描述为:细胞排列的特征为片状,条索状或假复层状,花团状或放射状结构;胞浆通常嗜碱性,也可嗜酸性;细胞核增大拥挤,染色质呈粗颗粒状;核仁明显或多核仁。
? 子宫内膜腺癌:
形态描述为:涂片背景常显示高雌激素影响水平;细胞常成团出
现,相互重叠,也可单个散在,松散排列;胞浆少嗜碱,常见空泡;细胞核以分化程度不同,大小相差悬殊;核染色质深,结构不清;核仁不明显。
? 子宫外腺癌:
子宫外的腺癌细胞,很少出现在阴道细胞涂片上,有时可以见到来自卵巢癌脱落的癌细胞,卵巢癌通常心肝浆液性乳头状囊腺癌多见,其细胞形态与子宫腺癌细胞相似,一般癌细胞呈卵圆形团块或乳头团块出现。胞浆少,可有空泡,胞核多贴边排列,恶性核结构,多伴有清洁,高雌激素影响的涂片背景。
福建安信生物科技有限公司整理 20xx年8月6日
第二篇:TBS报告方式说明
TBS 报 告 方 式 说 明
一、怎么样才算真正符合TBS报告方式的液基制片技术
19xx年7月全国宫颈癌防治研究协作会议制订关于细胞学涂片诊断标准的五级分类法,全国
许多地区到今仍在沿用。19xx年WHO提出应用描述性报告和与CIN一致的报告系统。同年美国NCI提出Bethesda(TBS系统)报告方式,该法主要强调将涂片质量,描述性诊断及临床与细胞病理互相沟通,并引进了鳞状上皮内病变(SIC)的概念。19xx年11月全国性“宫颈/阴道细胞学诊断报告方式”研讨会建议2-3年内在全国试用TBS系统报告方式,待条件成熟后再在全国推广应用。 TBS报告核心内容:它是一种描述性诊断,包括4个部分:
(一) 对涂片的满意程度:满意、基本满意和不满意。
(二) 良性细胞改变:
1、感染:滴虫性阴道炎;霉菌性阴道炎;形态学似嗜血杆菌感染;形态学似人乳头状瘤感染;形
态学似单纯疱疹病毒感染。
2、反应性改变:炎症(包括典型修复细胞的出现);萎缩性改变及炎症;放疗后改变;放置宫内
节育器的反应及其他。
(三)上皮细胞的异常改变:
1、 鳞状上皮细胞:没有明确诊断意义的不典型鳞状上皮细胞(ASCUS);低度鳞状上皮细胞内病变
(LSIL)包括CIN1;高度鳞状上皮内病变(HSIL)包括CIN2、CIN3、原位癌;鳞癌。
2、 腺上皮细胞:没有明确诊断意义的不典型腺上皮细胞(SGCUS);宫颈腺癌。
(四)雌性激素水平的评估:
雌性激素水平与年龄相符;雌性激素水平与年龄不相符;雌性激素水平难以评估。
TBS系统报告方式主要强调涂片的质量,对镜下所见细胞及其他有诊断价值的成分进行系统性报告及描述性诊断。现在许多商家(所谓的膜式过滤法液基细胞)为了推销自己的产品,把制片质量的优良简单地描述为只剩下上皮细胞、癌细胞、背景干净,其实这完全不符合TBS系统报告方式要求。如果在标本修理和制片过程中将中性粒细胞、淋巴细胞、霉菌等有价值的成分当成杂质统统去掉或是过滤掉,那么在TBS报告中“良性细胞改变”这项重要内容无法进行,当然由此方法制出的片子是不合格的,采用过滤膜进行工作的设备在国外已经淘汰,去掉了有诊断价值成分是方法淘汰的主要原因(滤膜微孔8微米,小于8微米的成分被过滤去除)。
标本中可以被去掉的只能是黏液、无结构的坏死退化细胞、大量红细胞、悬浮的细菌等无诊断价值的干扰成分,增加制片的清洁度。
二、改良宫颈/阴道细胞学的分类及报告细则(TBS)
巴氏涂片与TBS系统回报比较表:
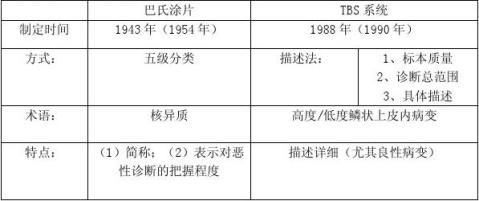
三、各种常见感染的阴道细胞学改变说明:
1.滴虫性阴道炎:除见到典型及非典型滴虫外,还常常见到污垢状的滴虫背景、白细胞、退变细胞、
细胞碎屑增多,上皮细胞核可见到核周空晕现象,细胞染色晦暗。
2.霉菌性阴道炎:细胞学图像见到霉菌或孢子外,也可见到核黄素周晕现象,白细胞增加不明显。 1
3.嗜血杆菌感染:除见到线索细胞》20%外,涂片背景中无阴道杆菌,且白细胞缺如,合并滴虫感染例
外。
4.单纯疱疹病毒感染:主要见于疱疹2病毒感染,感染的细胞增大,胞桨嗜碱性均匀不透明,呈毛玻
璃外观,核大,多核,核彼此镶嵌,互不重叠。
5.人乳头瘤病毒(HPV)感染:目前此种病毒的感染有明显上升趋势。鳞状上皮被HPV感染后,阴道细
胞涂片上,可见到3种细胞构成:挖空细胞、角化不良细胞和湿疣外底层细胞。
(1)挖空细胞:主要特征为表层和中层的细胞核周有较在空穴,环壁边缘锐利不规则,胞桨染色可呈
蓝色、伊红色或双色。核大或双核,核居中或偏位,核染色质地致密深染。
(2)角化不良细胞:常呈致密成片排列形式,胞桨嗜伊红或橘黄色。核稍大,圆形或梭形,核染色质固缩。(3)湿疣外底层细胞:常见化生性外底层细胞,胞桨呈双色,核稍大,染色质呈污垢状。
三、反应性细胞改变:
1、炎症反应性细胞学改变:无论何种原因引起的炎症,直接的宿主反应是细胞的退变及坏死。
●细胞背景的改变:背景常常较脏,有大量白细胞或红细胞,浆细胞,淋巴细胞可较多,有时组织细胞或
多核巨细胞也可出现。另外,背景中也可见到黏液及退化坏死的碎屑。
●细胞的改变:细胞增大或形态轻度不规则;胞浆致密或晦暗不清晰,可有空泡、核周晕、异染或多彩性,
甚至胞浆可消失出现裸核。胞核轻度增大,双核,多核或核致密固缩或碎裂。
●细胞成分比例的改变:炎症时,涂片中外底层细胞增多,也可出现内底层细胞膜。
●细胞的特殊形态改变:化生、修复和储备细胞。
1、化生细胞:化生是有一种类型的上皮转化为另一种类型上皮的过程。从化生组织脱落下来的上皮细胞,称为化生细胞。它分为未成熟化生细胞的成熟化生细胞。所谓未成熟化生细胞指形态多为圆形或卵圆形,与外底层细胞相似,胞浆常有小突起,胞核较大,核染色质匀细。所谓成熟化生细胞指形态多为多角形,胞浆丰富多突起,如蜘蛛状。
2、修复细胞:它是指组织在修复过程中,从再生上皮脱落下来的细胞。形态特征为细胞常以片状或团状,似合胞体式排列形式出现。细胞的排列方向一致,但不规则,胞浆边缘常有裂隙。细胞增大,胞浆丰富,可有空泡,嗜碱性染色。胞核增大,核仁明显,核膜增厚,染色质呈细颗粒状。
3、储备细胞:在柱状上皮的底层,有一层具有分化潜能的幼稚细胞,称为储备细胞。形态特征为细胞很小,呈卵圆形或低柱状,常成群排列,边界不清,胞浆少呈多角形,嗜碱,含细小空泡。泡核大,可有皱褶或纵沟,染色质匀细。
●萎缩性改变及炎症:绝经后卵巢功能的减退因人而异,宫颈细胞学涂片不一定表现为萎缩性改变。典型
的萎缩性图像以嗜碱性外底层细胞多见。也可见到嗜酸性外底层细胞。合并炎症时,
背景中伴有大量白细胞、组织细胞及黏液和杂菌。核呈退性改变,核增大,核固缩,
核碎裂,核溶解均可出现。
●放置宫内节育器后的改变:在子宫内可产生异物效应,导致子宫内膜腺上皮及子宫颈管柱状上皮细胞膜
的反应性改变。细胞学涂片常见的表现为特异性炎症。有时可见到不典型的
腺上皮细胞及怪异状细胞,需与腺癌相区别。
●放疗后的细胞学改变:放射线对良性细胞及恶性细胞,均能产生明显的影响,其改变基本相似。主要有
下形态改变:细胞明显增大,核浆比正常,胞浆及胞核呈比例增大;可出现怪异
细胞;胞浆内空泡可很大也可很小,有时染多彩性;核黄素大小不一,多核或双
核多见。
四、鳞状上皮细胞的异常改变
●没有明确诊断意义的不典型鳞状上皮细胞(ASCUS)的形态改变:细胞没有典型的良性结构或恶性结构
改变;细胞形态多样,或大或小,或呈片或散在;胞浆以嗜碱性为主,也可嗜酸性;核大。比正常中层细胞膜核大2--2.5倍,核浆比轻度增加;核轮廓光滑规则,可见双核,核轻度深染,染色质分布均匀。
另外ASCUS也可包括以下几种不典型的细胞:诊断HPV证据不足,但不能排除者;不典型化生
细胞;不典型修复细胞;角化不良细胞;不典型萎缩细胞。
2
ASCUS的临床意义:可能与炎症有关(3-6个月复查);与化学刺激有关(3-6个月复查);与
宫内节育器有关(3-6个月复查);与抹片采取固定不好有关(3-6个月复查);可能有癌前病变,但异常细胞程度不够标准。
●宫颈上皮内瘤变(CIN):由于中度不典型增生和原位癌无明显界限,所以有学者将不同程度的不典型
增生和原位癌统称为宫颈上皮内瘤变(CIN)。分1级(轻度)不典型增生,为CIN1;2级(中度)不典型增生,为CIN2;3级(重度)不典型增生及原位癌,为CIN3。CIN作为子宫颈鳞状上上以病变相互交流的名称,CIN的概念表明病人子宫颈上皮有异常,但一般不能根据临床症状分级。
CIN与非典型增生、原位癌的替代关系:
LSIL CIN1:轻度不典型增生
HSIL CIN2:中度不典型增生
CIN3:重度不典型增生----原位癌。
1、低度鳞状上皮内病变(LSIL//CIN1)的细胞学改变:
形态描述如下:细胞单个散在或片状排列,细胞边界清楚可见;以中表层细胞为主,胞浆嗜酸性;核增大,比正常中层细胞核至少大3倍;核大小形态中度不一致,双核或多核常见;核膜清晰可见或模糊不清;核深染,染色质均匀;核仁少见或不明显。核周空穴细胞,不典型空穴细胞,细胞改变符合HPV感染,包括在LSIL内。
2、高度鳞状上皮内病变(HSIL//CIN2//CIN3//原位癌):
形态描述如下:细胞大小比LSIL小,常常单个散在或成片或像合胞体样排列;大多胞浆嗜碱性,偶见嗜酸性;核大,核浆比明显增大;见有不规则核轮廓;核深染明显,染色质细颗粒状或块状,但分布均匀;核仁常常不明显。
●鳞状细胞癌:细胞学分型标准介绍如下:
1、非角化型鳞状细胞癌:
形态描述如下:细胞单个散在,或成团,成片或合胞体样排列;细胞大,以大细胞及中间细胞为主,也可见小细胞,偶尔可见到怪异状细胞;胞浆多嗜碱性,也可混有角化型细胞;胞核明显增大,染色质增多粗,颗粒状,分布不均,可出现块状;核浆比明显失比;核轮廓不规则;核仁明显。
2、角化型鳞状细胞癌:
形态描述如下:细胞多为散在或松散排列,也可有片状排列,偶可见到角化珠;癌细胞大小不一,形态多样,怪异状细胞多见;胞浆通常嗜酸性或嗜橘红色,也可混有嗜碱性癌细胞;核大小形态多种多样,染色质呈粗颗粒状,固缩状,块状,分布不均匀;核仁较少见。
3、小细胞型鳞状细胞癌:
形态描述如下:细胞多呈松散的片状排列,很少单个孤立存在;细胞小,呈圆形或卵圆形;胞浆少,通常嗜碱性;胞核大,核浆比明显失比,核深染,有粗颗粒状染色质,核轮廓不规则;核仁不明显。
五、柱状上皮细胞的异常改变:
●没有明确诊断意义的不典型腺上皮细胞(AGCUS)。
1、来源于宫颈管细胞的AGCUS: 形态描述为:细胞常呈片状排列,轻度大小不等;核大,比正常宫颈
管细胞大3-5倍;胞核大小不一致;细胞核轻度深染;核仁常常可见。
2、来源于宫内膜的AGCUS:
形态描述为:细胞常成群或呈团出现,边界不清;细胞核轻度增大,轻度深染;核仁不明显; ●宫颈腺癌:
形态描述为:细胞排列的特征为片状,条索状或假复层状,花团状或放射状结构;胞浆通常嗜碱性,也可嗜酸性;细胞核增大拥挤,染色质呈粗颗粒状;核仁明显或多核仁。
●子宫内膜腺癌:
形态描述为:涂片背景常显示高雌激素影响水平;细胞常成团出现,相互重叠,也可单个散在,松散排列;胞浆少嗜碱,常见空泡;细胞核以分化程度不同,大小相差悬殊;核染色质深,结构不清;核仁不明显。
●子宫外腺癌:
3
子宫外的腺癌细胞,很少出现在阴道细胞涂片上,有时可以见到来自卵巢癌脱落的癌细胞,卵巢癌通常心肝浆液性乳头状囊腺癌多见,其细胞形态与子宫腺癌细胞相似,一般癌细胞呈卵圆形团块或乳头团块出现。胞浆少,可有空泡,胞核多贴边排列,恶性核结构,多伴有清洁,高雌激素影响的涂片背景。
TBS诊断系统要点
TBS报告主要包括三部分内容
? 标本评估 ? 具体描述镜下所见 ?总体诊断
A、标本评估 :1、 满意 2、不满意
满 意 标 准
1、标本有标记,合格的含有详细临床资料的申请单;
2、鳞状上皮细胞量:CP>8000~10000(15/HP) LBP>5000(10/HP)
3、 柱状上皮细胞数量:CP>5/堆×2 或10/堆×1 LBP>10个以上
未见柱状上皮细胞需化生细胞(成熟或不成熟)>10/堆;
及时固定、送检。
注:萎缩细胞不作颈管及化生细胞评估。
B、总 体 诊 断 :
未见上皮内病变/恶性细胞(NILM)
2、其它
3、上皮细胞异常: a. 鳞状上皮异常 b. 腺上皮异常
未见上皮内病变/恶性细胞(NILM)
详细描述: 1、微生物 。2、其它非肿瘤性所见 。 3、反应性细胞改变 。
4、子宫切除后出现腺细胞 。 5、萎缩、管状化生、角化异常
阴道变异菌感染
诊断标准:
1. 线索细胞 >60~70%,PH>4.5 考虑细菌性阴道炎
2. 上皮细胞间(背景)可见大量球杆菌
反应性细胞改变
1、炎症反应性细胞改变
2、萎缩反应性细胞改变(伴或不伴炎症)
3、放疗反应性细胞改变
4、理疗后改变
5、滤泡性宫颈炎
诊断标准:与炎症有关的反应性细胞改变(包括典型的修复)
(1)鳞状细胞核增大,是正常中层细胞核的1-2倍或较多。颈管细胞核增大可以更多
(2)双核或多核可见
(3)核膜光滑、均匀
(4)核淡染或轻微深染,染色质细颗粒状、分布均匀显著的单个或多个核仁可以存在
(5)胞浆可以显示出多彩、空泡或核周晕、甚至核周空洞(无周边胞浆增厚)
相似的改变可以在鳞状化生细胞见到。
与放疗有关的反应性改变
(1)显著增加但核浆比例无增加,畸形细胞可以出现
(2)增大的核可以显示退变(核苍白、皱缩或染色质结构不清、核内空泡)
(3)核大小可以不同,一些细胞群中既可有增大的又可有正常大小的核
(4)双核、多核常见,核染色可以轻度增加
(5)如果同时存在有修复,可以存在显著的单个或多个核仁
(6)可见空泡状或多彩的胞浆
4
与IUD相关的反应性改变
(1)细胞可以单个散在,也可以成团,细胞团常有5-15个细胞
(2)胞浆量不同, 常有大的胞浆空泡使核的位置改变而使细胞呈印戒状表现
(3)有时单个上皮细胞核增大、核浆比例高
(4)核退变常明显, 核仁可以显著
(5)相似于砂粒体的钙化可以不同程度的存在
萎缩(有或无炎症)
(1)主要为外底层细胞,可以单个散在或单层平铺、保持良好的极向
(2)核可以增大到正常中层细胞核的3-5倍、可以 有轻度深染和增长、染色质分布均匀
(3)可以有裸核(由外底层细胞胞浆溶解产生)
(4)可以存在退变的胞浆桔黄或嗜伊红染色、核固缩的外底层细胞和不同形状、大小的组织细胞及有丰富的炎性渗出物及相似于肿瘤样素质的嗜碱性颗粒状背景
(5)外底层细胞或浓缩的粘液也可形成嗜碱性无定形物
角化不良
细胞表现为小多角形或圆形,相似于缩小的表层细胞,可以单个散在或排列成层或成细胞珠。细胞浆常染为桔黄色,也可以是黄色、红色、甚或是兰色,有中位固缩核,有些核也可以较透亮,常与过度角化共存。角化不良出现多形性表现—核和浆的大小和形态不同,称为多形性角化不良或非典型角化不良(ASC)。 过度角化
细胞表现形态相似于表层细胞而无核,核的部位可有一苍白区,胞浆可以染为黄色、橘黄或粉红色。有核的颗粒层细胞也可以出现,相似于正常表层细胞但在胞浆里有小的,黑兰色的透明角质颗粒。 其 它
宫内膜细胞>或=40岁
子宫切除后出现腺上皮细胞
40岁以后如果不在月经增生期或绝经,宫内膜细胞出现可以是良性宫内膜病变、激素改变影响或宫内膜上皮不正常(仅少数病例)。
40岁以下的妇女极少有宫内膜病理表现。
大多数患有宫内膜腺癌的妇女有出血症状,而少数患宫内膜腺癌无症状的妇女,涂片中的宫内膜细胞是仅有的不正常发现。
患宫内膜腺癌的危险因素,如临床症状、月经史、激素治疗和绝经情况对于个体妇女来说还不明确。 上皮细胞不正常
(一) 鳞状上皮细胞不正常
⒈ 非典型鳞状细胞 (Atypical squamous cells,ASC)
⑴非典型鳞状细胞, 意义不明 (Atypical squamous cells of undetermined significance,ASC-US)
⑵非典型鳞状细胞,不除外上皮内高度病变 (Atypical squamous cells,cannot exclude HSIL, ASC-H)
⒉ 鳞状上皮内病变 (Squamous Intraepithelial Lesion,SIL)
⑴鳞状上皮内低度病变 (Low-grade squamous Intraepithelial Lesion,LSIL)
⑵鳞状上皮内高度病变 (High- grade squamous Intraepithelial Lesion,HSIL)
⒊ 鳞状细胞癌 (Squamous cell carcinoma,SCC)
非典型鳞状上皮细胞(ASC)
● ASC-US ● ASC-H
ASC-US主要包括:
1、HPV证据不足又不除外
2、不典型化生
3、不典型修复
4、放疗反应
5
5、角化不良细胞
6、其他刺激后细胞改变
ASC-US诊断注意事项
1、一般认为ASC报告量 < 筛查样本的5% <上皮病变+恶性病变
2、报告后应提出建议并复查
3、ASC是TBS报告最受到争议的一栏,曾被人称为“垃圾桶”
诊断标准:
核增大是正常中层鳞状细胞核的2.5-3(约35um)倍核浆比例轻度增加,轻微的染色质增多、分布不规则或核的形状不规则
有致密桔黄色胞浆的不典型角化不良细胞常见
在液基标本中ASC-US细胞与在常规涂片中相似,但可以较大,较扁平。
ASC-H(2004版TBS报告新提出的概念)
诊断标准:
两种类型:
①不典型不成熟化生型
常单个散在或呈小的细胞碎片(<10个细胞),(在常规涂片这些细胞也可见于粘液湖中), 大小与化生细胞一致,核是正常化生细胞核的1.5-2.5倍,核浆比例接近HSIL,核不正常,如染色增多、染色质不规则和核形状局部不规则不如HSIL明显。
②拥挤细胞片:拥挤的细胞片、核极性紊乱或难以辩认有鳞状分化的特点(多角形的细胞、有致密的胞浆和有 明鲜的线性边缘)。
鳞状上皮内病变 :
● LSIL
● HSIL
● SQCA
低级别鳞状上皮内病变(LSIL)
诊断标准:
细胞单个散在或成片排列,胞界清。不正常改变一般限于中、表层鳞状细胞,有丰富的、成熟的胞浆和明确的胞界。核增大、至少是正常中层细胞核的3倍、大小和形状可以有不同,核浆比例升高, 可有双核或多核。染色质增多、常是粗颗粒状、均匀分布,亦可表现得模糊不清或致密、不透明。核仁一般不存在,如果存在也不明显。核膜常有轻微不规模则,但也可以光滑。胞浆可以有特征性的改变—挖空或是厚的、角化的。对挖空细胞和桔黄色的角化细胞,核必须符合上述改变,有核周空腔而无核改变者不符合低度病变的诊断。
注:
1. LSIL=CINⅠ
2. HPV感染包括在LSIL范围内。
HPV感染后细胞改变(湿疣细胞学)
? 在TBS报告属于LSIL范围
? 形态特点: 核周空穴细胞(“挖空细胞”)
角化不良细胞
湿疣外底层细胞
高级别鳞状上皮内病变(HSIL)
包含内容:
1. CIN Ⅱ-Ⅲ
6
2. 原位鳞状细胞癌
3. 不除外早期浸润癌
诊断标准:
细胞单个散在或成片或合体状排列,深染的细胞团应该仔细评价。不正常的细胞较低度病变细胞小而不成熟。细胞大小不同,可以从相似于低度病变大小的细胞到十分小的基底型细胞。核增大程度与低度病变相同或较小,但胞浆面积下降,核浆比例显箸上升。染色质明显增多、颗粒或细或粗、均匀分布。 核膜十分不规则,呈锯齿状或有裂隙。 一般无核仁,当高度病变累及颈管腺体时可见核仁。 胞浆可以不成熟,花边状或脆弱的或致密化生的,也可以是成熟和致密角化的。
原位癌与浸润癌细胞病理学鉴别
? 大而明显的核仁;
? 副染色质区透亮,染色质贴边,核膜增厚;
? 肿瘤样坏死背景。
鳞状细胞癌
? 角化型
? 非角化型
诊断标准:
腺上皮异常
AGC (宫颈、宫内膜、腺细胞)
AGC-N (倾向病变)
AIS
ADCA
非典型颈管细胞:细胞呈片状或条索状排列,有些拥挤、核重叠。核增大到正常颈管细胞核的3-5倍、大小和形状有一些不同,核浆比例增加,染色质轻度增多。核仁可以存在,核分裂像少见。胞浆丰富,胞界常可辩认。
非典型宫内膜细胞 细胞呈小群出现,每群常5-10个,核较正常宫内膜细胞增大。染色质轻度增多,可以有小核仁。胞浆少,有时有空泡,胞界不清。
腺原位癌(AIS)
诊断标准:细胞排列呈片状、团块状、条索状和玫瑰花样,核拥挤、重叠失去蜂窝状排列。单个不正常细胞不常见。一些细胞有明确的柱状表现,细胞团有栅栏状的核排列,有细胞核和胞浆尾从细胞团周围突出,呈现羽毛状的边缘。核增大,大小不一,卵圆形或增长、成层,核浆比例增加 。核染色质增多、均匀分布,有特征的粗颗粒状染色质。核仁常小或不明显,核分裂像和凋亡体常见。 胞浆量和细胞内粘液减少。涂片背景无肿瘤素质, 如果同时存在鳞状病变,不正常的鳞状细胞可以存在。
注:1. 相关探讨文章多,现为热点问题;
2. 争议多,难度大。
腺 癌
ü 宫颈腺癌
ü 宫内膜腺癌
诊断标准:
注:1. 两者鉴别困难;
2. 含腺鳞癌或腺癌鳞化。
妇科医生取样指南
1、取材尽可能避开经期,取材前24小时不上药,不冲洗、不过性生活。
2、分泌物较多时,可在取材前用棉签轻轻粘去,不可用力擦。
3、取材应在直接观察下进行,保证宫颈刷对所取部位有一定的压力,
宫颈刷的尖端放入颈管的外口,以取得足够的细胞成分。
7
4、取样过程中宫颈出血明显时,应立即停止。
5、在一般情况下尽量避免短期内(小于三小时)重复取材,以免出现 假阴性结果。
6、申请单填写应尽量完全,字迹工整,尽可能提供相关的临床信息。
宫颈CIN发生的危险因素
有多个性伴侣的妇女或其男性伴侣有多个性伴侣。
初次性交年龄低的妇女。
其男性性伴有其他患宫颈癌的性伴。
曾患有HPV感染或尖锐湿疣的妇女。
曾患有HSV感染的妇女。
HIV感染的妇女。
有性传播疾病的妇女。
有免疫过度的妇女(如器官移植后)
吸烟及过度饮酒的妇女。
有宫颈CIN或患有宫颈、子宫内膜、阴道或外阴癌的妇女。 经济状况低下的妇女。
液基细胞学检查后的临床处理原则
NILM
非高危人群——1-2年复查
强烈要求者或高危人群——加测HC2
阴性 ——1-2年复查
阳性—— 相应治疗后一年复查
ASC
4-6月后复查,阴性者正常追随
HC2检测,阴性者同上,阳性者行Col检查并活检
ASC—H建议即行Col检查并相应处理
LSIL
Col+Bio
HC2检测
Leep不常规用于LSIL
HSIL
Col+Bio确认后做相应处理
Bio后若仅为CINI4-6月复查
Bio确认为HSIL则行宫颈锥切
AGCUS
包括AGC和AIS
建议Col+Bio
年龄大于35周岁并有不明原因阴道出血应行诊断性刮宫 HC2检测一般认为意义不大
值得商讨的情况
LSIL或CINII是否行宫颈锥切
以LEEP取代多点活检
多点活检取代诊断性锥切(尚未生育且可见移形带)
几种不恰当的处理
8
宫颈菜花样或溃疡样改变行液基细胞学检查
诊断性LEEP应用于CIN病理的ASCUS中
TBS描述(+)活检(-)放弃追随
TBS结果(+)而未经阴道镜检即手术
已做宫颈细胞学检查后未间隔一月重复检查
子宫颈细胞病理学TBS报告系统培训教材(余小蒙)
首都医科大学附属北京友谊医院病理科 余小蒙
1子宫颈正常组织学及细胞学
1.1子宫颈正常组织学
1.鳞状上皮
子宫颈突入**,其上部分称宫颈**上部,其下部分称宫颈**部,中央为子宫颈外口。宫颈**部被覆非角化复层鳞状上皮,正常情况下基底细胞层平直无钉突。在生殖年龄雌激素促进上皮细胞成熟,孕激素抑制细胞成熟。鳞状上皮从底层至表层分为5个层次:
(1)基底细胞层 紧密贴附在基底膜上的一层低柱状细胞,细胞较小,胞浆较少,嗜碱性,核圆形,较
深染,核浆比高。正常情况下不脱落。
(2)基底旁细胞层 由2~3层多边形细胞构成,有细胞间桥,胞浆较宽,嗜碱性,核圆形,其面积较基
底细胞小,核浆比为1:2。滤泡期ER阳性而PR阴性,在黄体期PR阳性而ER阴性。
(3)中间细胞层 又称浅棘细胞层,约有5层细胞,胞浆丰富,呈多边形,该细胞上面两层细胞变扁,
细胞间有明显间桥。胞浆内有较多糖原和空泡而淡染。细胞核比基底旁细胞核稍小,呈圆形。
(4)致密细胞层 又称上皮内层,细胞呈多边层或舟形,胞浆内红染角质颗粒核小,圆形,深染。无细
胞间桥。妊娠期该层细胞浆糖原过丰富而透明,胞膜厚,称为妊娠细胞。
(5)浅表细胞层 宫颈上皮最表面一层细胞呈长扁形,平行于基底细胞层,胞浆丰富,嗜酸性,含丰富
的角质蛋白,在雌激素水平高时,嗜酸性更明显。核固缩状,深染,圆形而小。
2.柱状上皮
子宫颈管黏膜被覆柱状上皮,呈高柱状,单层排列,其基底部附着在基底膜上。细胞核圆形或卵圆形,位于细胞的下1/3部。在妊娠和排卵后分泌旺盛时细胞核可在细胞中部或基底部。柱状上皮包括分泌细胞(粘液细胞)和纤毛细胞两种。分泌细胞顶部呈圆顶状突起,表面有很短的微绒毛,胞浆淡染,有时内含粘液空泡,将核推压成新月形,位于细胞基底部。多数细胞核呈圆形或卵圆形,染色质均匀细颗粒状,常见小核仁;纤毛细胞表面有动纤毛,和微绒毛相间,细胞浆较浓染,嗜碱性。细胞核圆形或卵圆形,位于细胞的下部,染色质均匀细颗粒状,常见小核仁。宫颈管柱状上皮中纤毛细胞多于分泌细胞,特别是在颈管上部接近子宫内膜处子宫颈**部可发生真性糜烂。当宫颈**部有腺性糜烂时,采取的宫颈细胞涂片中可见多量柱状上皮。
3.储备细胞
柱状上皮与基底膜之间有不连续的一层细胞,称为储备细胞,是一种幼稚上皮细胞,在正常情况下是分化成熟为柱状上皮,补充死亡脱落的柱状上皮。在某种刺激下储备细胞增生成为一层连续的细胞,甚至达几层,细胞立方形,大小一致,核圆而大,有较明显的核仁,胞浆少。
4.化生的鳞状上皮
子宫颈鳞柱上皮交界处(移行带)在月经开始后的妇女柱状上皮常化生为鳞状上皮。关于化生鳞状上皮起源有不同的学说:免疫组化角蛋白的研究发现储备细胞既有柱状上皮型蛋白,又有非角化鳞状上皮蛋白的表达,表明储备细胞有多方向分化的潜能,多数作者认为化生的鳞状上皮来源储备细胞。储备细胞可增殖成多层,在成熟中胞浆增多显示出鳞状上皮分化,柱状上皮仍保留在表面,最终脱落。在化生阶段细胞呈圆形或椭圆形,胞浆嗜碱性,细胞核形状和大小与基底旁层细胞的核相同,核浆比为1:2,核仁小, 9
可有可无。细胞间不见间桥。完全成熟的化生鳞状上皮与**部正常鳞状上皮无区别。
1.2子宫颈正常细胞学
1.鳞状上皮细胞(图1)
(1)基底层(内底层)细胞 正常不脱落,在宫颈涂片中通常不见,只有在绝经后上皮明显萎缩、创伤、
增生时才在涂片中见到。细胞圆形或椭圆形,胞浆少,嗜碱性,核浆比高。
(2)基底旁层(外底层)细胞 涂片中常成群出现,胞浆厚,嗜碱性,核圆形或椭圆形,核浆比为1:2~3。
(3)中层细胞 胞浆薄而透明,多边形且边缘皱褶,核圆形,中央位置,核浆比为1:3~5。
(4)致密层细胞(或称角化‘前细胞’)细胞大,胞浆宽广,多边形。胞浆浅蓝色,常见卷边或褶皱,
核中等大,染色质疏松,核浆比约为1:5-10。
(5)浅表层细胞(或称角化细胞)细胞大,多边形,胞浆红染,常见卷边或褶皱,核小,染色质致密固
缩状,有时核周见小的空晕。完全角化细胞核一般消失,胞浆红染或橘黄色。
2.柱状上皮细胞
(1)粘液细胞(分泌细胞) 细胞侧面观呈高柱状,顶部可隆起,核在细胞的一端(基底部),核圆形或新月形,染色质比鳞状细胞纤细、均匀、淡染。极面观呈圆形,核在中央。在涂片中,特别是在液基细胞学涂片中常成团出现,细胞重叠,周边部见排列整齐。上下调整显微镜的焦点可见清晰的细胞浆边界和均匀平淡的细胞质染色。此种细胞不应与异型增生的柱状上皮、肿瘤细胞团块相混淆,后者显示细胞更拥挤,增大,核膜不规则和染色质异常[2]。此种细胞功能是分泌粘液,排卵期孕激素水平高,粘液分泌旺盛,细胞浆更透明。(图-2)
(2)纤毛细胞 呈“倒锥”状,细胞游离缘宽,可见纤毛,在液基涂片中更清晰,直或弯曲细长部分是细胞的基底部。胞浆呈蓝色,较深,细胞边界较清楚。核的结构、大小与分泌型宫颈内膜细胞相同,但不会呈新月形,此型细胞在涂片中常成群出现。子宫颈上皮细胞团也可平铺状,呈蜂窝状结构,侧面观呈栅栏状结构。(图1、3)
(3)储备细胞 涂片中储备细胞体积比基底旁层细胞小。细胞核相对较大,胞浆窄,淡蓝色,核浆比例大于1:1。细胞核圆形,染色质细颗粒状均匀分布,核仁较明显。部分细胞浆内见黏液空泡。单个或成群出现。(图4)
3.子宫内膜细胞
(1)上皮细胞,在正常情况下,月经期、月经即将来潮和月经刚净时可见子宫内膜上皮细胞。在流产后、产后、宫内节育器、用避孕药引起子宫出血时,刮取子宫内膜术后的近期,急性子宫内膜炎,子宫黏膜下肌瘤,子宫内膜息肉,子宫功能性出血,子宫内膜增殖症及子宫内膜癌时在细胞学涂片中都可出现子宫内膜上皮细胞。细胞较小,胞浆宽,嗜碱性,偶有空泡。细胞常呈重叠小团状,常呈三维结构,也可呈平铺状。核圆形,大小一致,核膜清楚,染色质细颗粒状,其面积相似于正常**部中间层鳞状细胞的核。(图5~7)
(2)间质细胞为卵圆形,胞浆少;核小、卵圆形,染色稍淡。涂片中偶见呈双轮廓形式的细胞团,即腺上皮细胞围绕着一个深色的间质细胞团。(图7)
4.化生鳞状细胞
子宫颈管内膜腔面和腺体柱状上皮常发生鳞状上皮化生,机能分化反映在胞浆变宽,多边形。在涂片上,不成熟性化生细胞的胞浆嗜碱性,淡染、花边状、边界清楚、胞浆内可见小空泡,核圆形,染色质均匀细颗粒状,核仁较明显,核浆比稍高于成熟细胞(图8)。成熟性化生细胞的胞浆有“蜘蛛样”突起,胞浆常较致密,嗜碱性,偶尔表现嗜双色性(图9)。化生鳞状细胞常呈片状出现,也可单个散在,后者与中层鳞状细胞不易区别。
5.修复细胞
子宫颈**部鳞状上皮或移行区柱状上皮在炎症、接触性损伤,甚至在刮取(刷取)宫颈细胞学检查后不久在活检组织片中常见鳞状上皮修复现象,即局部鳞状上皮或柱状上皮完全脱失,由其旁的正常的鳞状上皮基底层细胞增生覆盖于上皮缺乏处,细胞层次仅2~3层,这个过程称为上皮修复。宫颈细胞学涂片上常见修复细胞,其特征是细胞呈平铺单层,胞浆较丰富,嗜碱性,边界清楚,细胞核椭圆形或圆形,染色质均匀细颗粒状,核仁明显,核呈水流状极向排列;修复细胞也可呈圆形团簇状,无明显水流状排列,细胞团团内甚或细胞浆内见多形核白细胞,后种情况与不成熟化生鳞状细胞、深部中间层鳞状细胞不易区别。 10
(图10、11)
6.蜕膜细胞
在妊娠期子宫颈间质细胞可蜕膜变,当子宫颈上皮脱落形成糜烂时,在子宫颈涂片中可见蜕膜细胞,单个或小簇出现。细胞呈多边形,边界清楚,胞浆丰富、淡染,核圆形中央位置,大小相当于多形核白细胞的2~3倍,染色质淡染,可见1个或多个小核仁。蜕膜细胞可能被误认为低级别鳞状上皮内病变,后者一般没有核仁是鉴别的重点。
7.滋养层细胞
在妊娠前3个月或末3个月,以及流产后和产后在子宫颈细胞学涂片中可出现合体滋养层细胞或细胞滋养层细胞。合体滋养层细胞形态和大小多变,细胞平均大小为500μm,胞浆丰富致密,嗜酸性,含多个大小一致互相重叠的核,核染色质呈细颗粒状或致密,核仁罕见。
细胞滋养层细胞呈圆形,边界清楚,胞浆淡染。核深染,多不规则。上述两种细胞确认时一定要结合相关病史,否则不易确认,特别是细胞滋养层细胞缺乏特征,难以确认。虽然如此,滋养层细胞通常无异形型性,也不会将其误认为低级别以上鳞状细胞。
8.性激素对宫颈细胞的影响
**部宫颈和**复层鳞状上皮在雌激素影响下在脱落前成熟到中层和浅表层;黄体酮对鳞状上皮的影响只限于中层细胞。在生育期,卵泡期涂片中以浅表层细胞占优势,胞浆红染、细胞边缘褶皱;而在黄体期中层细胞即胞浆蓝染细胞占优势,在妊娠期、产后期或哺乳期,涂片上一般以中层鳞状细胞和基底层细胞为主。在儿童期和绝经期后,因为雌激素水平低会导致宫颈鳞状上皮不发育或萎缩。绝经期后妇女有黄体酮的存在鳞状上皮可成熟到中层细胞,称为雌二醇萎缩,当雌激素和黄体酮均不足时,上皮萎缩而变薄,鳞状上皮仅发育到基底旁层,此种情况为终末萎缩,黏膜干燥,易患老年性**炎。萎缩细胞改变:组织学上**/宫颈鳞状上皮薄,仅覆盖基底细胞和少数几层基底旁层细胞。涂片上仅见基底旁细胞,背景为蓝染的上皮细胞碎片和炎性细胞碎片,鳞状上皮显示不同程度的非典型性,核常增大。染色质淡且模糊不清、多形性,酷似上皮内和浸润病变,会使诊断困难。此种情况应报告为未明确意义的不典型鳞状细胞,建议给予短期非肠道的雌激素治疗可使鳞状上皮成熟,再复查涂片,涂片变干净,细胞非典型性消失。如果非典型性鳞状上皮内病变或癌所致,则细胞非典型性会更明显。此时报告中指出在萎缩性涂片中见异常鳞状细胞,并列出鉴别诊断的线索甚至建议及时行活体组织检查。
9.子宫颈细胞学涂片中非上皮性细胞和分泌物
在子宫颈细胞学涂片中常见非上皮性细胞成分,主要有血源性细胞:
(1)红细胞:月经期,月经来潮前或刚干净,刮(刷)片创伤,在涂片中可见红细胞。如在近半数视野中见较多红细胞,甚至红细胞掩盖鳞状细胞,如果鳞状上皮量不足10%则为标本不满意,虽然鳞状细胞量超过10%,则标本满意,但受血涂片限制。
(2)多形核白细胞:部分细胞边界清楚,但常发生胞浆溶解。涂片中多形核白细胞的多少与月经周期时间及有无宫颈(**)炎有关。排卵期涂片中多形核白细胞较少。不能单凭涂片中多形核白细胞而诊断炎症,还需根据上皮细胞有无炎性改变,多形核白细胞与上皮细胞的关系(贴附在上皮细胞膜上甚至进入上皮细胞胞浆中)以及多形核白细胞有无变性、坏死等表现来判断。通常是以涂片中多形核白细胞的量的多少如<50%,>50%<75%和>75%来判断炎症的轻、中和重度。这首先取决于采取细胞的方法是否规范和正确,如果宫颈附着较多炎性分泌物,首先应用棉球擦除分泌物再采取细胞,否则涂片上的炎性渗出过多,鳞状细胞过少,标本是不满意的,判断炎症程度也是不准确的。
(3)淋巴细胞:细胞小,胞浆窄,核相对较大。在慢性宫颈(**)炎涂片中淋巴细胞较多。但滤泡性宫颈炎涂片中见多量淋巴细胞,由于部分淋巴细胞是来自淋巴滤泡生发中心,细胞核较大,核仁明显,局部细胞较单一。此种情况不仅要考虑滤泡性宫颈炎,也应考虑恶性淋巴瘤的可能,虽然宫颈淋巴瘤罕见,但我们在一年内曾见过两例宫颈黏膜相关淋巴瘤。当涂片中见大量淋巴细胞,细胞较单一,核仁明显,在报告中一定要指出特征,提示临床医生结合临床情况进一步明确诊断,以防漏诊。
(4)浆细胞:多见于慢性子宫颈(**)炎涂片,细胞呈椭圆形,核呈偏位状。
(5)吞噬细胞:在子宫颈涂片特别是宫颈(**)炎患者,涂片中吞噬细胞常见。小噬细胞:核圆形或卵圆形,比多形核细胞稍大,核圆形、卵圆性或肾形,核较深染,核膜清楚。胞浆呈灰蓝色,胞膜不清楚,胞浆呈泡沫状。此种细胞易被误认为宫颈管柱状上皮或中间层鳞状细胞。,后两者胞浆通常不呈泡沫状, 11
包膜清楚。巨噬细胞:细胞体积大,胞浆丰富,细胞膜不清楚,胞浆粉红色或蓝染,或染色不定,胞浆内常见空泡或见吞噬的核碎片。涂片中也可见到多核异物巨细胞,细胞大,胞浆丰富,多个细胞核,甚至多达几十个核,分布在细胞中央。
(6)非致病菌:**杆菌(乳酸杆菌)是**中正常菌群,为非致病菌。此种杆菌有分解上皮细胞胞浆内糖原产生乳酸的功能,使**保持酸性环境。光镜下为短棒状,其产生的酶能破坏中层鳞状细胞胞浆,使其成为裸核状态(图12)。纤毛菌是一种有纤毛的霉菌样微生物。光镜下似头发样,无孢子(图13);通常不致病,但可与滴虫并存。
(7)精子:采取子宫颈细胞学标本前如有性交,涂片中可见精子。精子分头、颈、尾三部分,呈蝌蚪状,染成蓝色,易辨认。变性的精子头部肿胀,尾部溶解,可被看作细胞核碎片或霉菌孢子。
1.3子宫颈细胞学取样、涂片制作及观察方法
子宫颈细胞学检查主要目的是检查发现有无异常增生细胞,主要是鳞状细胞,也包括异常增生腺上皮(子宫颈管腺上皮和子宫内膜腺上皮),还包括累及宫颈、**的肛门、直肠、下泌尿道、卵巢和输卵管等的恶性肿瘤细胞。能否达到预期目的,主要取决于标本采取的合理性,涂片制备的优良性和遵循可靠的细胞学诊断标准。
1.标本取样方法:一些宫颈炎患者,宫颈**部常附着多量炎性分泌物,采取标本前应用棉球将分泌物擦除,否则采取到的标本中炎性渗出物过多,在涂片上遮盖上皮细胞;刮(或刷)取标本时用力适当,用力过大会引起出血,在涂片上血细胞会遮盖上皮细胞;采样器的一部分一定要深入宫颈管,确保标本中含有宫颈管细胞成分,因各种原因引起的上皮异常增生首先起源于鳞、柱状上皮交界处的移行区。
2.涂片制作方法:力求涂片中有足够的鳞状细胞,涂片太厚细胞重叠影响观察,太薄时上皮细胞量可能不足。传统宫颈细胞涂片要及时固定,要用巴氏染色法染色:宫颈细胞涂片要干湿状态下及时固定于95%乙醇中,固定15~20分钟,如果固定不及时,空气干燥,虽然再固定,细胞不能收缩,细胞核大,而且染色不清晰。以往一些著作称为细胞退变,不及时固定,短时间内细胞可能有退变的因素,但可能性不大;空气干燥本身就是一种细胞固定方法,并适合于MGG染色法染色;但空气干燥后的涂片不适合于巴氏染色;空气干燥造成细胞形态的变化是人工现象。TBS系统要求宫颈涂片必须使用巴氏染色法染色。有许多单位的涂片染色质量差,妨碍了镜下观察。严格配置试剂和操作步骤,力求涂片染色好是十分必要的。
3.子宫颈细胞涂片的显微镜观察方法:阅片时先用10?10倍视野上下移动涂片,由左至右循序渐进的观察,视野之间的相邻接区域要稍重叠,避免漏看。对于需要重点辨认的结构一般采用10?40高倍视野仔细观察,根据观察所见,做出判读结论。
4.及时将标本质量的信息反馈给临床医生/取样人员,能促使他们提高对标本采集的关注,考虑改进取样器械及技术,确保标本质量,为细胞学医生做出准确的判读,防止错误的结论具有重要意义。 2子宫颈细胞学TBS报告系统
子宫颈细胞学涂片检查由著名细胞学家George Papnicolaou(巴氏)创立于20世纪40年代初。半个多世纪以来,此项检查在子宫颈癌的筛查中发挥了巨大的作用。发展至今,全世界每年都会有数以万计的子宫颈癌病人得到较早确诊,治愈率明显上升,死亡率也显著降低。巴氏五级报告方式即:Ⅰ级,未见异型性细胞或不正常细胞。Ⅱ级,细胞有异型性但无恶性特征。Ⅲ级,怀疑恶性但证据不足。Ⅳ级,高度提示恶性但证据不足。V级,肯定恶性(癌)。受到历史条件的限制,巴氏五级报告方式只是针对癌的筛查,而对子宫颈癌的前驱病变或癌前病变还知之甚少,不可能提出反映子宫颈病变本质的明确分类及合适的处理建议。近20年来,随着临床医学、组织病理学及细胞病理学的发展,人们对子宫颈疾病认识的不断提高,使传统的巴氏五级报告方式已经逐渐显示出其应用中的缺陷:(1)不能直接反映子宫颈疾病细胞学改变的本质,尤其是对宫颈癌的前驱病变或癌前病变的细胞病理学改变。(2)其报告分类、术语与组织病理学术语不一致。(3)不能满足临床医生对病人进一步检查和处理的需要。
19xx年美国癌症研究所组织50余位来自不同国家(地区)的病理学、细胞学及妇女保健医学专家会集Bethesda城,充分肯定了巴氏子宫颈细胞学涂片检查的重要意义,讨论了巴氏五级报告方式存在的不足,提出了新的子宫颈细胞病理学报告方式:“The Bethesda System for reporting cervical cytology简称子宫颈“TBS”报告系统。其内容涉及标本质量评估、微生物感染、反应性细胞改变、非典型鳞状上皮细胞、鳞状上皮内病变、鳞状细胞癌、非典型腺上皮细胞、腺癌及其它恶性肿瘤等诸多方面。在近10几年应用中,“TBS” 报告方式已经过两次重要修订,逐步得到完善,并已在世界范围内推广应用。 12
-
子宫颈细胞学TBS报告方式
子宫颈细胞学TBS报告方式子宫颈细胞学检查的意义宫颈癌是常见的妇科恶性肿瘤之一发病率居全球女性恶性肿瘤第二位每年约有50万宫颈癌新…
-
宫颈细胞学TBS报告系统鳞状上皮部分解读及临床处理
宫颈细胞学TBS报告系统鳞状上皮部分解读及临床处理曹彤孙其兰李广友平阴县中医医院病理科山东平阴250400近年来随着液基细胞学技术…
-
TBS报告结果中文版
有非典型细胞请三至六个月复诊有少量非典型细胞请三至六个月复诊炎性抹片中有非典型细胞请在发炎减退后复取抹片有非典型细胞类似湿疣病变请…
-
TBS报告方式说明
TBS报告方式说明一怎么样才算真正符合TBS报告方式的液基制片技术19xx年7月全国宫颈癌防治研究协作会议制订关于细胞学涂片诊断标…
-
TBS报告详细内容
市医院检验科液基薄层细胞学诊断报告书细胞列号收到标本日期姓名年龄门诊住院号病房号送验医院科室送验医生标本类型液基方法读片方式高清晰…