氧化还原反应与配位平衡实验报告
氧化还原反应与配位平衡实验报告
姓名: 学号: 班级:

实验一:氧化还原反应
一、实验目的
学会装配原电池。掌握电极的本性,电对的氧化型或还原型物质的浓度、介质的酸度等因素对电极电势、氧化还原反应的方向、产物、速率的影响。通过实验了解化学电池电动势。
二、实验原理
推动氧化还原反应发生的推动力是氧化还原电对形成的电动势E,E可由正负极的电极电势求出:
E =  -
- 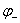
 和
和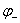 分别为正负极电对的电极电势。若E > 0,那么氧化还原反应能够发生;反之不能发生。利用这一原理可将氧化还原反应设计为原电池。
分别为正负极电对的电极电势。若E > 0,那么氧化还原反应能够发生;反之不能发生。利用这一原理可将氧化还原反应设计为原电池。
在常温下的能斯特方程为:
 =
= 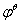 +
+ 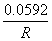 lg
lg
其中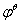 是该电对的标准电极电势,R为常数。当氧化型物质的浓度降低(如生成沉淀或形成配合物)时,会导致电极电势降低;反之,当还原性物质的浓度降低时,电极电势会升高。
是该电对的标准电极电势,R为常数。当氧化型物质的浓度降低(如生成沉淀或形成配合物)时,会导致电极电势降低;反之,当还原性物质的浓度降低时,电极电势会升高。
有时,一个半反应中的氧化型物质不只一个,若增加另一种物质的浓度,也会使电对的电极电势升高。
三、实验用品
仪器:试管若干、烧杯两个、盐桥、伏特表、胶头滴管、表面皿。
药品:浓盐酸、2mol/L硝酸、6mol/L醋酸、1mol/L硫酸、6mol/L氢氧化钠、浓氨水、1mol/L硫酸锌、0.01、1mol/L硫酸铜、0.1mol/L碘化钾、溴化钾、三氯化铁、硫酸铁、碘酸钾、溴水、碘水、1mol/L硫酸亚铁、3%过氧化氢、饱和氯水、饱和氯化钾、四氯化碳、酚酞指示剂、0.4%淀粉溶液。
四、实验内容
1. 取0.5mL 0.1mol/L碘化钾于试管中,滴入2~3滴三氯化铁溶液,再注入0.5mL四氯化碳,振荡,静置,观察现象。
现象: 。
2. 用0.1mol/L溴化钾代替碘化钾进行同样实验,观察现象。
现象为: 。
3. 向两支试管中分别加入3滴碘水、溴水,然后加入约0.5mL 0.1mol/L硫酸亚铁,摇匀后注入0.5mL四氯化碳,振荡。
现象为: 。
4. 结论:Br2/Br-、I2/I-、Fe3+/Fe2+三个电对的电极电势大小为:
。
5. 往一只小烧杯中加入30mL 1mol/L硫酸锌并插入锌片;往另一只小烧杯中加入同体积同浓度的硫酸铜溶液并插入铜片。用盐桥将两烧杯相连,接入伏特表,读数为( )V。若将硫酸铜溶液换为硫酸四氨合铜溶液,读数为( )V。若将硫酸锌溶液换为硫酸四氨合锌溶液,读数为( )V。
6. 设计如下浓差电池,并测出其电动势:
Cu︳CuSO4(0.01mol/L)‖CuSO4(1mol/L)︳Cu
测得电动势为( )V。在浓差电池两极各连一个回形针,然后在表面皿上放一小块滤纸,滴加1mol/L硫酸钠,使滤纸完全湿润,再加入两滴酚酞,将回形针压在滤纸上。
现象: 。
7. 在三支均盛有0.5mL 1mol/L亚硫酸钠的试管中分别滴加0.5mL 1mol/L硫酸、蒸馏水与6mol/L氢氧化钠,摇匀后再各滴加2滴0.01mol/L高锰酸钾。
现象:
反应方程式为

8. 在试管中加入0.5mL 0.1mol/L碘化钾和两滴0.1mol/L碘酸钾,再加几滴淀粉溶液,摇匀后溶液颜色有无变化?( )然后滴加2~3滴1mol/L硫酸,溶液颜色有无变化?( )最后滴加2~3滴6mol/L氢氧化钠使溶液呈碱性,溶液颜色有无变化?
( )
反应方程式为

9. 往盛有水、四氯化碳和0.1mol/L硫酸铁各0.5mL的试管中加入0.5mL 0.1mol/L碘化钾溶液,振荡后观察四氯化碳层溶液的颜色。颜色为 。
10. 往盛有四氯化碳、1mol/L硫酸亚铁和0.1mol/L硫酸铁各0.5mL的试管中加入0.5mL 0.1mol/L碘化钾溶液,振荡后观察四氯化碳层溶液的颜色,与上一个实验中四氯化碳层颜色有何不同?( )
11. 在实验9的试管中加入少许氟化铵固体,振荡,四氯化碳层的颜色变化为( )
12. 在两支各盛有0.5mL 0.1mol/L溴化钾的试管中分别加入0.5mL 1mol/L硫酸和6mol/L醋酸,然后各加入两滴0.01mol/L高锰酸钾,颜色褪去速度为( )。
13. 在试管中加入0.5mL 0.1mol/L碘化钾和2~3滴1mol/L硫酸,再加入1~2滴3%过氧化氢,溶液颜色变化为( )。
14. 在试管中加入2滴0.01mol/L高锰酸钾,再加入3滴1mol/L硫酸,摇匀后滴加2滴3%过氧化氢,溶液颜色变化为( )。
实验二:配位平衡
一、实验目的
比较配合物与简单化合物和复盐的区别。了解配位平衡与沉淀反应、氧化还原反应、溶液酸碱性的关系。了解螯合物的形成条件。
二、实验用品
仪器:试管、点滴板、滴管。
药品:1mol/L硫酸、硫酸铜、氯化钡、2mol/L氢氧化钠、2mol/L氨水、0.1mol/L硫化钠、硝酸铁、硝酸银、溴化钾、碘化钾、硫氰化铵、硫代硫酸钠、铁氰化钾、硫酸铁铵、EDTA(乙二胺四乙酸)、0.25%邻菲罗啉、1%二乙酰二肟、无水酒精、四氯化碳。
三、实验内容
1. 取1mL 1mol/L硫酸铜,逐滴加入2mol/L氨水,产生沉淀后继续滴加氨水,直至形成深蓝色溶液。将溶液分为三份,在一、二份中分别滴加少量氢氧化钠和氯化钡,观察到的现象为: 。在第三份中加入1mL无水酒精,现象为: 。
2.  取1mL 0.1mol/L硝酸铁于试管中,滴加2滴0.1mol/L硫氰化铵,溶液颜色为( )。然后滴加2mol/L氟化铵溶液直至溶液变为无色,再滴加饱和草酸铵溶液至溶液变为黄绿色。反应方程式为:
取1mL 0.1mol/L硝酸铁于试管中,滴加2滴0.1mol/L硫氰化铵,溶液颜色为( )。然后滴加2mol/L氟化铵溶液直至溶液变为无色,再滴加饱和草酸铵溶液至溶液变为黄绿色。反应方程式为:
3.  在试管中注入0.5mL 0.1mol/L硝酸银,滴入0.1mol/L溴化钾,再注入2mL 0.1mol/L硫代硫酸钠后再向试管中滴加0.1mol/L碘化钾,最后向试管中滴加0.1mol/L硫化钠。现象为: 。有关的反应方程式为:
在试管中注入0.5mL 0.1mol/L硝酸银,滴入0.1mol/L溴化钾,再注入2mL 0.1mol/L硫代硫酸钠后再向试管中滴加0.1mol/L碘化钾,最后向试管中滴加0.1mol/L硫化钠。现象为: 。有关的反应方程式为:
4. 取两支试管各加入0.5mL 0.1mol/L硝酸铁,然后想一支试管中加入同体积的饱和草酸铵,另一支试管加入同体积的蒸馏水,再向两支试管中各加入同体积0.1mol/L碘化钾和1mL四氯化碳,振荡。两支试管四氯化碳层的颜色分别为: 。
5. 在硫酸四氨合铜溶液中逐滴加入稀硫酸,现象: 。
6. 取0.5mL六硝基合钴酸钠,逐滴加入6mol/L氢氧化钠,振荡,有何现象?
7. 分别在10滴硫氰酸铁和10滴硫酸四氨合铜中加入0.1mol/L EDTA,各产生什么现象?
8. 在点滴板上滴一滴0.1mol/L硫酸亚铁和2~3滴0.25%邻菲罗啉,现象为:
9. 在点滴板上滴一滴0.2mol/L硫酸镍、一滴0.1mol/L氨水和一滴1%二乙酰二肟,现象为:
第二篇:中分实验报告
铜合金中铜锌铅含量的测定
陈博
1200061702 北京大学化学与分子工程学院
1.引言
本实验利用碘量法测定铜的含量,并最终测得铜的含量,。用EDTA络合法测定锌的含量,在使用模拟液验证时候得出较好的结果,但测合金的时候出现较大的误差,证明实验原理没有问题。通过失败的EDTA络合滴定铅离子的和成功的EDTA滴定锌离子的比较中,发现沉淀的多少对于指示剂颜色变化观察有很大的影响。通过失败的重铬酸钾反滴定铅离子得出硫酸铅Ksp小于铬酸铅的结论。
2.实验原理
1,在铜的测定中,本实验利用了碘量法
先用KIO3标定配好的Na2S2O3,发生的反应:
IO3-+8I-+6H+=3I3-+3H20
Cu2+被I-还原成为等量I3-
2 Cu2++5 I-=2CuI+ I3-
生成的I3-用Na2S2O3标液滴定
2S2O32-+ I3-=S4O62-+3 I-
使用淀粉作指示剂
使用NH4HF2控制溶液pH,接近终点是加入KSCN可以使CuI转化成为溶解度更小的CuSCN使终点变色明显。
由于碘量法测定铜的含量时,其他金属离子不会发生氧化还原反应,即不会影响到铜的测定,所以无需掩蔽。
2,在锌的测定中,本实验利用了EDTA络合滴定
本实验中,合金中的铜,铅,铝都可以和EDTA络合,所以需要掩蔽到合金中的其他金属。
本实验用沉淀掩蔽法掩蔽铅,微酸性条件下,加入适量氯化钡和硫酸钾,当钡离子的量超过铅离子量十倍时,铅离子就会深入硫酸钡晶格中去,形成铅钡混晶沉淀,可以有效的掩蔽铅离子
利用氧化还原配位掩蔽法掩蔽铜:在一定酸度下Cu2+被硫脲还原成Cu+
8Cu2++CS(NH2)2+5H2O=8Cu++CO(NH2)2+SO42-+10H+
Cu+再与硫脲形成配合物而被掩蔽。
利用配位掩蔽法掩蔽铝,使用NH4F使铝形成氟的配合物
使用二甲酚橙作为指示剂。
3,在铅的测定中,本实验利用的重铬酸钾反滴定
在合金溶液中加入过量的重铬酸钾,使铅离子沉淀下来,再使用硫酸亚铁铵滴定剩余的重铬酸钾,使用二苯胺磺酸钠作为指示剂。
3.仪器及试剂
仪器:100ml小烧杯,玻璃棒,表面皿,称量瓶,万分之一分析天平,电热板,洗瓶,滴管250ml容量瓶,100ml容量瓶,25ml移液管,10ml移液管,酸碱滴定管,1000ml试剂瓶,250ml试剂瓶
试剂:Na2S2O3固体,KIO3固体,CuSO4固体,CuCl2固体,ZnCl2固体,PbCl2固体,EDTA固体, BaCl2固体, K2SO4固体, NH4F, 硫脲, 抗坏血酸, 六亚甲基四胺, 二甲酚橙, 酒石酸钾钠, 亚铁氰化钾, K2Cr2O7固体, 乙酸钠, 乙酸, 二苯胺磺酸钠, 硫酸亚铁铵, AgNO3-Sr(NO3)2,混合溶液, H2SO4-H3PO4混合溶液, NH4HF2, KI, 0.5%淀粉溶液,KSCN溶液,6mol/lHCl,30%H2O2.
4.实验步骤
1.标定各种需要用到的溶液
配制约0.05mol/l的硫代硫酸钠溶液,使用碘酸钾标液标定其浓度。同实验室的同学分别配制了铜离子,铅离子和锌离子的标液以及EDTA在酸和碱中的浓度。
2.配制模拟液
用移液管分别移取50.00ml铜离子标液,75.00ml锌离子标液,10.00ml铅离子标液,定容至250.00ml。但是配制好才发现PbSO4会沉淀下来,所以有需要配制新的铜标液(CuCl2)并且重新标定.再重新按照上述比例配制模拟液。
3.利用模拟液来验证试验方法的可行性
铜含量的测定中,由于碘量法是经典的测定铜含量的方法,所以不加以验证。
锌含量的测定中,移取25.00ml模拟液,加入3mlBaCl2,10ml饱和K2SO4,加入4mlNH4F,加入2g饱和硫脲。1g抗坏血酸,震荡1min。加2g六亚甲基四胺,五滴二甲酚橙,用EDTA标液滴定,溶液由紫红变成亮黄,平行两次。
铅的含量测定中,移取25.00ml试液,2g硫脲,1g抗坏血酸,震荡1min,加3g酒石酸钾钠,2g六亚甲基四胺,5ml亚铁氰化钾,7滴二甲酚橙,EDTA滴定有紫红变为亮黄。平行三次。但是发现,亚铁氰化钾掩蔽锌的时候,产生大量沉淀,平行两次。此时溶液的颜色很难判断,所以,这个实验方案不合理。
准确称取0.5185g K2Cr2O7,定容至250ml。
2g硫酸亚铁铵溶于250ml水中。
由于时间原因,后没有定量的验证铅离子的新的实验方案,只是去取一定量的K2Cr2O7标准溶液加入适量的H2SO4-H3PO4混合溶液,使用二苯胺磺酸钠指示剂,用浓度为0.02mol/l左右的硫酸亚铁铵标准溶液滴定至紫色变为亮绿色,发现颜色变化明显。
4.测定样品
准确称取0.4970g铜合金,置于100ml烧杯中,加入10mL 1:1HCl溶液,滴加约3mL30%H2O2,盖上表面皿,放在加热板上,加热至无气泡产生。冷却后转移至100ml容量瓶,定容。
移取25.00mL合金溶液, 5mL NH4HF2,1gKI,然后用Na2S2O3溶液滴定至浅黄色,加3mL0.5%淀粉溶液,继续滴定至溶液显浅灰色或浅蓝色。然后加5mL KSCN溶液,充分摇动。此时,溶液蓝色加深.继续用Na2S2O3溶液滴定至蓝色刚好消失即为终点。平行三次。
准确称取0.4973铜合金,置于100ml烧杯中,加入10mL 1:1HCl溶液,滴加约3mL30%H2O2,盖上表面皿,放在加热板上,加热至无气泡产生。冷却后转移至100ml容量瓶,定容。
移取25.00ml合金溶液,加入3mlBaSO4,10ml饱和K2SO4,加入4mlNH4F,加入2g饱和硫脲。1g抗坏血酸,震荡1min。加2g六亚甲基四胺,五滴二甲酚橙,用EDTA标液滴定,溶液由紫红变成亮黄。滴定两组发现数据不平行。
称取1.3432g合金,置于100ml烧杯中,加入30mL 1:1HCl溶液,滴加约10mL30%H2O2,盖上表面皿,放在加热板上,加热至无气泡产生。冷却后转移至100ml容量瓶,定容。
准确称取0.5185g K2Cr2O7,定容至250ml。
2g硫酸亚铁铵溶于250ml水中。
取10.00ml K2Cr2O7标液,加入5ml H2SO4-H3PO4混合溶液,3滴二苯胺磺酸钠,使用标定硫酸亚铁铵滴定由紫色变成亮绿色。
移取25.00ml合金溶液,加入4g乙酸钠,2ml乙酸,不停摇动下加入10.00mlK2Cr2O7标准溶液,15s后加5mlH2SO4-H3PO4混合溶液,3滴二苯胺磺酸钠,使用标定好的硫酸亚铁铵滴定由紫色变成亮绿色。
5.一些方法可行性的探究
取适量铅离子标液,加入稍微过量的K2Cr2O7溶液,出现大量黄色沉淀,再加入过量的H2SO4溶液,摇晃后静置,发现白色沉淀变成了白色。
5.实验记录
1. 配制硫代硫酸钠溶液
称取硫代硫酸钠质量:12.40g溶于500ml水中
准确称取碘酸钾0.5416g定容至250ml水中(严海涵)
硫代硫酸钠消耗体积:29.37ml 29.40ml 29.47ml(过量) 29.40ml
称取硫代硫酸钠质量12.40g,溶于500ml水中
计算得碘酸钾浓度:0.01014mol/L(严海涵)
硫代硫酸钠消耗体积:26.10ml 26.01ml 26.02ml 26.00ml
2. 配制模拟液
移取25.00ml+25.00ml铜离子标液,25.00+25.00+25.00ml锌离子标液,10.00ml铅离子标液。
3. 利用模拟液来验证试验方法的可行性
检验锌离子消耗EDTA的体积:37.00ml 37.03ml
检验铅离子消耗EDTA体积:3.65ml 4.05ml
4. 测定样品
测定铜的含量
合金质量:14.6526g-14.1556g=0.4970g 27℃ 133 50%
硫代硫酸钠消耗体积:19.62ml 19.65ml 19.63ml
测定锌的含量
合金质量:14.6527g-14.1554g=0.4973g 27℃ 133 50%
滴定消耗的EDTA 体积:32.80ml 33.10ml
测定铅的含量
合金质量:15.5117g-14.1685g=1.3432g 27℃ 133 50%
重铬酸钾质量:12.4641g-11.9456g=0.5185g 27℃ 133 50%
硫酸亚铁铵质量:2.0g
标定硫酸亚铁铵时消耗的体积:19.50ml(目测已过) 19.18ml 19.42ml 19.40ml
测定样品时消耗的硫酸亚铁铵体积:19.21ml 19.39ml 19.38ml
5. 其他用到的一些数据
EDTA浓度:0,02240mol/L
铜离子标液浓度:0.2200 mol/L
锌离子标液浓度:0,09821mol/L
铅离子标液浓度:0.01916mol/L
6.数据处理
1. 配制硫代硫酸钠溶液
C=mKIO3÷(250.00ml×MKIO3) ×25.00ml×6÷VNa2S2O3
C1=0.05155mol/L C2=0.05848mol/L
2. 配制模拟液
C=C’V÷250ml
CCu=0.04400mol/L CZn=0.02946mol/L CPb=0.0007664mol/L
3. 利用模拟液来验证试验方法的可行性
锌离子c=CEDTA×V÷25.00ml
C=0.2948mol/L 相对误差0.06%
由于铅离子数据不平行故不能使用。
4.测定样品
铜离子含量ω= C2×V÷25.00ml×100.00ml×MCu÷m合金
ω=58.71% 相对误差:0.05%
锌离子含量ω= CEDTA×V÷25.00ml×100.00ml×MZn÷m合金
这组数据不平行,所以不能用到。
重铬酸钾浓度:c=m÷M÷250.00ml
Fe2+浓度:c‘=10.00ml×6×10.00×c÷V
铅的含量ω=(10.00×C-C’×V’ ÷6)÷25.00×250.00×MPb÷m合金
这一组实验才后来的验证中发现铬酸铅沉淀的Ksp小于硫酸铅Ksp,所以不可行。
7.结论与讨论
1. 关于沉淀对于溶液颜色变化观察的影响的思考
本实验中,开始用到了两个需要沉淀掩蔽的方法,第一个是使用硫酸钾沉淀铅离子,第二个是使用亚铁氰化钾掩蔽锌离子,但是第一个成功了,而第二个方法被验证不可行。其主要原因就是沉淀的多少。
在第一个中,由于本实验使用的金属样品中的铅的含量较少,所以产生的沉淀不是很多,基本不影响指示剂颜色变化的观察。方法验证过程中,所得结果在1‰以内,证明实验方法没有问题,但是后来做样品时候的两组数据不平行,差了好多,这个的原因可能是一些实验操作上的不规范,与实验原理无关。
第二个方法中,由于样品中锌的含量比较大,产生的沉淀很多,对指示剂颜色变化产生了比较大的影响,导致观察不到颜色的突变点,最后数据不平行。
改进:有沉淀是,其实可以先把沉淀过滤出来,再用滤液测含量。但是这样就需要多次洗涤,导致滴定体系变得很大,颜色变化区域变得很宽,也很影响观察。所以我认为实验中尽量少使用沉淀掩蔽。
2. 铅离子含量测定
本实验中用到了重铬酸钾沉淀铅离子再反滴定重铬酸钾的方法来测定铅的含量。发现测定的结果中,铅的含量几乎为0。后来做了探究实验,发现硫酸铅的Ksp更小,而实验中用于调节pH的是S-P混酸,所以实验不成功。
该实验可以进行改进,但是需要注意的是,不近要注意调节酸度的算和铅离子沉淀的Ksp,还需要注意酸的氧化性和还原性。如果使用盐酸来调节pH,重铬酸钾会氧化氯离子,如果使用硝酸来调节pH,硝酸会氧化亚铁离子,都是不合适的。所以需要一种既不易被氧化也不易被还原的强酸来调节pH。磷酸的作用是与三价铁形成络合物防止影响颜色的观察。
3. 实验结果的分析
本实验中,使用碘量法测定铜的含量,结果只有0.5‰的误差,证明这个经典的测定铜的方法是很可靠的。测定锌的时候,使用模拟液验证的时候很理想,误差为0.6‰,但是,在使用合金样品溶液测定时,结果出现了较大的错误,我认为是自己的实验操作出现了较大的错误,但是具体是哪一步就不清楚。而铅离子的测定中,一共用了两个方法均已失败告终。第一个方法是由于沉淀影响了指示剂颜色的变化观察,第二个是木有注意到硫酸会溶解掉铬酸铅。
8.参考文献
1. 北京大学化学与分子工程学院分析化学教学组 基础分析化学实验 北京大学出版社
2. 李正权 铜合金中铅测定的探讨 化学技术与开发 2011.4 第40卷第4期
3. http://wenku.baidu.com/view/11c6f689d0d233d4b14e6956.html
-
氧化还原反应实验报告
实验十二氧化还原反应一实验目的1理解电极电势与氧化还原反应的关系和介质浓度对氧化还原反应的影响2加深理解氧化态或还原态物质浓度变化…
-
实验九 氧化还原与电化学
无机实验报告实验九氧化还原与电化学一、电极电势与氧化还原反应方向结论:(MnO4/Mn2+)(Fe3/Fe2+)(I2/I-)(S…
-
氧化还原反应和电化学的实验步骤
步骤1原电池的组成和电动势的粗略测定在一只井穴皿的123位置分别倒入约12容积的01MolL现象解释结论及方程式21CuCu22C…
-
实验17 氧化还原反应和电化学
实验17氧化还原反应和电化学一实验目的1了解电极电势与氧化还原反应的关系2试验并掌握浓度和酸度对电极电势的影响二实验原理原电池是将…
-
课题_氧化还原反应实验报告
一实验目的1理解电极电势与氧化还原反应的关系和介质浓度对氧化还原反应的影响2加深理解氧化态或还原态物质浓度变化对电极电势的影响3进…
-
分析化学实验报告(武汉大学第五版)
分析化学实验报告陈峻贵州大学矿业学院贵州花溪550025摘要熟悉电子天平的原理和使用规则同时可以学习电子天平的基本操作和常用称量方…
-
氧化还原反应实验报告
实验十二氧化还原反应一实验目的1理解电极电势与氧化还原反应的关系和介质浓度对氧化还原反应的影响2加深理解氧化态或还原态物质浓度变化…
-
同济大学化学系研究生实验报告实验二循环伏安法研究
实验二循环伏安法研究FeCN6FeCN6实验目的1了解循环伏安法的基本原理及操作技术342通过测定标准电化学可逆电对FeCN63F…
-
湖南大学材料化学电化学实验报告
实验一线性极化法测定金属Fe在稀H2SO4中的腐蚀速度一基本要求1掌握动电位扫描法测定电极极化曲线的原理和实验技术通过测定Fe在0…
-
氧化还原与电化学实验报告
氧化还原与电化学实验报告一实验目的二实验原理三预习思考题1为什么KMnO4能氧化盐酸中的Cl而不能氧化氯化钠溶液中的Cl2为什么H…
- 实验14氧化还原反应