生物工程工艺综合性实验报告
生物工程工艺综合性实验报告
院 (系): 城市建设学院
专业班级: 生物工程1101
学生姓名: 马雪文
学 号: 20111171041
指导教师: 李 世 杰

20 14 年 5 月 26 日至20 14 年 6 月 15 日
发酵工艺综合性实验指导书
一、 实验目的
微生物发酵技术是生物工程最核心的技术,微生物发酵按其对
氧的需求可分为好氧微生物发酵,和厌氧微生物发酵。好氧和厌氧发酵有较大的区别,各自对工艺条件、发酵设备有不同的要求。分别掌握好氧和厌氧发酵技术也就比较全面的掌握了工业微生物技术。
本实验分别开出典型的好氧和厌氧发酵实验,训练学生掌握这两种工艺的基本技术、操作程序、分析手段,全面锻炼同学们实际动手能力。巩固和提高微生物净化操作能力、显微观察技术、培养基配制和灭菌技术、无菌取样和细胞量的确定、生长曲线的制作、光谱分析技术、气象色谱分析技术。初步培养同学们工业微生物领域科学研究和技术开发的基本能力。
二、 实验原理
红曲霉通过有氧发酵将淀粉质原料转化为次级代谢产物红曲色素。
丙丁梭状芽孢杆菌经厌氧发酵将农副产品转化为丁醇和丙酮。
三、 实验内容
1、好氧实验:红曲的发酵实验及其抑菌作用研究
2、厌氧实验:丁醇的发酵实验及其气相色谱检测
四、 仪器设备和试剂、消耗品:
1. 仪器设备:
电子分析天平
手提式蒸汽灭菌锅、自动控制蒸汽灭菌锅
双孔水浴锅
1000W电炉 5台
生物显微镜、电脑成像生物显微镜
生物培养箱、培养摇床
真空干燥箱
紫外可见分光光度计
离心机
真空泵、真空干燥器
蒸发器
气象色谱仪
2. 药品和耗材:
药品:可溶淀粉 1瓶(500克),蛋白胨 1瓶(500克),琼脂,饴糖(麦芽汁)麦芽1000克,大米粉 5公斤,硝酸钠NaNO3 1瓶(500克),磷酸二氢钾KH2PO4 1瓶(500克),磷酸氢二钾K2HPO4 1瓶,硫酸镁MgSO4·7H2O 1瓶(500克),硫酸铵(NH4)2SO4 1瓶,氯化锰MnCL2 1瓶,硫酸锰MnSO4·H2O 1瓶,碳酸钙CaCO3 1瓶,维生素B1(盐酸硫胺素)1小瓶,酵母膏1瓶,乳酸(液态1瓶500克),葡萄糖(分析纯)1瓶,乙醇(分析纯)5瓶(5×500克),乙醇(色谱纯Aladdin) 2瓶,丁醇(色谱纯Aladdin)2瓶,丙酮(色谱纯Aladdin)2瓶,叔戊醇(色谱纯Aladdin)2瓶
耗材:500ml三角瓶50只, 250ml三角瓶16个,100ml粗口径试管50只,1000ml烧杯10个,培养皿160套,常规试管160个,200ml烧杯16个,1ml移液枪头5盒,标签纸若干,玻璃真空干燥器大号1个,波美计8只,移液枪(1000ml)2只,玻璃珠2盒,100ml量筒8个,500ml量筒2个,称量纸2盒,不锈钢试剂勺4根, pH试纸2包,玻璃棒若干,玻璃推棒32根,5ml移液管16只
五、实验方法步骤和具体操作过程
(一) 红曲的发酵实验及其抑菌作用研究
红曲是一种具有一定营养和药理作用的纯天然红色素,可赋予肉制品、食品、饮料等鲜艳的色泽及特殊风味,而且具有较好的营养价值和一定的防腐作用,因而被广泛地应用于食品工业。
红曲是由红曲霉经发酵分泌到胞外的一种色素,发酵的主要原料是淀粉类如大米、薯类等。红曲霉发酵合成色素同时对有害菌产生抑制作用。本实验分为两个部分,前一部分为红曲的发酵实验,后一部分为红曲的抑菌试验。
(Ⅰ)红曲的发酵实验
1.菌种
本实验室保藏的红曲霉菌种monascus purpureus。用本实验室自主设计的保藏方法,在短梗霉多糖膜片中封存,置于冰箱中保藏。使用时每取出一片,进行活化,然后作为种子扩大培养。
2.培养基
①斜面试管和平板培养基:
饴糖培养基:6~8。Bx饴糖100 mL,可溶淀粉5 g,蛋白胨3 g,琼脂2 g,121℃灭菌30。每大组制备200ml用于制作平皿
用于菌种活化则不加琼脂,100ml饴糖培养基装入500ml三角瓶中(加入一定数量的玻璃珠)121℃灭菌30分钟备用
*饴糖(麦芽汁)的制备:大麦芽50克,粉碎后加入4倍于麦芽重量的水,搅拌均匀,在55℃至60℃的保温箱中糖化4小时,取出过滤得麦芽汁,测波美度,灭菌备用。
以上麦芽汁的制备分为四个大组进行实验,每大组做2瓶试样,
②种子培养基为:
大米粉3% ,硝酸钠O.5% ,KH2PO4 0.15% , MgSO4 0.1% , 250ml三角瓶中装量100ml,pH6.0乳酸调(加入一定数量的玻璃珠),121℃灭菌30分钟备用(或可溶性淀粉3g,硝酸钠0.3g,黄豆饼粉0.5g,水100ml “微生物学实验” 胡开辉)每小组做一瓶
③发酵培养基为:
a. 大米粉9% ,硝酸钠O.2% ,KH2PO4 0.1%, MgSO4 0.2% ,pH6.0乳酸调
b. 小麦粉9% ,硝酸钠O.2% ,KH2PO4 0.1%, MgSO4 0.2% ,pH6.0乳酸调
c. 玉米粉9% ,硝酸钠O.2% ,KH2PO4 0.1%, MgSO4 0.2% ,pH6.0乳酸调
d. 木薯粉9% ,硝酸钠O.2% ,KH2PO4 0.1%, MgSO4 0.2% ,pH6.0乳酸调
e. 土豆粉9% ,硝酸钠O.2% ,KH2PO4 0.1%, MgSO4 0.2% ,pH6.0乳酸调
f. 称取100g籼米热水浸泡1小时,沥干,入玻杯中,灭菌锅中蒸30分钟,冷却后接入种子液,摇匀,培养3~5天,米粒呈紫红色(胡开辉)
*分为四大组,每组一个配方进行实验,配方e.、f.作为自选项
3.菌种活化
在净化操作台上操作。保藏于短梗霉多糖薄膜的保藏片,用灭过菌的剪刀将其外包装塑料膜剪开,再用灭过菌的镊子将里面的短梗霉多糖膜片夹出,置于装有100ml饴糖培养基的500ml三角瓶中,在恒温摇床上(28士1)℃,以200转速度震荡培养3天左右至瓶中浑浊有颜色变化有孢子生成(以上有教师作预备试验)
4.平板单菌落
超净工作台擦拭干净,打开紫外灯提前灭菌15分钟至20分钟。
准备9个平皿、玻棒、推棒、1ml移液吸管头1包、9只试管分
别装9ml生理盐水,包扎灭菌(121℃,30分钟)好,放入净化操作台备用。(2人一组)
配制加有琼脂的饴糖培养基200ml,三角瓶中灭菌好(121℃,30分钟),放入净化操作台,待培养基冷却至50℃左右,将其分别平均倒入9个平皿中,待其冷却凝固。(操作前先点燃酒精灯,开启微风,倒平皿时要在酒精火焰的下风口进行操作,倒平皿速度要较快,否则琼脂凝固就会倒不出来)
将三角瓶中活化好的红曲孢子,用移液枪吸取1ml,放入其中1只装有9ml生理盐水的试管中,玻棒搅打均匀。再用移液枪吸取上述试管中的液体1ml放入装有9ml净化水的试管2中,依此类推,逐步稀释,至第9只试管。将上述试管中的第3、第4、第5、第6、第7,五只试管中稀释的孢子各吸取0.2ml,涂布在已经凝固好的平板上。从最稀的第7只开始涂布,到较浓的第3只。以玻棒推平,同样也是从最稀的开始逐个推平。置于恒温培养箱中28℃培养至明显的单个菌落出现且能观察到孢子生成。
5.种子培养
配制种子培养基②(加入一定数量的玻璃珠)121℃灭菌30分钟(2人一组),放入无菌操作台,待其冷却至常温,将上述平皿上长出的单个菌落上的红曲孢子挑取一环接入三角瓶种子培养基中(250ml三角瓶装量100ml,每组2瓶,其中一瓶用于取样观察,另一瓶则不取样留作种子),放置培养摇床上28℃~30℃,200rpm转速培养,每日在超净工作台上取样观察,至有较多的菌丝生成,将转速调整到160rpm,待有孢子生成即可作为种子。
6.发酵培养(事先将1ml吸管头包扎灭菌备用)
分为4大组(每大组做4瓶),分别配制大米粉培养基、小麦粉培养基、玉米粉培养基、木薯粉培养基,500ml三角瓶装量100ml,121℃灭菌30分钟,放入无菌操作台待冷却至常温。
在超净工作台上将上述培养好的种子培养液用移液枪吸取2ml,接种于已灭菌好的发酵培养基中,置于培养摇床上28℃~30℃,200rpm转速进行培养,每日取样观察。
7. 取样检测
① 将三角瓶从摇床中取出,置于超净工作台上(超净工作台事先擦拭干净,紫外灭菌15分钟),点燃酒精灯,开微风,用事先灭过菌的移液枪头吸取1ml发酵液,置于1ml的离心管中;(接种后也要立即取样,作为第一天的检测数据)
② 在离心机中以3000rpm离心10min,离心机停止转动后立即将上清液倒入一只试管中,加入10ml去离子水稀释;
③ 上述稀释液进一步适当稀释后,用紫外可见分光光度计505纳米处测其吸光值(去离子水作为空白对照),
吸光度=测定值×稀释倍数,作好记录;
④ 离心管下部沉淀物置于真空干燥箱中,抽真空,60℃干燥3小时,电子天平称重,作好记录
⑤ 5天后停止取样,记录每天取样检测结果
8. 整理每天观察和检测得到的数据
① 以时间数据为横坐标,离心沉淀物干重为纵坐标作红曲的生长曲线;
② 以时间数据为横坐标,相应每天得到的红曲吸光度为纵坐标,做红曲色素的生成曲线。
(Ⅱ)红曲的抑菌作用实验
1. 大肠杆菌和金黄色葡萄球菌的培养
①菌种:大肠杆菌E.coli和金黄色葡萄球菌S.aureus 斜面菌种各一只,本实验室保藏,从冰箱中取出备用。
②培养基:LB培养基:蛋白胨10 g,酵母膏5 g,NaC1 10g,自来水
1000 mL,pH 7.2。配制50ml装于250ml三角瓶中,各2瓶,121℃灭菌20分钟,冷却至常温备用。
(或蛋白胨10 g,牛肉膏10 g,葡萄糖10g,NaC1 5g,自来水1000 mL,pH 7.0 中国工业微生物菌种目录培养基32)
③种子培养:将大肠杆菌和金黄色葡萄球菌斜面菌种分别接种于上述LB培养液中,37 ℃培养36 h作种子。
④色素抑菌性能的测定:
a.LB培养液配制10瓶~14瓶,分别加入10 mL浓度不同的红曲色素灭菌备用(如红曲浓度较低则以旋转蒸发器浓缩,或在真空干燥箱中真空浓缩以后再做成不同浓度加入)。再用移液枪分别移接0.2mL上述大肠杆菌和金黄色葡萄球菌(细胞浓度107个/mL )于含不同浓度红曲色素的LB三角瓶培养基中,其中一瓶不加红曲色素作为空白对照。 置入恒温摇床中37 ℃培养36 h,测定红曲色素抑菌性能。
b.取上述培养液10ml,8 000 r/min离心5 min,去上清液,用无菌水洗涤3次,将所得菌体加10 mL的无菌水稀释。以无菌水做空白对照用可见分光光度计分别在600 nm和640 nm处测菌悬液的比浊度,除以不含红曲色素培养液培养的菌悬液的比浊度,计算抑菌率。
抑菌率=(空白培养液浊度-含红曲培养液浊度)÷空白培养液浊度
c.以红曲的添加量为横坐标,抑菌率为纵坐标,作红曲的抑菌曲线图。
注:以上实验作两轮,直到得到满意结果,大约需15天左右,为使实验保持连续性,星期六和星期天可能不休息。
(二)丁醇的发酵实验及其气相色谱检测
丁醇是由淀粉质原料经丙酮丁醇梭状芽胞杆菌发酵转化得到的一种有广泛用途的化工原料。它可以作各种涂料的溶剂,比如飞机涂料的最理想溶剂。
生物丁醇与乙醇相似,是生物加工的醇类燃料。汽油中的主要组成是C6 ~ C8 ,因此丁醇比乙醇更类似于"油" , 丁醇与乙醇相比也具有较高的能量密度,它与燃料添加剂和润滑油配伍性更好。同时,因其类似烃类的结构,丁醇不易于与水相混合,可在炼油厂调合和用管道运送, 无须在分销终端进行调合,同时可调入更高浓度,无需改造汽车。
与其它生物燃料相比丁醇腐蚀性较小,混合燃料中可混入20%的丁醇,丁醇还是一种高能生物燃料,与传统燃料相比可支持汽车多走10%的路程,与乙醇相比多走30%的路程。
丁醇发酵是典型的厌氧发酵,不需要像红曲霉那样震荡好氧培养,通过丁醇发酵实验,可以了解厌氧发酵的的工艺过程,同时通过丁醇的检测也可以学习气象色谱仪的检测方法。
(Ⅰ)发酵试验
1.菌种 本实验室保藏的丙酮丁醇梭状芽胞杆菌,其芽孢封存于短梗霉多糖薄膜中,在冰箱中长期保存。用时取出一片,玉米培养基中活化。
2.培养基
(1)种子培养基 干燥的玉米粒粉碎过80目筛,5克玉米粉加100ml自来水,在烧杯中搅匀,电炉上煮沸至糊化完全(期间补充水维持在100ml,大约45分钟左右至糊状无颗粒),转至粗口径试管中封口,于灭菌锅中121℃灭菌30分钟
(2)发酵培养基
①玉米培养基: 干燥的玉米粒粉碎过80目筛,6克玉米粉加100ml自来水,糊化灭菌同种子培养基
②蔗糖培养基: 蔗糖5g/100ml,(NH4)2SO40.6 g/100ml,玉米浆1.0 g/100ml,KH2PO40.04 g/100ml,CaCO30.6 g/100ml。pH7.0左右
③葡萄糖培养基:葡萄糖5g/100ml,(NH4)2SO40.6 g/100ml,玉米浆1.0 g/100ml,KH2PO40.04 g/100ml,CaCO30.6 g/100ml。
④混合培养基:蔗糖3.2g/100ml,葡萄糖1g/100ml,果糖 0.8g/100ml, (NH4)2SO40.6 g/100ml,玉米浆1.0 g/100ml,KH2PO40.04 g/100ml,CaCO30.6 g/100ml。
3. 种子活化
带帽试管事先灭菌好,将封存有丙丁梭状芽孢杆菌的短梗霉多糖薄膜片从冰箱中取出,在净化操作台上将膜片的外包装塑料膜剪开,用镊子将多糖膜片夹出,置于灭好菌的空试管中,将已经糊化灭菌好的玉米粉种子培养基倒入该试管,管口盖好,在沸水中热激活2分钟,在自来水管下迅速冷却至常温。
试管转至玻璃真空干燥器中用真空泵连接,抽真空。连同真空干燥器一起放入恒温培养箱中,37℃培养。观察产气和泡盖生成情况,大约1~2天泡盖形成,在净化操作台上操作,将泡盖挑出,继续培养。当气泡完全消失,孢子下沉,液面变清(大约5天左右),即可作为种子使用。
4. 发酵
分别配制好发酵培养基①、②、③、④,121℃灭菌30分钟,冷却至常温备用;
100ml粗口经空试管洗刷干净,制作棉塞塞住管口,包扎灭菌,在净化操作台上操作,将种子液上部清液倒掉,下部孢子摇匀,分别倒入灭菌好的粗口经试管中,注意平均分配,然后将灭菌好的发酵培养基分别倒入100ml,塞好棉塞,在沸水浴中热激活2分钟,迅速冷却至常温。
接种好的试管一起放入真空干燥器抽真空,然后连同真空干燥器一起放入恒温培养箱中,37℃静置培养。每日观察试管内的变化,和产气的情况。注意形成泡盖的在泡盖比较牢固时挑取泡盖。
发酵至产气结束,待孢子下沉,上部变清,即可倒出上清液,下部孢子浑浊液离心收获孢子。
5. 蒸馏
收集的上部清液置于蒸馏器中,进行蒸馏,蒸馏进行到瓶底只剩极少量混浊物,收集馏出液,还原体积至100ml,进行下一步的气相色谱检测。
(Ⅱ)气相色谱检测
1.开机程序
①首先打开氮气钢瓶总阀门、调节减压阀压力为0.3~0.4Mpa。调节柱前压约为0.04Mpa。
②打开GC气相色谱仪右侧的电源开关,当屏幕上显示出主画面后,即可设置测试参数(柱温、进样器温度、检测器温度等)。设定柱温时,一定要注意柱子的最高使用温度。
③当温度达到设定温度时,开空气、氢气。打开空气、氢气钢瓶总阀门,调节减压阀压力为0.3~0.4Mpa。
④打开仪器面板上空气、氢气针形阀开关。(参考值:空气开7圈,氢气开4圈。)
⑤用点火器点火。注意将氢气针形阀开至5圈以上来点火,火点着后调回4圈。为防止积水,当检测器温度大于150℃且检测器外侧有少许发热后才可以点火;火点着后,检测器上方有水汽,信号显示有激流产生。
⑥ 打开工作站,查看基线。稳定大约30min,待GC温度达到设
定温度后,基线亦稳定,即可测定。
2.测试条件的设定:
色谱条件的设定要根据不同化合物的不同性质选择柱子,一般情况极性化合物选择极性柱。非极性化合物选择非极性柱。色谱柱柱温的确定主要由样品的复杂程度决定,其目的要达到在最短的时间里,使每个化合物的组份完全分离。对于混合物一般采用程序升温法。柱温的设定要同时兼顾高低沸点或溶点化合物。 一般测试化合物有两种测试方法:
① 毛细管柱分流法:样品被直接进入色谱柱,不需稀释进样量要少
于0.1μl。若为固体化合物,则尽可能用少量溶剂稀释,进样量为0.2~0.4μl
②大口径毛细管法不分流:无论固体或液体,一定要稀释后,方可进样,进样量为0.2~0.4μl(1ml/mg)
3.注意事项:
①检测器温度不能低于进样口温度,否则会污染检测器进样口温度应高于柱温的最高值,同时化合物在此温度下不分解。
②含酸、碱、盐、水、金属离子的化合物不能分析,要经过处理方可进行。
③进样器所取样品要避免带有气泡以保证进样重现性。
④取样前用溶剂反复洗针,再用要分析的样品至少洗2-5次以避免样品间的相互干拢。
⑤需直接进样品,要将注射器洗净后,将针筒抽干避免外来杂质的干扰。
4.关机程序
①关闭氢气、空气钢瓶总阀。
②退出软件,关闭计算机。
③按下退出按键,使仪器降温:
④待柱箱温度降至50℃后,关闭色谱仪开关。
⑤待氮气吹一段时间(约10分钟),关闭氮气钢瓶总阀。
5.数据整理
色谱检测得到的数据进行拷贝、计算、整理,图谱保留在实验报告中展示。
6.对不同的糖质原料进行丁醇发酵所得到的结果作比较,分析丁醇产量高低差别的原因
注:以上实验将在时间安排上和红曲发酵实验穿插进行,避免过分忙乱或者出现时间空当
六 、实验报告
1. 要求每人有完整的原始实验记录,实验记录连同实验报告一起交老师评分。
2. 实验报告主要内容:
(1) 实验名称
(2) 实验原理
(3) 实验仪器设备和化学试剂
(4) 实验菌种名称,培养基和实验方法,包括分析方法;实验步骤按顺序填写
(5) 实验结果,包括菌的生长曲线,产物的生成曲线,分析图谱,每批实验的产物量,列表,以及对比分析,说明等
(6) 查阅的与实验相关的参考文献
(7) 实验对动手能力培养的收获及实验中获得的经验教训建议等。
3. 实验报告提交和评分
实验完成后一个星期之内提交实验报告,由学习委员收集,交实验指导教师。
总评分按实际操作过程和实验报告内容质量两个部分,各占50分。实际操作过程包括参加实验的次数考勤情况、操作的正确性和熟练程度、分析解决所遇到问题的能力、互相帮助的作风等;实验报告包括记录的翔实准确、工艺过程的描述、分析数据的整理及其图表的清晰度、结果和结论分析的深度等。
七、实验操作步骤及结果分析
(一)红曲的发酵试验及其抑菌作用研究
1) 实验原理:红曲霉通过有氧发酵将淀粉质原料转化为次级代谢产物红曲色素。
2)实验仪器设备和化学试剂
1、实验仪器:电子分析天平,手提式蒸汽灭菌锅,自动控制蒸汽灭菌锅,双孔水浴锅,电炉,生物显微镜,恒温培养箱,培养摇床,真空干燥箱,紫外可见分光光度计,离心机,真空泵,真空干燥器,布氏漏斗,蒸发器
2、 化学试剂:大米粉、硝酸钠、磷酸二氢钾、硫酸镁、乳酸、95%乙醇、蒸馏水
3) 试验菌种名称,培养基和试验方法
1、菌种:红曲霉菌种monascus purpureus 。
2、培养基:
(1)种子培养基:大米粉3% ,硝酸钠O.5% ,KH2PO4 0.15% , MgSO4 0.1% , 250ml三角瓶中装量100ml,pH6.0乳酸调 (加入一定数量的玻璃珠),121℃灭菌30分钟备用(或可溶性淀粉 3g,硝酸钠0.3g,黄豆饼粉0.5g,水100ml “微生物学实验” 胡开辉)每小组做一瓶
(2)发酵培养基:大米粉9% ,硝酸钠O.2% ,KH2PO4 0.1%, MgSO4 0.2% ,pH6.0乳酸调
4)实验步骤
5月26号
1.种子培养基为:(配两瓶分别标为1A,1B)
大米粉3% ,硝酸钠O.5% ,KH2PO4 0.15% , MgSO4 0.1% , 250ml三角瓶中装量100ml,测pH,pH6.0乳酸调,不需滴加乳酸调pH,(分别加入70颗玻璃珠),用10层纱布裹住锥形瓶口,再套上牛皮纸密封,121℃灭菌30分钟备用。
2.接种红曲霉
在无菌操作台进行接种:1.点燃酒精灯;2.用酒精棉球擦拭双手与接种铲;3.解下细绳松动瓶口,灼烧接种铲,待冷却后取菌种接种(B瓶中接种的菌种面积约0.09 ;A瓶中接种菌落面积比B瓶稍大一点)
;A瓶中接种菌落面积比B瓶稍大一点)
3.菌种培养
在摇床上培养(30℃,188rpm)
5月27号
1.发酵培养基配制(配两瓶分别标为1A,1B)
大米粉9g ,硝酸钠O.2g,KH2PO4 0.1g, MgSO4 0.2g,100ml水,测pH,pH6.0,未滴加乳酸调pH,分别加入70颗玻璃珠,用10层纱布裹住锥形瓶口,再套上牛皮纸密封,121℃灭菌30分钟备用。
2.接种
在无菌操作台上将培养好的种子培养液1B(1A放入冰箱中)用移液枪吸取1ml,接种于已灭菌的上述发酵培养基A,B中
3.菌种培养
在摇床上培养(30℃,188rpm)
4.取B瓶种子培养液制片,检测红曲霉生长状况(第一次镜检)
滴一滴生理盐水于载玻片上,滴一滴种子培养液和伊红美蓝,盖上盖玻片镜检,拍照(见附件)
5月28号
1.取斜面培养基中的红曲霉进行制片,镜检
在无菌操作台上进行制片,点燃酒精灯,酒精棉球擦拭双手与接种环,取两片载玻片,均滴加一滴生理盐水,灼烧接种环,冷却后,挑取斜面培养基上的红曲霉,涂于生理盐水中,按同样的方法在做一载玻片,一个滴加伊红美蓝染色,另一个不染色均盖上盖玻片,镜检,拍照。【见图一、图二】
2.在B瓶发酵培养基中追加1ml菌种(无菌操作台)
5月29号
1.在无菌操作台上,用移液枪取五毫升A瓶中的发酵液与离心管中【A瓶比B瓶颜色深(见图三),取完后继续放在摇床上培养】装有发酵液的离心管放入离心机中以3500rpm离心5min,取上清液测在505nm处的吸光值A管ɑ=0.204(10:30);B管ɑ=0.342(15:25)
2.将离心管的沉淀物制片观察,并拍片【见图四、图五】
3.用95%的酒精浸提离心管A,B中的沉淀物(16:05)
5月30号
1.将离心管中的浸提物离心五分钟,3500rmp取上清液测吸光值
A管ɑ=0.096;B管ɑ=0.389(15:14)
2.用抽滤机抽滤红曲发酵培养基(A,B均抽滤后存放在一起)把滤渣即菌丝收集倒入三角瓶中,加入95%乙醇(体积约为滤渣体积的4-5倍),牛皮纸封口。(15:09)(布氏漏斗中叠放三层滤纸)
6月3号
1.取100g大米于500ml三角瓶中,用200ml沸水浸泡2h,沥干封口于灭菌锅中121℃灭菌30min
2.配制200ml大米粉培养基配置两瓶(A为实验组,B为对照组)
大米粉18g,硝酸钠0.4g,KH2PO4 0.2g , MgSO4 0.4g , 未滴加乳酸均加入 60颗玻璃珠。8层纱布,牛皮纸封口,于灭菌锅内121℃灭菌30min
3.无菌操作台(用红曲种子培养基A)接种,在大米粉培养基A中接种两毫升种子液(14:54),大米培养基接种10ml(14:59)(后因大米没熟,加水20ml,再次灭菌—121℃,30min。接种20ml,放入恒温箱培养。
4.在两瓶大米培养基中各取5ml(在无菌操作台上进行)于离心管中,离心管A为实验组,B为对照组,记为0号样。在离心机中离心5min,3500r/min。倒出上清液,沉淀物用95%的乙醇浸提。[15:43]
6月4号
1.在505nm处,测5月30号下午滤液及用乙醇浸提过的滤渣的吸光值。测滤液的吸光值用蒸馏水作对照,测得 =0.519[9:30],测酒精浸提后的上清液,用酒精作对照,测得
=0.519[9:30],测酒精浸提后的上清液,用酒精作对照,测得 =3.010[9:30],稀释8倍后,测得
=3.010[9:30],稀释8倍后,测得 =0.608[9:45],操作完毕,倒入废液缸,洗净。
=0.608[9:45],操作完毕,倒入废液缸,洗净。
2.测6月3号下午,0号样的吸光值,505nm,用酒精作对照, =0.034,
=0.034, =0.029[9:49]
=0.029[9:49]
3.在无菌操作台上,用接种铲翻动大米培养基[10:28],操作完毕,放入恒温箱中培养。
4.从摇床上取出实验组(未红),恒温培养箱中取出对照组,重复6月3号四过程,离心管A为实验组,B为对照组,记为1号样[14:55],操作完毕,放回原位。【未知原因,已废,另取】
6月5号
1.从摇床上取出实验组(未红),在无菌操作台上,补加彭帆组种子2ml[8:54],操作完毕放入摇床。
2.从恒温箱中取出大米培养基,在无菌操作台上,用接种铲翻动通气[9:00](深红),操作完毕,放入恒温箱培养。
3.观察大米培养基,紫红[14:35]
4.从摇床上取出实验组(淡粉),取出对照组,重复6月4号四过程,离心管A为实验组,B为对照组,记为1号样[14:50],操作完毕,三角锥瓶放回原位。离心管离心5min,3500r/min,将A中上清液倒入一离心管,测吸光值( =0.833[15:14])。B中上清液倒入废液缸。沉淀物用95%的乙醇浸提[14:57]。
=0.833[15:14])。B中上清液倒入废液缸。沉淀物用95%的乙醇浸提[14:57]。
5.从摇床上取出实验组(嫣红),取出对照组,重复6月5号四过程,离心管A为实验组,B为对照组,记为2号样[21:00],操作完毕,三角锥瓶放回原位。离心管离心5min,3500r/min,将A中上清液倒入一离心管,测吸光值( =1.405[21:23],稀释4倍后,
=1.405[21:23],稀释4倍后, =0.3513[21:29])。B中上清液倒入废液缸。沉淀物用95%的乙醇浸提[21:09]
=0.3513[21:29])。B中上清液倒入废液缸。沉淀物用95%的乙醇浸提[21:09]
6月6号
1.测6月5号四中1号样的吸光值。 =0.336,
=0.336, =0.032[9:33]
=0.032[9:33]
2.从摇床上取出实验组(绛红),取出对照组,重复6月5号五过程,离心管A为实验组,B为对照组,记为3号样[11:06],操作完毕,三角锥瓶放回原位。离心管离心5min,3500r/min,将A中上清液倒入一离心管,测吸光值( =0.577[11:27])。B中上清液倒入废液缸。沉淀物用95%的乙醇浸提[11:22]
=0.577[11:27])。B中上清液倒入废液缸。沉淀物用95%的乙醇浸提[11:22]
3.将6月5号五中的离心管取出,离心5min,测上清液的吸光度。 =0.214,
=0.214, =0.08[14:54]
=0.08[14:54]
4.从摇床上取出实验组(绛红),取出对照组,重复6月6号二过程,离心管A为实验组,B为对照组,记为4号样[15:51],操作完毕,三角锥瓶放回原位。离心管离心5min,3500r/min,将A中上清液倒入一离心管,测吸光值( =0.574[16:10])。B中上清液倒入废液缸。沉淀物用95%的乙醇浸提[15:58]
=0.574[16:10])。B中上清液倒入废液缸。沉淀物用95%的乙醇浸提[15:58]
6月7号
1.将6月6号三中的离心管取出,离心5min,测上清液的吸光度。 =0.832,
=0.832, =0.018[9:13],将实验组稀释2倍后,
=0.018[9:13],将实验组稀释2倍后, =0.416[9:27]
=0.416[9:27]
2.从摇床上取出实验组(深红),取出对照组,重复6月6号四过程,离心管A为实验组,B为对照组,记为5号样[9:30],操作完毕,三角锥瓶放回原位。离心管离心5min,3500r/min,将A中上清液倒入一离心管,测吸光值( =1.118[10:04],稀释2倍后,
=1.118[10:04],稀释2倍后, =0.671[10:11])。B中上清液倒入废液缸。沉淀物用95%的乙醇浸提[9:43]
=0.671[10:11])。B中上清液倒入废液缸。沉淀物用95%的乙醇浸提[9:43]
3.在无菌操作台上,从大米三角锥瓶中,取大于5g大米。取出后,再用天平称量8g,用40ml95%的乙醇浸泡,用牛皮纸封口[10:46]。
4.测红曲4号样的吸光度, = 0.561,
= 0.561, =0.019[16:10]
=0.019[16:10]
5.从摇床上取出实验组(深红),取出对照组,重复6月7号二过程,离心管A为实验组,B为对照组,记为6号样[16:16],操作完毕,三角锥瓶放回原位。离心管离心5min,3500r/min,将A中上清液倒入一离心管,测吸光值( =1.615[16:15],稀释4倍后,
=1.615[16:15],稀释4倍后, =0.546[16:39])。B中上清液倒入废液缸。沉淀物用95%的乙醇浸提[16:27]
=0.546[16:39])。B中上清液倒入废液缸。沉淀物用95%的乙醇浸提[16:27]
6月8号
1.测红曲5号样的吸光度, = 0.620,
= 0.620, =0.012[8:56]
=0.012[8:56]
2.从摇床上取出实验组(深红),取出对照组,重复6月7号五过程,离心管A为实验组,B为对照组,记为7号样[8:45],操作完毕,三角锥瓶放回原位。离心管离心5min,3500r/min,将A中上清液倒入一离心管,测吸光值( =0.681[9:05])。B中上清液倒入废液缸。沉淀物用95%的乙醇浸提[8:56]
=0.681[9:05])。B中上清液倒入废液缸。沉淀物用95%的乙醇浸提[8:56]
3.取6月7号8g大米用乙醇浸提液,离心5min,测吸光度,用酒精稀释8倍后, =0.447[10:48]
=0.447[10:48]
4.测红曲6号样的吸光度, = 0.819,
= 0.819, =0.012[16:09],实验组稀释2倍后,
=0.012[16:09],实验组稀释2倍后, =0.401[16:14]
=0.401[16:14]
6月9号
1.测红曲7号样的吸光度, = 0.780,
= 0.780, =0.021[11:19],实验组稀释2倍后,
=0.021[11:19],实验组稀释2倍后, =0.536[11:24]
=0.536[11:24]
5)实验结果(见附录)
6)实验结果分析
影响红曲发酵的因素:1.菌种:应选择生长快,适应性强,产红色素明显的菌株;2.原料:一般选用无粘性的粳米或籼米,其淀粉含量高,营养丰富,且可吸收适量水分。米的含水量对发酵影响很大,起始水分含量低,红曲色素易生成;水分含量高,会抑制色素合成。一般米中含水量以25%-30%为宜;3.补水:红曲霉在生长繁殖过程中,需补充适量的水分,尤其在生长旺盛期补水显得更加重要;4.湿度:空气相对湿度关系到水分的蒸发,对发酵的影响也很大,一般RH控制在85%以上;5.温度:能在20-37℃范围内生长,通常冷却至30℃发酵;6.通气:红曲霉是一种好氧性微生物,因此培养过程中要注意保持良好的通气。鉴于以上这些客观因素每组都相同,因此结果不同可能是主观原因,比如培养基成分漏加,错加,重复加;摇瓶时培养瓶所处的位置;取样时所取菌种的量不同;加酒精浸提的量不同;观察时间和取样时间不同;调pH值时,有的加了乳酸,有的未加,加了的加的滴数不同等等。
(二)丁醇的发酵试验及其气相色谱检测
1)实验原理:
丙丁梭状芽孢杆菌经厌氧发酵将农副产品转化为丁醇和丙酮。
2)实验仪器设备和化学试剂
1、实验仪器:电子分析天平,手提式蒸汽灭菌锅,自动控制蒸汽灭菌锅,双孔水浴锅,电驴,生物显微镜,恒温培养箱,培养摇床,真空干燥箱,紫外可见分光光度计,离心机,真空泵,真空干燥器,布氏漏斗,蒸发器
2、化学试剂:玉米粉,葡萄糖,玉米浆,硫酸铵,磷酸二氢钾,碳酸钙、氢氧化钠
3)试验菌种名称,培养基
1.菌种:丙酮丁醇梭状芽孢杆菌
2.培养基:发酵培养基
① 玉米培养基
② 葡萄糖培养基
4)实验步骤
1.丙酮丁醇梭状芽孢杆菌发酵培养基配制
玉米培养基:一大组配2大瓶(每瓶300mL)(共6小组) 每瓶(18g玉米粉+300mL自来水)
电炉煮沸
灭菌:用10层纱布包裹瓶口,牛皮纸、细线密封。121℃,30min。同时每小组放2个50mL试管(用牛皮纸包裹)一起灭菌
2.接种
在无菌操作台上,将种子液上清液倒出,下部细胞搅匀分装。再倒入灭菌好的玉米培养基,于沸水中煮沸2min(热激活),在自来水管下迅速冷却至常温
3.抽真空,培养
接种好的试管一起放入真空干燥器抽真空,然后连同真空干燥器一起放入恒温培养箱中,37℃静置培养。
5月28号
观察丙酮丁醇梭状芽孢杆菌发酵情况:两个试管中都有泡盖部分形成,有气泡产生。
其他组:有些只有气泡,没有泡盖形成,有些组部分形成泡盖
5月29号
1.挑泡盖 【见图六】
两个试管培养基中都有明显泡盖形成,于无菌操作台中将发酵培养基上的泡盖挑出,继续培养。
其他组:所有组都有明显的泡盖形成,统一于无菌操作台挑出泡盖。
2.油镜观察
在无菌操作台上,用接种环挑取试管A底部菌体(勿挑到培养基),涂片于涂有生理盐水的载玻片上,用酒精灯烘干固定,油镜观察【见图七】
5月30号
1.油镜观察
在无菌操作台上,用接种环挑取试管A底部的菌体,涂布滴生理盐水的载玻片上,在酒精灯上烘干固定,染色2min,洗去染液,用油镜观察【见图八】
6月5号
1. 葡萄糖培养基配制
葡萄糖18g, 1.8g 玉米浆3,0g
1.8g 玉米浆3,0g  0.12g 将上述四种用150mL溶解,
0.12g 将上述四种用150mL溶解,
 1.8g 用150mL水尽量溶解(可在电炉上加热),PH 要求7.0.
1.8g 用150mL水尽量溶解(可在电炉上加热),PH 要求7.0.
滴加了4滴NaOH, 封口,灭菌(一起灭菌的还有空的对照组和空的锥形瓶,都用纱布、牛皮纸盒细线密封)121℃,30min
2.接种培养
在无菌操作台上,将5.30号厌氧发酵A中上清液倒入一空试管,底部的孢子倒入上午灭菌的空锥形瓶里,再将上午灭菌好的葡萄糖培养基倒入装有孢子的锥形瓶中,从中取5mL于离心管中测吸光值(0号样),完后,封口,置于沸水中热激活2min,迅速用冷水冷却,抽真空,放入恒温箱32℃培养 (时间:16:26)
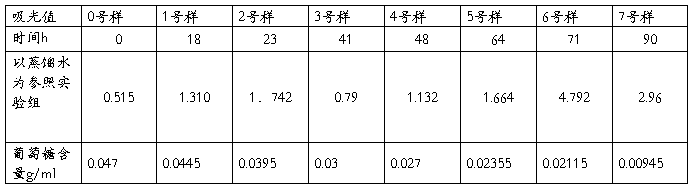
3.测上一条离心管中样液在600nm处的吸光值 α=0.515
4.测葡萄糖消耗量
将上述离心管离心5min,3500rpm,在生物传感分析仪测葡萄糖消耗量
取1mL上清液,加99mL蒸馏水,即稀释100倍,测得葡萄糖含量为47mg/dL
6月6号
1. 将6.5号下午做的丙酮丁醇发酵培养液取样5mL,测吸光值,此为1号样
对照组取5ml,测吸光值。
以蒸馏水为对照, 实验组α=1.310,对照组α=o.285
以对照组为参照。 实验组α=1.029 (时间:10:01)
2.重复上午丁醇发酵试验的取样步骤,制丁醇2号样 (时间15:31)
以蒸馏水为对照, 实验组α=1.742 对照组α=0.240
以对照组为参照。 实验组α=1.469 (时间:15:31)
从实验组中取1ml,加入蒸馏水49ml,测葡萄糖消耗量
测得的葡萄糖含量:第一次:80mg/dL,第二次:78mg/dL (时间:16:56)
6月7号
1.取丙酮丁醇的发酵液5ml,制丁醇3号样 (时间:9:30)
对照组取5ml,测吸光值。
以蒸馏水为对照, 实验组α=0.699,对照组α=0.368 稀释2倍后,实验组α=0.395
对照组α=0.204
以对照组为对照,实验组α=0.331 稀释2倍后,实验组α=0.190 稀释前时间为9:50 稀释后时间为10:02
将实验组离心后,去上清液1ml,加蒸馏水稀释50倍,测葡萄糖含量:第一次60mg/dL
第二次:60mg/dL ( 时间10:32)
2.取丙酮丁醇的发酵液5ml,制丁醇4号样(时间:9:30)
对照组取5ml,测吸光值。
以蒸馏水为对照, 实验组α=0.840,对照组α=0.268 稀释2倍后,实验组α=0.561
对照组α=0.132
以对照组为对照,实验组α=0.651 稀释2倍后,实验组α=0.427 稀释前时间为9:50 稀释后时间为10:02
将实验组离心后,去上清液1ml,加蒸馏水稀释50倍,测葡萄糖含量:第一次67mgdL
第二次:68mg/dL (时间 17:07)
6月8号
1.取丙酮丁醇的发酵液5ml,制丁醇5号样(时间:8:51)
实验组稀释4倍后α=0.416 (时间:9:07)
将实验组离心后,去上清液1ml,加蒸馏水稀释30倍,混合均匀后,测葡萄糖含量:第一次77mg/dL 第二次:79mg/dL (时间9:55)
2.取丙酮丁醇的发酵液5ml,制丁醇6号样(时间:15:51)
实验组稀释8倍后α=0.599(时间:16:09)
将实验组离心后,去上清液1ml,加蒸馏水稀释30倍,混合均匀后,测葡萄糖含量:第一次70mg/dL 第二次:71mg/dL (时间16:44)
6月9号
1.取丙酮丁醇的发酵液5ml,制丁醇7号样(时间:10:46)
实验组稀释8倍后α=0.370(时间:10:51)
将实验组离心后,去上清液1ml,加蒸馏水稀释30倍,混合均匀后,测葡萄糖含量:第一次32mg/dL 第二次:31mg/dL (时间16:35)
2.从冰箱里取出丁醇上清液[A试管中倒入39ml(全部),B试管中倒入36ml(剩5ml,倒入离心管中在3500rpm下离心5min,上清液倒掉,用接种环挑去下部孢子,制片观察孢子形态)共75ml。倒入圆底烧瓶进行蒸馏。蒸馏出馏分62ml,(体积大约为总体积的4/5)将此馏分装于150ml的锥形瓶中,套上橡皮塞。
【蒸馏装置见图九、图十】
3.制片,用油镜观察芽孢形态。
先用接种环挑取上述二中处理过的芽孢于干净的载玻片上,置于酒精灯上固定,固定好后用孔雀绿染色,并在火焰上固定,固定过程中要滴加孔雀绿保持湿润,不能烤干,十分钟后用蒸馏水洗净,动作要轻,以免将菌体冲洗干净,再用番红复染,静置一分钟,在用蒸馏水洗净。滴加香柏油,置于载物台上,用油镜观察。【见图十一、十二】
6月10号
取蒸馏液0.5ml,加入0.2ml 2%的叔戊醇,在加60%的酒精定容至10ml,用玻璃棒搅拌均匀后,上气相色谱仪。分析图谱见附录
5)实验结果(见附录)
丁醇含量×20×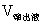 /
/ =0.1003×20×62/75=1.66g/100ml
=0.1003×20×62/75=1.66g/100ml
6)实验结果分析
鉴于客观因素每组都相同,因此结果不同可能是主观原因,比如培养基成分漏加,错加,重复加;取样时所取菌种的量不同;观察时间和取样时间不同;观察时显微镜操作方式不同;制片操作手法不同;稀释倍数不同;调pH值时,有的加了NaOH,有的未加,加了的加的滴数不同等等。
(三)试验对动手能力培养的收获及试验中获得的经验教训建
这是我做的第一次为期这么长时间的的实验。在做实验前,我以为这会是一个很难做的实验,和以前那种半天就可以完事,做完实验然后两下子就可以将实验报告做完的实验不一样。但当我真的着手去做时才发现也没有那么难,都是我自己吓自己吧了。
不管难与易,在做实验前,一定要先把老师发的讲义大概看一遍,了解实验的大概方向,当老师讲解时一定要认真听,虽然老师分给我们四个人一个小组,但是只有每个人都了解清楚了,我们的小组才能配合的更加默契,我们的速度才会更快,实验结果才会更加令人满意。这次实验让我体会到作为一个团队齐心协力,默契很重要。另外做实验时,一定要亲力亲为并且弄清楚每一个环节,弄明白。生物实验特别要注意操作,操作一定要规范,严格要求自己要用科学严谨的态度对待实验,因为生物实验与其他的化学实验物理实验不同特别要注意不能染菌,接种时一定要在无菌操作台进行,勤消毒灭菌。这次实验让我见识到了一些以前没有见过或不曾亲手操作过的仪器如生物传感器,摇床,气相色谱仪等等。增长的我许多见识及动手操作能力,希望下次还有机会做这样的实验。
附录





丙酮丁醇馏出液气相色谱图

峰号 峰名 保留时间 峰高 峰面积 含量
1 0.398 202.514 1190.450 0.0000
2 丙酮 1.590 2187.840 4124.950 0.0390
3 1.798 38.394 85.664 0.0000
4 乙醇 1.982 1491087.625 7747798.500 0.6363
5 叔戊醇 2.307 5998.846 11323.800 0.0000
6 2.523 142.500 213.200 0.0000
7 丁醇 3.848 5002.869 15155.700 0.1003
-
工程测试技术实验报告
工程测试实验报告学号姓名实验一电阻应变片的粘贴与应用单臂电桥性能实验一实验目的了解金属箔式应变片的应变效应单臂电桥工作原理和性能二…
-
《土木工程实验(一)》实验报告
姓名:报名编号:学习中心:江苏泰州兴化奥鹏学习中心层次:高起专专业:建筑工程技术实验一:水泥实验一、实验目的:1、学习水泥性质检验…
-
人因工程实验报告
实验一一实验目的BDII302型双手调节器通过双手调节器的操作学习绘制练习曲线二仪器简介1有两个摇把控制的和铅笔类似的针一个两个摇…
- 需求工程实验报告
-
系统工程实验报告
系统工程实验报告授课老师指导老师班级姓名学号实验一简单库存模型1结果如下简易库存结果模型实验二二阶库存系统1结果如下简易库存结果模…
-
开放性实验报告
开放性实验报告题目:函数信号发生器的设计专业:通信工程学生姓名:班级学号:指导老师:日期:20##/12/26一.设计内容:采用集…
-
开放性实验报告
开放性实验报告实验名称机构创新组合与设计开放性实验院系机械与材料工程学院专业机械与材料工程学院班级学号学生姓名指导老师起止时间20…
-
综合性设计性实验报告格式
综合性设计性实验报告实验课程传感器与检测技术姓名班级指导教师实验日期20xx1224实验六位移检测传感器应用一实验类型综合性实验二…
-
综合性实验报告(咖[1]..1
广州大学化学化工学院本科学生综合性实验报告实验课程实验项目药物的合成和鉴定专业班级学号姓名指导教师及职称开课学期实验时间药物合成与…
- 学生探究性实验报告格式
-
电子工艺设计实验报告及心得体会
姓名:高桥一、实验目的1.掌握电烙铁的使用方法2.掌握手工焊接技术3.完成八路抢答器二.实验器材:电烙铁,松香,万能板,导线,镊子…