溶液法测定极性分子的偶极矩实验报告
结构化学实验报告
——溶液法测定极性分子的偶极矩
一、实验目的
1.用溶液法测定正丁醇的偶极矩
2.了解偶极矩与分子电性质的关系
3.掌握溶液法测定偶极矩的实验技术
二、实验原理
1.偶极矩与极化度
(1)两个大小相等方向相反的电荷体系的偶极矩定义为:

(2)极化程度可用摩尔定向极化度P定向来衡量:
P定向=4/3πNA*μ02/(3kT)=4/9πNA*μ02/(kT)
(3)极性分子所产生的摩尔极化度P是摩尔定向极化度、摩尔电子诱导极化度和摩尔原子诱导极化度的总和:
P=P定向+P诱导=P定向+P电子+P原子
2.偶极矩的测定方法(溶液法测定偶极矩)
(1)无限稀释时溶质的摩尔极化度的公式:
P=P2∞=3αε1/(ε1+2)2 * Μ1/ρ1 + (ε1-1)/(ε1+2) * (Μ2-βΜ1)/ρ1
(2)习惯上用溶质的摩尔折射度R2表示高频区测得的摩尔极化度,因为此时P定向=0,P原子=0,推导出无限稀释时溶质的摩尔折射度的公式:
P电子=R2∞=n2-1/(n12+2) * (Μ2-βΜ1)/ρ1+6n12Μ1γ/[(n12+2)2*ρ1]
(3) 近似公式:
ε溶=ε1(1+α* x2)
ρ溶=ρ1(1+β*x2)
n溶=n1(1-γ*x2)
(4) 永久偶极矩的获得
考虑到摩尔原子诱导极化度通常只有摩尔电子极化度的5%-15%,而且P定向又比P原子大得多,故常常忽略P原子,可得P定向=P2∞-R2∞=4/9πNA*μ02/(kT)
μ0=0.0128*[(P2∞-R2∞)*T]1/2
(5)介电常数的测定:用空气与一已知介电常数ε溶的标准物质分别测得电容C/空 ,C/标
C/空=C空+Cd= C0+Cd C/标=C标+Cd
则通过上两式可求得C0=(C/标-C/空)/(ε标-1) Cd=C/空-C0=C/空-(C/标-C/空)/(ε标-1)
ε溶= C溶/ C0=(C/溶- Cd)/ C0
三、仪器和试剂
仪器:阿贝折光仪1台;比重管1只;电容测量仪一台;电容池一台;电子天平一台;电吹风一只;25ml容量瓶4支;25ml、5ml、1ml移液管各一支;滴管5只;5ml针筒一支;针头一支;吸耳球一个;
试剂:正丁醇(分析纯);环己烷(分析纯);蒸馏水;丙酮
四、实验步骤
1.溶液的配制
配制4种正丁醇的摩尔分数分别是0.05、0.10、0.15、0.20的正丁醇-环己烷溶液。操作时应注意防止溶质和溶剂的挥发以及吸收极性较大的水气,为此溶液配好后应迅速盖好瓶盖,并置于干燥箱中。
2.折光率的测定
在恒温(25±0.10C)条件下用阿贝折光仪测定环己烷和各配制溶液的折光率。测定时注意各样品需加样三次,每次读取一个数据,取平均值。
3.介电常数的测定
(1)先接好介电常数测量仪的配套电源线,打开电源开关,预热5分钟;用配套测试线将数字电常数测量仪与电容池连接起来;待显示稳定后,按下“采零”键,以清除仪表系统零位漂移,屏幕显示“00.00”。
(2)电容C0 和Cd 的测定:本实验采用环己烷为标准物质,其介电常数的温度公式为: ε标=2.203-0.0016(t-20)
式中t为实验室温度(0C)。用电吹风将电容池加样孔吹干,旋紧盖子,将电容池与介电常数测量仪接通。读取介电常数测量仪上的数据。重复三次,取平均值。用移液管取1ml纯环己烷加入电容池的加样孔中,盖紧盖子,同上方法测量。倒去液体,吹干,重新装样,用以上方法再测量两次,取三次测量平均值。
(3)溶液电容的测量:测定方法与环己烷的测量方法相同。每个溶液均应重复测定三次,三次数据差值应小于0.05pF,所测电容读数与平均值,减去Cd,即为溶液的电容C溶。由于溶液易挥发而造成浓度改变,故加样时动作要迅速,加样后迅速盖紧盖子。
4.溶液密度的测定
取干净的比重管称重m0。然后用针筒注入已恒温的蒸馏水,定容,称重,记为m1。用丙酮清洗并吹干。同上,测量各溶液,记为m2 。则环己烷和各溶液的密度为:
ρ溶=(m2-m0)/(m1-m0) *ρ水 ,ρ25℃水=0.99707g/mL
5.清洗、整理仪器
上述实验步骤完成后,确认实验数据的合理性。确认完毕,将剩余溶液回收,容量瓶、比重管、针筒洗净、吹干。整理实验台,仪器恢复实验前的摆放。
五、数据记录和处理
1. 溶液的配制

2.折光率的测定
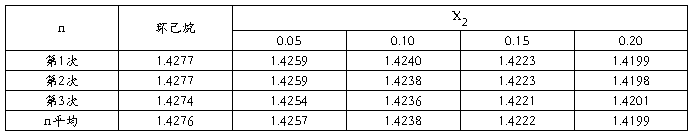
由上图可知:n1=1.4276
γ=0.0378/1.4276=0.0265
3.介电常数的测定

t=17.8℃ ε标=2.203-0.0016(t-20)=2.207
C0=(C/标-C/空)/(ε标-1)=(5.48-5.24)/(2.207-1)=0.199
Cd=C/空-C0=5.24-0.199=5.04
由ε溶=(C/溶- Cd)/ C0 ,可算出:
ε(环己烷)=2.207
ε(0.05)=2.66
ε(0.10)=2.56
ε(0.15)=3.16
ε(0.20)=2.86
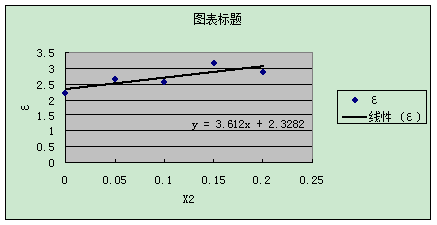
由上图可知:ε1=2.3282
α=3.612/2.3282=1.551
4.溶液密度的测定
m0=25.0273
m1=28.4069
m2(环己烷)=27.6384
m2(0.05)=27.6410
m2(0.10)=27.6457
m2(0.15)=27.6470
m2(0.20)=27.6491
由ρ溶=(m2-m0)/(m1-m0) *ρ水,可算出:
ρ(环己烷)=0.7726
ρ(0.05)=0.7734
ρ(0.10)=0.7748
ρ(0.15)=0.7752
ρ(0.20)=0.7758
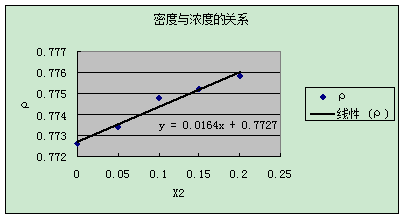
由上图可知:ρ1=0.7727
β=0.0164/0.7727=0.0212
5.求P2∞、R2∞
P2∞=3αε1/(ε1+2)2 * Μ1/ρ1 + (ε1-1)/(ε1+2) * (Μ2-βΜ1)/ρ1
=91.71
R2∞=(n12-1)/(n12+2) * (Μ2-βΜ1)/ρ1 + 6n12Μ1γ/[(n12+2)2*ρ1]
=26.23
6.求偶极矩μ0(当时温度为17.80C)
μ0=0.0128*[(P2∞-R2∞)*T]1/2=0.0128*[(91.71-26.23)*290.8]1/2
=1.77
六、分析讨论
1.分析本实验误差的主要来源,如何改进?
答:(1)溶液的配制:移液管使用过程中量取溶液并不十分精确,会导致溶液配置的时候X2的值与要求值有一定的偏差。所以,在移液的过程中要保证移液管使用操作迅速准确。
(2)折光率的测定:折光率的线性还比较好,测量中除了取样,试剂瓶盖子应随时盖好.以免样品挥发影响溶液浓度。而且样品滴加要均匀,用量不能太少,以免测量不准确。
(3)介电常数的测定:仪器不是很稳定,而且并未用移液管移取1mL,而是用每种溶液的专用滴管吸取50滴,滴管的构造不一样,也导致了移取的样品量不一致,这是造成介电常数与浓度关系的线性很差的两个原因。应该用同一个移液管准确移取,且每次都要用丙酮洗净用待测液润洗,而且在重新装样前,为了证实电容池电极间的残余液确已除净,须先测量空气的电容值,待空气的电容值恢复到测量之前,或者在±0.05pF的误差范围内,方可进行下一次测量。
(4)溶液密度的测定:因为电子天平非常灵敏,当有电吹风在吹或稍有动静时,读数就变得很厉害,两次测量的数据都会很不一样,所以每个样品测了两次,取了比较合理的数据。减小误差的方法是确保每次装样品前比重管都要洗净吹干(内外管壁都是),溶液要装满比重管,且外壁不能沾溶液,测量的环境要尽可能安静。
2.本实验中,为什么要将被测的极性物质溶于非极性的溶剂中配成稀溶液?
答:因为溶液法的基本想法是,在无限稀释的非极性溶剂的溶液中,溶质分子所处的状态和气态时相近,于是无限稀释的溶液中就可以使用如下稀溶液的近似公式:
ε溶=ε1(1+α* x2)
ρ溶=ρ1(1+β*x2)
n溶=n1(1-γ*x2)
从而可以推导出无限稀释时溶质的摩尔极化度及摩尔折射度的公式,最终得到永久偶极矩。
3.根据实验结果,判断正丁醇的对称性(所属点群)。
答:由于正丁醇具有永久偶极矩,且只有属于Cn、Cnv(包括Cs)点群的分子才具有永久偶极矩,所以正丁醇所属点群为C1 。
第二篇:稀溶液法测定极性分子的偶极矩0109
稀溶液法测定极性分子的偶极矩
一、实验目的
1. 掌握溶液法测定偶极矩的原理、方法和计算。
2. 熟悉小电容仪、折射仪和比重瓶的使用。
3. 测定正丁醇的偶极矩,了解偶极矩与分子电性质的关系。
二、实验原理
1. 分子的极性
分子是由带正电荷的原子核和带负电荷的电子组成的。分子呈电中性,但因空间构型的不同,正负电荷中心可能重合,也可能不重合,前者为非极性分子,后者称为极性分子,分子极性大小用偶极矩μ来度量,其定义为
μ=qd (1)
式中:q为正、负电荷中心所带的电荷量,单位是C;d是正、负电荷中心的距离,单位是m。μ是偶极矩,单位是(SI制)库[仑]米(C·m)。而过去习惯使用的单位是德拜(D):
1D =1×10-18静电单位·厘米=3.338×10-30C·m
在不存在外电场时,非极性分子虽因振动,正负电荷中心可能发生相对位移而产生瞬时偶极矩,但宏观统计平均的结果,实验测得的偶极矩为零。极性分子具有永久偶极矩,由于分子热的运动,偶极矩在空间各个方向的取向几率均等,统计值等于零。若将极性分子置于均匀的外电场中,分子将沿电场方向转动,同时还会发生电子云对分子骨架的相对移动和分子骨架的变形,称为极化。极化的程度用摩尔极化度P来度量。分子因转向而极化的程度用摩尔转向极化度P转向来表示,因变形而极化的程度用摩尔变形极化度P变形来表示。而P变形又由P电子 (电子极化度)和P原子 (原子极化度)两部分组成,于是有
P =P转向+P变形=P转向+(P电子+P原子) (2)
P转向与永久偶极矩的平方μ2的值成正比,与热力学温度T成反比: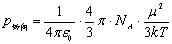 (3)
(3)
式中:NA为阿佛加德罗(Avogadro)常数;k为玻耳兹曼(Boltzmann)常数。
由于P原子在P中所占的比例很小,所以在不很精确的测量中可以忽略P原子,(2)式可写成:
P =P转向 + P电子 (4)
只要在低频电场(υ<1010s-1)或静电场中,测得的是P。在中频电场(υ=1012~1014s-1) (红外频率)时,极性分子的转向运动跟不上电场的变化,故P转向=0,P =P变形=P电子+P原子。在高频电场(υ≈1015s-1)(紫外可见光)中,由于极性分子的转向和分子骨架变形跟不上电场的变化,故P转向=0,P原子=0,所以测得的是P电子。此时电子极化度可以用摩尔折射度R代替。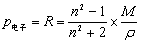
因此,分别在低频和中频电场下测出分子的摩尔极化度,两者相减即可得到P转向,再由(3)式计算μ。
通过测定偶极矩,可以了解分子中电子云的分布和分子对称性,判断几何异构体和分子的立体结构。
2. 极化度与偶极矩
摩尔极化度P与介电常数ε之间的关系为
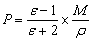 (5)
(5)
式中:M为待测物质的摩尔质量(g·mol-1);ρ为待测物质的密度(g·cm-3);ε为介电常数。
2. 溶液法测定偶极矩
所谓溶液法就是将极性待测物溶于非极性溶剂中进行测定,然后外推到无限稀释。因为在无限稀的溶液中,极性溶质分子所处的状态与它在气相时十分相近,此时分子的摩尔极化度就可视为(5)的P。
在稀溶液当中,溶液的摩尔极化度P可用下式求出:
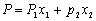 (1-溶剂,2-溶质,x-摩尔分数)
(1-溶剂,2-溶质,x-摩尔分数)
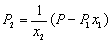 (6)
(6)
将(5)式代入(6)得
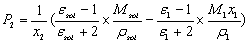
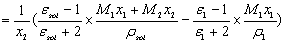 (7)
(7)
式中:sol代表溶液,ε1,M1,ρ1分别是溶剂的相对介电常数、摩尔质量和密度。M2为溶质摩尔质量。
为了省去溶液密度的测量,经Guggenheim和Smith的简化与改进,得到如下公式:

d1为溶剂的密度。
分子的偶极矩可按下式计算:
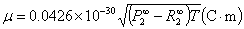 (7)
(7)
式中,P∞2和R∞2分别表示无限稀时极性分子的摩尔极化度和摩尔折射度(习惯上用摩尔折射度表示折射法测定的P电子);T是热力学温度。
本实验是将正丁醇溶于非极性的环己烷中形成稀溶液,然后在低频电场中测量溶液的介电常数和溶液的密度求得P∞2;在可见光下测定溶液的R∞2,然后由(5)式计算正丁醇的偶极矩。
(1) 极化度的测定
无限稀时,溶质的摩尔极化度P∞2的公式为
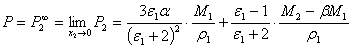 (6)
(6)
式中,ε1、ρ1、M1分别是溶剂的介电常数、密度和相对分子质量,其中密度的单位是g·cm-3;M2为溶质的相对分子质量;α和β为常数,可通过稀溶液的近似公式求得:
ε溶= ε1(1+αx1) (7)
ρ溶=ρ1(1+βx2) (8)
式中,ε溶和ρ溶分别是溶液的介电常数和密度;x2是溶质的摩尔分数。
无限稀释时,溶质的摩尔折射度R∞2的公式为
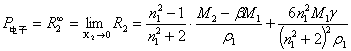 (9)
(9)
式中,n1为溶剂的折射率;γ为常数,可由稀溶液的近似公式求得:
n溶=n1(1+γx2) (10)
式中,n溶是溶液的折射率。
(2) 介电常数的测定
介电常数ε可通过测量电容来求算
ε = C/C0 (11)
式中,C0为电容器在真空时的电容;C为充满待测液时的电容,由于空气的电容非常接近于C0,故(11)式改写成
ε=C/C空 (12)
 本实验利用电桥法测定电容,其桥路为变压器比例臂电桥,如图1所示,电桥平衡的条件是
本实验利用电桥法测定电容,其桥路为变压器比例臂电桥,如图1所示,电桥平衡的条件是

式中,C′为电容池两极间的电容;CS为标准差动电器的电容。调节差动电容器,当C′=CS时,uS=uX,此时指示放大器的输出趋近于零。CS可从刻度盘上读出,这样C′即可测得。由于整个测试系统存在分布电容,所以实测的电容C′是样品电容C和分布电容Cd之和,即
C′=C +Cd (13)
显然,为了求C首先就要确定Cd值,方法是:先测定无样品时空气的电空C′空,则有
C′空 =C空+ Cd (14)
再测定一已知介电常数(ε标)的标准物质的电容C′标,则有
C′标 = C标+Cd=ε标C空+ Cd (15)
由(14)和(15)式可得:
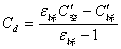 (16)
(16)
将Cd代入(13)和(14)式即可求得C溶和C空。这样就可计算待测液的介电常数。
三、仪器与试剂
小电容测量仪1台;阿贝折射仪1台;超级恒温槽2台;电吹风1只;比重瓶(10mL,1只);滴瓶5只;滴管1只。
环己烷(A.R.);正丁醇摩尔分数分别为0.04,0.06,0.08,0.10和0.12的五种正丁醇—环己烷溶液。
四、实验步骤
1. 折射率的测定
在25℃条件下,用阿贝折射仪分别测定环己烷和五份溶液的折射率。
2. 密度的测定
在25℃条件下,用比重瓶分别测定环己烷、正丁醇和五份溶液的密度。
3. 电容的测定
(1) 将PCM-1A精密电容测量仪通电,预热20min。
(2) 将电容仪与电容池连接线先接一根(只接电容仪,不接电容池),调节零电位器使数字表头指示为零。
(3) 将两根连接线都与电容池接好,此时数字表头上所示值既为C′空值。
(4) 用2mL移液管移取2mL环己烷加入到电容池中,盖好,数字表头上所示值即为C′标
(5) 将环己烷倒入回收瓶中,用冷风将样品室吹干后再测C′空值,与前面所测的C′空值应小于0.05pF,否则表明样品室有残液,应继续吹干,然后装入溶液,同样方法测定五份溶液的C′溶。
五、注意事项
1.每次测定前要用冷风将电容池吹干,并重测C′空,与原来的C′空值相差应小于0.01pF。严禁用热风吹样品室。
2.测C′溶时,操作应迅速,池盖要盖紧,防止样品挥发和吸收空气中极性较大的水汽。装样品的滴瓶也要随时盖严。
3.每次装入量严格相同,样品过多会腐蚀密封材料渗入恒温腔,实验无法正常进行。
4.要反复练习差动电容器旋钮、灵敏度旋钮和损耗旋钮的配合使用和调节,在能够正确寻找电桥平衡位置后,再开始测定样品的电容。
5.注意不要用力扭曲电容仪连接电容池的电缆线,以免损坏。
六、数据处理
1. 将所测数据列于表中。
2. 根据(16)和(14)计算Cd和C空。其中环己烷的介电常数与温度t的关系式为:ε标=2.023-0.0016(t-20)。
3. 根据(13)和(12)式计算C溶和ε溶。
4. 分别作ε溶—x2图,ρ溶—x2图和n溶—x2图,由各图的斜率求α,β,γ。
5. 根据(6)和(9)式分别计P ∞ 2 和R ∞ 2 。
6. 最后由(5)式求算正丁醇的μ。
七、思考题
1. 本实验测定偶极矩时做了哪些近似处理?
2. 准确测定溶质摩尔极化度和摩尔折射度时,为何要外推到无限稀释?
3. 试分析实验中误差的主要来源,如何改进?
-
偶极矩的测定实验数据处理
偶极距测定数据处理T29705KP10206KPa1折光率的测定数据处理如下加上x015时候的数据会使得线性不好故舍去该组数据由数…
-
溶液法测定极性分子的偶极矩实验报告
实验日期08年3月27日结构化学实验报告溶液法测定极性分子的偶极矩一实验目的1用溶液法测定正丁醇的偶极矩2了解偶极矩与分子电性质的…
-
物理化学实验报告_偶极矩
华南师范大学实验报告课程名称结构实验实验项目稀溶液法测定偶极矩实验类型验证设计综合实验时间20xx年11月20日一实验名称稀溶液法…
-
稀溶液法测定偶极矩实验报告
稀溶液法测定偶极矩实验目的123测定正丁醇的偶极矩1偶极矩与极化度分子结构可以近似地看成是由电子云和分子骨架原子核及内层电子所构成…
-
稀溶液法测定偶极矩实验报告(华南师范大学物化实验)
稀溶液法测定偶极矩一实验目的1掌握溶液法测定偶极矩的主要实验技术2了解偶极矩与分子电性质的关系3测定正丁醇的偶极矩二实验原理21偶…
-
钻井液中固相含量的测定实验报告
中国石油大学油田化学实验报告实验日期成绩班级学号姓名教师同组者实验四钻井液中固相含量的测定一实验目的1掌握固相含量测定仪的操作方法…
-
最大泡压法测定溶液的表面张力实验报告
物理化学实验报告20xx年02月21日总评姓名学校陕西师范大学年级20xx级专业材料化学室温100大气压100kpa一实验名称最大…
-
水溶液电化学稳定窗口的测定实验报告
一实验目的1理解电位窗口的意义2掌握阴极极化曲线和阳极极化曲线的使用方法3测量玻碳电极在酸性中性和碱性溶液中的阳极和阴极极化曲线二…
-
EDTA标准溶液的配制和标定及铅、铋混合液中铅、铋含量的连续测定
EDTA标准溶液的配制和标定及铅铋混合液中铅铋含量的连续测定摘要在EDTA标准溶液的配制和标定实验中学习EDTA标准溶液的配制和标…
-
07实验七 铅、铋混合液中铅、铋含量的连续测定定-教案
实验七铅铋混合液中铅铋含量的连续测定教案课程名称分析化学实验B教学内容以二甲酚橙为指示剂连续测定铅铋混合液中铅铋含量实验类型验证教…
-
分光计测玻璃折射率实验报告
西安理工大学实验报告实验目的1了解分光计的结构掌握调节和使用分光计的方法2掌握测定棱镜角的方法3用最小偏向角法测定棱镜玻璃的折射率…