1.3 有机化学实验预习、记录和实验报告
1.3 有机化学实验预习、记录和实验报告
一、预习笔记
实验前做好充分的准备工作是十分重要的。在做一个实验前学生必须仔细阅读有关的教材(实验的原理、步骤和用到的实验技术),查阅手册或其他参考书。要做到:弄懂这次实验要做什么,怎样做,为什么这样做,不这样做行不行,还有什么方法等。对所用的仪器装置做到能叫出每件仪器的名称,了解仪器的原理、用途和正确的操作方法,可否用其他仪器代替等。并在实验记录本上写好预习笔记。
合成实验的预习笔记包括以下内容:
(l) 实验目的;
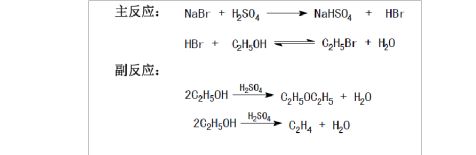
(2) 主反应和重要的副反应的平衡方程式;
3) 原料、产物和副产物的物理常数;
(4) 原料用量(克、毫升、摩尔),计算过量试剂的过量百分数,计算理论产量;
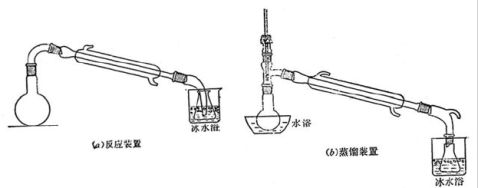
(5) 正确而清楚地画出仪器装置图;
(6) 用图表形式表示整个实验步骤的流程。
二、实验记录
每个学生都必须准备一本实验记录本,并编上页码,不能用活页本或零星纸张代替。不准撕下记录本的任何一页。如果写错了,可以用笔勾掉,但不得涂抹或用橡皮擦掉。文字要简练明确,书写整齐,字迹清楚。写好实验记录是从事科学实验的一项重要训练。
在实验过程中,实验者必须养成一边进行实验一边直接在记录本上作记录的习惯,不允许事后凭记忆补写,或以零星纸条暂记再转抄。记录的内容包括实验的全部过程,如加入药品的数量,仪器装置,每一步操作的时间、内容和所观察到的现象(包括温度、颜色、体积或质量的数据等)。记录要求实事求是,准确反映真实的情况,特别是当观察到的现象和预期的不同,以及操作步骤与教材规定的不一致时,要按照实际情况记录清楚,以便作为总结讨论的依据。其他各项,如实验过程中一些准备工作,现象解释,称量数据,以及其他备忘事项,可以记在备注栏内。应该牢记,实验记录是原始资料,科学工作者必须重视。
三、试剂的过量百分数、理论产量和产率的计算
在进行一个合成实验时,通常并不是完全按照反应方程式所要求的比例投入各原料,而是增加某原料的用量。究竟过量使用哪一种物质,则要根据其价格是否低廉,反应完成后是否容易去除或回收,能否引起副反应等情况来决定。
在计算时,首先要根据反应方程式找出哪一种原料的相对用量最少,以它为基准计算其他原料的过量百分数。产物的理论产量是假定这个作为基准的原料全部转变为产物时所得到的产量。由于有机反应常常不能进行完全,有副反应,以及操作中的损失,产物的实际产量总比理论产量低。通常将实际产量与理论产量的百分比称为产率。产率的高低是评价一个实验方法以及考核实验者的一个重要指标。
四、总结讨论
做完实验以后,除了整理报告,写出产物的产量、产率、状态和实际测得的物性,如沸程、熔程等数据,以及回答指定的问题,还要根据实际情况就产物的质量和数量,实验过程中出现的问题等进行讨论,以总结经验和教训。这是把直接的感性认识提高到理性思维的必要步骤,也是科学实验中不可缺少的一环。 实验记录本示例
实验二溴乙烷的制备
实验目的
(1) 学习从醇制备溴代烷的原理和方法;
(2) 学习蒸馏装置和分液漏斗的使用方法。
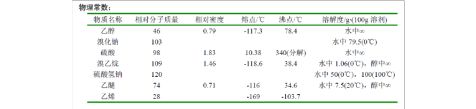
物理常数:
仪器装置图:

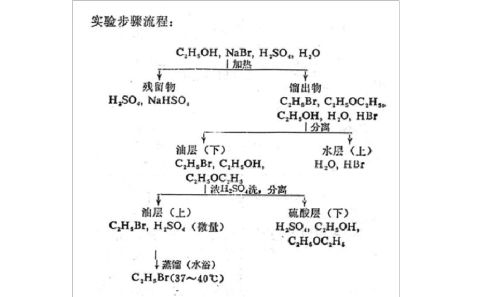
实验记录:
产物:溴乙烷,无色透明液体,沸程38?39.5°C,产量10g,产率73%。
讨论:
本次实验的产物产量和质量基本上合格。加浓硫酸洗涤时发热,表明粗产物中乙醚,乙醇或水分过多。这可能是反应时加热太猛,使副反应增加。另外,也可能由于从水中分出粗油层时,带了一点水过来。溴乙烷沸点很低,硫酸洗涤时发热使一部分产物挥发损失。

第二篇:有机化学实验实验报告六
乙 酰 乙 酸 乙 酯 的 制 备
一. 实验目的
1. 了解Claisen缩合反应实验技术(无水操作)
2. 掌握金属钠的粉碎处理
3. 进一步熟悉减压蒸馏操作技术和阿贝折光仪的使用
二. 实验试剂及其物理常数
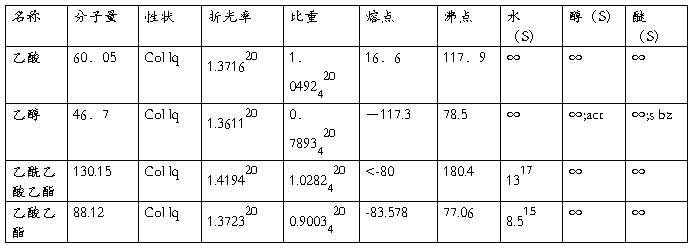
乙酸乙酯25g(27.5ml,0.38mol), 金属钠2.60g, 二甲苯12.5ml, 30%醋酸溶液, 饱和氯化钠溶液, 无水硫酸钠
三. 实验装置图
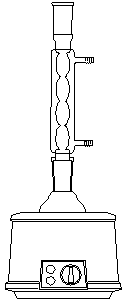
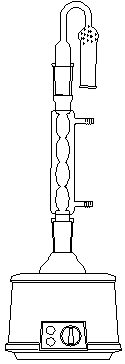
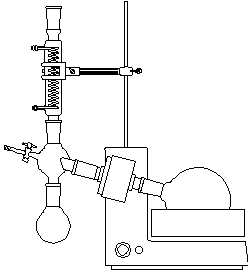
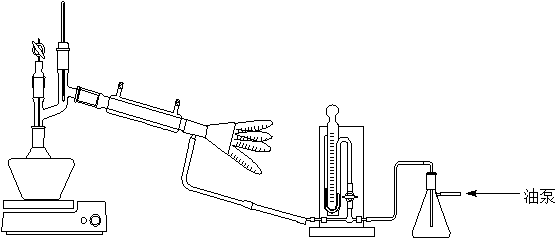
四. 实验原理和实验步骤
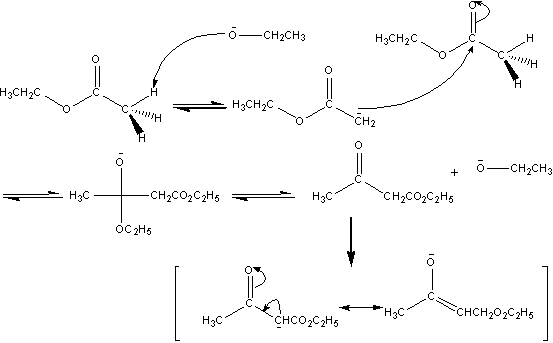
从反应原理可以看出,乙酸乙酯必须绝对干燥,但其中应含有1%~2%的乙醇。

五. 产率计算和实验讨论
产物质量为41.43-35.03=6.4g, 产率为43.5%(2.60g金属钠)
nD20=1.4184
本次实验最大的失误在于醋酸溶液加入过多,由于过量的醋酸会增加酯在水中的溶解度, 使产量下降.
烯醇是动力学控制产物,酮是热力学控制产物,延长反应时间,显然可以使产率提高。
六. 思考题
1. Claisen酯缩合反应的催化剂是什么?本实验为什么可以用金属钠代替?
答:Claisen酯缩合反应的催化剂为强碱性的醇钠。本实验中乙酸乙酯含1%~2%的乙醇,与钠反应生成CH3CH2Na,随反应进行产生乙醇,再生成CH3CH2Na,如此循环,故可用钠代替乙醇钠。
2. 本实验加入30%醋酸溶液和饱和氯化钠溶液的目的何在?
答:反应后生成乙酰乙酸乙酯的钠化物,因此,必须用醋酸酸化,才能使乙酰乙酸乙酯游离出来。用氯化钠洗去油层中的乙酸,醇钠,乙醇等,除去产物中的部分杂质。
-
有机化学实验预习报告模板
有机化学专业实验预习报告模板带气体吸收的回流装置分液蒸馏装置及操作四主要仪器及装置如回流装置加热套100mL圆底单口烧瓶球形冷凝管…
-
有机化学实验预习报告
南昌大学有机化学实验预习报告实验项目名称一实验目的二实验基本原理或主副反应式五实验装置图这部分请画在预习报告纸上六实验简单操作步骤…
-
有机化学实验预习报告(示例)
南昌大学预习实验报告示例实验项目名称阿司匹林的制备及物理常数测定一实验目的二实验基本原理或主副反应式五实验装置图用铅笔画1反应装置…
-
熔点测定 有机化学实验预习报告 2
南昌大学有机化学实验预习报告实验项目名称熔点的测定一实验目的1了解玻璃温度计的种类和校正方法2掌握熔点测定的意义和操作二实验基本原…
-
1.3 有机化学实验预习、记录和实验报告
13有机化学实验预习记录和实验报告一预习笔记实验前做好充分的准备工作是十分重要的在做一个实验前学生必须仔细阅读有关的教材实验的原理…
-
有机化学实验报告模板
有机化学实验报告专业班级学号姓名实验名称实验时间年月日学生姓名同组人姓名第一部分实验预习报告一实验目的二实验原理包括实验装置简图三…
-
有机化学实验预习报告模板
有机化学专业实验预习报告模板带气体吸收的回流装置分液蒸馏装置及操作四主要仪器及装置如回流装置加热套100mL圆底单口烧瓶球形冷凝管…
-
环己酮的制有机化学实验报告
实验学专班姓指导日机化学实验报告名称环己酮的制备业化学工程与工艺级名学号教师房江华李颖期有一实验目的1学习次氯酸氧化法制环己酮的原…
- 四川理工学院有机化学实验预习报告
-
丙酮与甲苯溶液的分离有机化学实验报告
丙酮与甲苯溶液的分离一实验目的1少量的丙酮与甲苯混合物的分离2掌握蒸馏和分馏的基本操作二实验原理1蒸馏纯粹的液态物质在大气压下都有…
-
化学实验报告格式
化学实验报告格式例一定量分析实验报告格式(以草酸中h2c2o4含量的测定为例)实验题目:草酸中h2c2o4含量的测定实验目的:学习…