高一化学必修2《元素周期表》知识点总结
高一化学必修2《元素周期表》知识点总结
知识回顾:
1、 原子的结构:
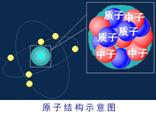
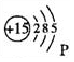
l 原子是由原子核和电子组成;原子核由质子和中子组成
l 原子的质量集中在原子核上,电子的质量很小,几乎可以忽略不计
l 一个质子带一个单位的正电荷,一个电子带一个单位的负电荷,中子不带电,所以原子对外显中性
2、 元素的定义:
具有相同核电荷数(质子数)的一类原子的总称
一、元素周期表的结构
1、原子序数
原子序数=核电荷数=质子数=核外电子数
2、周期
l 按原子序数递增的顺序,把电子层数相同的元素自左向右排成横行,每行叫做一个周期。
l 元素周期表共有七个周期,从上到下依次命名为第一周期、第二周期等
各周期内的信息表

3、族
l 按电子层数递增的顺序,把不同横行中最外层电子数相同的元素由上而下排成纵行,每一个纵行称为一个族.共18行
l 元素周期表共有十八个纵行,除8、9、10三个纵行叫第Ⅷ族外,其余每个纵行各为一个族,它们又被划分为十六个族。
l 族分为主族和副族,主族用罗马数字加“A”表示,如ⅠA族;副族用罗马数字加”B”来表示,如ⅡB。0族和Ⅷ族则不加“A”或“B”
各族内的信息如下表

注意:① 1,2行对应为ⅠA,ⅡA;13---17行对应为ⅢA---ⅦA
② 3---7行对应为ⅢB ---ⅦB;11,12行对应为ⅠB,ⅡB。
③ 8,9,10对应为Ⅷ
④ 18行对应0族
二、元素的性质与原子结构
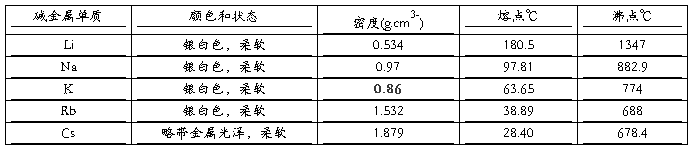
1、碱金属元素
知识回顾:Na的物理性质和化学性质
l 从上到下原子的电子层数在增加,原子半径逐渐增大,所以失电子的能力逐渐增强
l 从上到下金属性逐渐增强(金属性包括
l 碱金属元素的化学性质
R+2H2O====2ROH+H2
4Li+O2====2Li2O
4Na+O2====2Na2O(缓慢氧化)
Na+O2==△===Na2O2
碱金属的主要物理性质
2、卤族元素
卤族元素的主要物理性质

l 从上到下电子层数依次增加,原子半径依次增加,所以得电子的能力也依次减弱,即非金属性依次减弱(非金属性包括
l 单质溴是唯一在常温常压下呈液态的非金属单质
l 卤素的化学性质
X-+Ag+======AgX↓(AgCl为白色沉淀,AgBr为淡黄色沉淀,AgI为黄色沉淀)
X2+H2O=====HX+HXO
F2+H2O=====HF+O2
Fe+Cl2=====2FeCl3
Fe+I2=====FeI2
三、核素
1、质量数
将原子核内所有质子和中子的相对质量取近似整数值相加,所得到的数值叫质量数
质量数(A)=质子数(Z)+中子数(N)
2、核素
具有一定数目质子和一定数目中子的一种原子叫做核素
如下表所示

3、同位素
l 质子数相同而中子数不同的同一元素的不同原子互为同位素
l 当某种元素具有两种或两种以上天然、稳定的同位素时,无论是在单质还是在化合物里,任意一种同位素在该元素内所占的原子数目百分比都不变
4、同素异形体
指同种元素形成的不同单质,它们之间互称为同素异性体。
第二篇:高一化学必修2 元素周期表同步练习
第一节 元素周期表3
1.α射线是α粒子组成的,α粒子是一种没有核外电子的粒子,它带有2个单位正电荷的质量数等于4,由此可判断,α粒子带有 个质子, 个中子。
2.某粒子用 R表示,下列关于该粒子的叙述不正确的是( )
A.所含质子数=A-n
C.所含电子数=Z+n B.所含中子数=A-Z D.所带电荷数=n n-
3.某元素Mn+核外有a个电子,该元素的某种原子的质量数为A,则该原子的核内中子数为
( )A.A-a+n B.A-a-n C.A+a-n D.A+a+n
4、已知某主族元素的原子结构示意图如下,判断其位于第几周期,第几族?

5、某元素形成气态氢化物为

高氧化物水化物的化学式( ) A.其最高价氧化物水化物的分子中有m个氧原子,则其最, B

.
C. D.

6、元素周期表是一座开放的“元素大厦”,元素大厦尚未客满。请你在元素大厦中为119号元素安排好它的房间( )
A.第八周期第IA族 B.第七周期第 ⅦA族
C.第七周期第0族 D.第六周期第ⅡA族
7、短周期主族元素A、B、C、D的原子序数依次增大,其中A、C同主族,B、C、D同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径最大的主族元素。试回答下列问题:
(1)A的元素符号;D
(2)A、B、C三种元素形成的简单离子的半径由大到小的顺序是
(3)A、B、C、D形成的化合物B2A2、CD2、D2A、DA2中各原子都满足最外层8电子结构的是
(填写具体的化学式 )。
(4)CA2与D元素的单质在水溶液中反应的化学方程式是 。
参考答案:1、2,2 2、A 3、B
4、第四周期ⅠA族 第五周期ⅦA族
5、A 6、A 7、(1)O ,(2)S2- > O2- > Na+
(3)Na2O2,SCl2,Cl2O (4)SO2 +Cl2 + 2H2O = 2HCl + H2SO4
习题二
1、下列说法中错误的是 ( )
A.原子及其离子的核外电子层数等于该元素所在周期数
B.元素周期表中从ⅢB族到ⅡB族10列的元素都是金属元素
C.除氦外的稀有气体原子的最外层电子数都是8个
D.同一元素的各种同位素的物理性质和化学性质完全相同
2.鉴别Cl-、Br-、I-可以选用的试剂是 ( )
A.碘水,淀粉溶液 B.氯水,四氯化碳
C.淀粉,KI溶液 D.硝酸银溶液,稀HNO3
3.砹(At)是卤族元素中位于碘后面的元素,试推测砹和砹的化合物最不可能具备的性质是 ( )
A.砹易溶于某些有机溶剂 B.砹化氢很稳定不易分解
C.砹是有色气体 D.砹化银不溶于水或稀HNO3
4、在HI溶液中滴加淀粉溶液无明显变化,但加入某种物质后,溶液立即变蓝。该物质可能是。 ( ) A.FeCl3 B.K2SO3 C.KNO3 D.Na2S
5、下列关于卤素的叙述正确的是 ( )
A、卤素只以化合态存在于自然界中 B、 随核电荷数增加,单质熔沸点升高
C、随核电荷数增加,单质氧化性增强
D、单质与水反应,均可用通式X2+H2O=HX+HXO表示
6 、 A、B、C、D、E、F六种短周期元素的原子序数依次增大。已知A、C、F三原子的最外层
共有11个电子,且这种三元素的最高价氧化物的水化物之间两两皆能反应,均能生成盐和水,
D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子
数多3个。试回答:
(1)写出下列元素的符号AD
(2)用电子式表示B、F形成的化合物。
(3)A、C两种元素最高价氧化物的水化物之间反应的离子方程式 。
(4)D的固态氧化物是体。含nmolD的氧化物的晶体中含D-O共价键为 mol。
参考答案:1、AD 2、BD 3、BC
6、(1)Na;Si;P (2)
(3)Al(OH)--
3+OH==AlO2+2H2O
(4)原子,4n 4、AC 5、AB
-
高中化学必修一知识点总结
必修1全册基本内容梳理从实验学化学一化学实验安全11做有毒气体的实验时应在通风厨中进行并注意对尾气进行适当处理吸收或点燃等进行易燃…
-
高中化学必修一知识点总结 精简版
第一章从实验学化学一化学实验安全11做有毒气体的实验时应在通风厨中进行并注意对尾气进行适当处理吸收或点燃等进行易燃易爆气体的实验时…
-
人教版高一化学必修一知识点总结
一重点聚焦1混合物的分离原理和分离方法2混合物分离方法的操作3离子的检验及检验试剂的选择4物质分离与提纯过程的简单设计5物质的量及…
-
高中化学必修一知识点总结
高中化学必修1复习提纲注A了解B理解C综合应用必修1全册基本内容梳理一从实验学化学一化学实验安全11做有毒气体的实验时应在通风厨中…
-
高一化学必修一知识点总结
新课标化学必修一1学习方法2研究一种物质的性质的程序3观察法4金属钠的物理性质5金属与水的反应第三章金属及其化合物1金属的化学性质…
-
高中化学必修二-化学键、化学反应与能量知识点总结[1] 2
必修二一、化学键与化学反应1.化学键1)定义:相邻的两个或多个原子(或离子)之间强烈的相互作用叫做化学键。2)类型:Ⅰ离子键:由阴…
-
高一化学必修二有机物知识点总结
必修二有机物一、有机物的概念1、定义:含有碳元素的化合物为有机物(碳的氧化物、碳酸、碳酸盐、碳的金属化合物等除外)2、特性①种类多…
-
高一化学必修2有机化合物知识点总结精编
第三章有机化合物知识点绝大多数含碳的化合物称为有机化合物,简称有机物。像CO、CO2、碳酸、碳酸盐、金属碳化物等少数化合物,它们属…
-
苏教版高中化学必修二知识点总结(专题三、四)
专题三有机化合物的获得与应用绝大多数含碳的化合物称为有机化合物,简称有机物。像CO、CO2、碳酸、碳酸盐等少数化合物,由于它们的组…
-
高一化学必修二第二章知识点总结
学点归纳一、化学键与化学反应中能量变化的关系1、化学键的断裂和形成是化学反应中能量变化的主要原因;2、能量是守恒的;3、E(反应物…
-
人教版化学必修2有机物知识点总结
一、化石燃料化石燃料:煤、石油、天然气天然气的主要成分:CH4石油的组成元素主要是碳和氢,同时还含有S、O、N等。主要成分各种液态…