最全人教版化学必修1常见化学方程式总结归纳
高中化学无机反应
1、钠露置于空气中生成白色固体:4Na+O2= 2Na2O
2、钠在空气中燃烧(黄色的火焰):2Na+O2 Na2O2(淡黄色固体)
Na2O2(淡黄色固体)
3、钠在氯气中燃烧(白烟现象):2Na+Cl2 2NaCl
2NaCl
4、钠与硫在研磨时爆炸:2Na+S=Na2S
5、钠与水反应(浮、熔、游、响、红):2Na + 2H2O =2NaOH + H2↑ (2Na + 2H2O = 2Na+ + 2OH - +H2 ↑)
6、氧化钠与氧气反应:2Na2O+ O2 2Na2O2
2Na2O2
7、氧化钠与稀盐酸反应:Na2O+2HCl= 2NaCl + H2O(Na2O+2H+=2Na++ H2O)
8、钠与硫酸铜溶液反应:2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑(2Na+2H2O+Cu2+=Cu(OH)2↓+2Na++H2↑)
9、钠与氯化铁溶液反应:6Na+6H2O+2FeCl3=2Fe(OH)3↓+6NaCl+3H2↑
(6Na+6H2O+2Fe3+=Fe(OH)3↓+6Na++3H2↑)
10、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,用于漂白。)
2Na2O2 + 2H2O = 4NaOH + O2↑ 2Na2O2 + 2H2O = 4Na+ + 4OH - +O2↑(Na2O2既是氧化剂又是还原剂)
11、过氧化钙与水的反应:2CaO2 + 2H2O = 2Ca(OH)2 + O2↑
12、氧化钙与水的反应:CaO + H2O = Ca(OH)2
13、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源,原因是:2Na2O2 + 2CO2 = 2Na2CO3 + O2
(Na2O2既是氧化剂又是还原剂)
14、过氧化钠与二氧化硫气体反应:Na2O2+ SO2= Na2SO4
CO、H2在氧气中燃烧后再通过Na2O2时的总反应:(CO、H2全部被吸收)
Na2O2+ CO= Na2CO3 Na2O2+H2=2NaOH
15、过氧化钠与稀盐酸的反应:2Na2O2 +4HCl= 4NaCl + 2H2O + O2↑(2Na2O2 +4H+= 4Na+ + 2H2O + O2↑)
16、苏打(纯碱)与盐酸反应:
①盐酸中滴加纯碱溶液(有气泡):Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ CO32- + 2H+ = H2O + CO2↑
②纯碱溶液中滴加少量盐酸(无气泡):Na2CO3 + HCl = NaHCO3 + NaCl CO32- + H+ = HCO3-
17、小苏打受热分解:2NaHCO3 Na2CO3 + H2O +CO2 ↑
Na2CO3 + H2O +CO2 ↑
18、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热NaHCO3 + NaOH  Na2CO3 + H2O
Na2CO3 + H2O
(若是溶液中反应有离子方程式):HCO3-+ OH - = H2O + CO32-
19、小苏打(碳酸氢钠)与盐酸反应:NaHCO3+ HCl=NaCl + H2O + CO2↑(HCO3-+H+=H2O+CO2 ↑)
20、饱和碳酸钠溶液通入CO2气体(晶体析出):Na2CO3+H2O+CO2=2NaHCO3↓
21、少量NaHSO4和Ba(OH)2的反应:NaHSO4+Ba(OH)2=BaSO4↓+H2O+NaOH
(H++SO42-+Ba2++OH-=BaSO4↓+H2O)
22、足量NaHSO4和Ba(OH)2的反应:2NaHSO4+Ba(OH)2=BaSO4↓+2H2O+Na2SO4
(2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O)
23、少量NaHCO3和Ca(OH)2的反应:NaHCO3+Ca(OH)2=CaCO3↓+H2O+NaOH(HCO3-+OH-+Ca2+=CaCO3↓+H2O)
24、足量NaHCO3和Ca(OH)2的反应:2NaHCO3+Ca(OH)2=CaCO3↓+2H2O+Na2CO3
(2HCO3-+2OH-+Ca2+=CaCO3↓+2H2O+CO32-)
25、少量Ca(HCO3)2和NaOH的反应:Ca(HCO3)2+2NaOH=CaCO3↓+2H2O+Na2CO3
(2HCO3-+2OH-+Ca2+=CaCO3↓+CO32-+2H2O)
26、足量Ca(HCO3)2和NaOH的反应:Ca(HCO3)2+NaOH=CaCO3↓+H2O+NaHCO3
(HCO3-+OH-+Ca2+=CaCO3↓+H2O)
27、少量NH4HCO3和NaOH的反应:NH4HCO3+2NaOH=Na2CO3+NH3?H2O +H2O
(NH4++HCO3-+2OH-=CO32-+NH3?H2O+H2O)
28、足量NH4HCO3和NaOH的反应:HCO3-+OH-=CO32-+H2O
29、少量NH4HSO4和NaOH的反应:NH4HSO4+2NaOH=Na2SO4+NH3?H2O+H2O
(NH4++H++2OH-=NH3?H2O+H2O)
30、足量NH4HSO4和NaOH的反应:H++OH-=H2O
31、足量明矾[KAl(SO4)2?12H2O]和Ba(OH)2的反应: 6OH-+3Ba2+ +2Al3++3SO42-=2Al(OH)3↓+3BaSO4↓
32、少量明矾[KAl(SO4)2?12H2O]和Ba(OH)2的反应:Al3++2SO42-+4OH-+2Ba2+=AlO2-+2H2O+2BaSO4↓
39、金属锂在空气中燃烧:4Li + O2 2Li2O
2Li2O
40、金属镁在水中加热:Mg+2H2O Mg(OH)2+H2↑
Mg(OH)2+H2↑
41、金属镁与盐酸反应:Mg+2HCl=MgCl2+H2↑(Mg+2H+=Mg2++H2↑)
42、氧化镁与水反应缓慢:MgO+H2O=Mg(OH)2
43、氧化镁与盐酸反应:MgO+2HCl=MgCl2+H2O (Mg+2H+=Mg2++H2O)
44、铜丝在氯气中剧烈燃烧(棕黄色的烟):Cu+Cl2 CuCl2
CuCl2
45、铁在氯气中剧烈燃烧(棕褐色的烟):2Fe + 3Cl2 2FeCl3
2FeCl3
46、铁在氧气中剧烈燃烧(火星四射,放出大量的热):3Fe +2O2 Fe3O4
Fe3O4
47、氢气在氯气中燃烧(苍白色火焰,瓶口有白雾):H2 + Cl2 2HCl
2HCl
48、氯气溶于水(新制氯水中含H+ 、Cl - 、ClO - 、OH-(少量)、Cl2、HClO、H2O):
Cl2 + H2O = HCl + HClO Cl2 + H2O = H+ + Cl - + HClO
49、次氯酸见光分解(强氧化剂、杀菌消毒,漂白剂)2HClO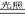 2HCl + O2↑
2HCl + O2↑
50、氯气尾气的吸收原理:Cl2+2NaOH NaCl+NaClO+H2O(Cl2+2OH-
NaCl+NaClO+H2O(Cl2+2OH- Cl-+ClO-+H2O)
Cl-+ClO-+H2O)
51、久置氯水变稀盐酸原理:2Cl2+2H2O 4NaCl + O2↑(2Cl2+2H2O
4NaCl + O2↑(2Cl2+2H2O 4Na++4Cl-+O2↑)
4Na++4Cl-+O2↑)
52、工业制漂白粉的原理(石灰乳与氯气反应)及漂白粉的失效:
2Ca(OH)2 + 2Cl2 =Ca(ClO)2 + CaCl2 + 2H2O
2Ca(OH)2 + 2Cl2=2Ca2++2ClO- + 2Cl -+ 2H2O
Ca(ClO)2 + CO2 + H2O=CaCO3↓ + 2HClO 2HClO 2HCl + O2↑
2HCl + O2↑
(此反应若在溶液中进行时有离子反应方程式):Ca2++2ClO- + CO2 + H2O=CaCO3↓+ 2HClO
53、氯气的实验室制法:(仪器:分液漏斗,圆底烧瓶):MnO2 + 4HCl(浓)  MnCl2 +Cl2↑+ 2H2O
MnCl2 +Cl2↑+ 2H2O
MnO2 + 4H+ +2Cl- Mn2+ + Cl2↑+ 2H2O
Mn2+ + Cl2↑+ 2H2O
54、氯气通常用湿润的淀粉KI试纸检测:Cl2+ 2I-= I2+2Cl-
55、溴水能使湿润的淀粉KI溶液变蓝:Br2+ 2I-= I2+2Br-(单质碘遇淀粉溶液变蓝色)
56、氯酸钾与浓盐酸反应:KClO3+6HCl(浓)=KCl+ 3Cl2↑+3H2O(ClO3-+6H++5Cl-=3Cl2↑+3H2O)
57、高锰酸钾溶液与浓盐酸反应:2KMnO4+16HCl(浓)=2KCl+2MnCl2 +5Cl2↑+8H2O
(2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O)
58、次氯酸钙溶液与浓盐酸反应:Ca(ClO)2 +4HCl(浓)=CaCl2+2Cl2↑+2H2O
(2ClO-+4H++2Cl-=2Cl2↑+2H2O)
59、次氯酸钙溶液与稀盐酸反应:Ca(ClO)2 +2HCl(稀)=CaCl2+2HClO(ClO-+H+=HClO)
60、酸性高锰酸钾溶液中加入双氧水:2KMnO4+5H2O2+3H2SO4=K2SO4+2MnSO4+5O2↑+8H2O
(2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O)
61、固体NaCl、固体NaClO和浓硫酸制氯气:NaCl + NaClO + H2SO4 =Na2SO4 +Cl2↑+ H2O
(产物中Na2SO4写为NaHSO4也可)
62、浓氨水检测氯气泄漏时产生白烟现象:8NH3+3Cl2=6NH4Cl+N2 (氨气少量时2NH3+3Cl2=6HCl+N2)
63、新制氯水注入盛溴化钠溶液的试管中: Cl2 + 2NaBr = Br2 + 2NaCl Cl2 + 2Br- = Br2 + 2Cl-
64、铁与硫加热时反应生成硫化亚铁:Fe + S  FeS(黑色固体,不溶于水)
FeS(黑色固体,不溶于水)
65、铜与硫加热时反应生成硫化亚铜:2Cu +S  Cu2S(+1价铜)
Cu2S(+1价铜)
66、硫化亚铁与稀盐酸反应 FeS + 2HCl = FeCl2 + H2S↑ FeS + 2H+ = Fe2+ +H2S↑
67、二氧化硫制三氧化硫(无色固体,熔点16.8℃) 2SO2 + O2 2SO3
2SO3
68、二氧化硫与酸性高锰酸钾溶液的反应:5SO2+2MnO4- +2H2O= 2Mn2+ +5SO42—+4H+
二氧化硫被次氯酸钙溶液氧化:2SO2+Ca(ClO)2+2H2O= CaSO4↓+H2SO4+2HCl
69、二氧化硫与硫化氢的反应:SO2+2H2S= 3S↓+2H2O
70、硫化氢被硫酸铜溶液吸收生成黑色固体沉淀:H2S+CuSO4= Cu2S↓+H2SO4
71、亚硫酸钠被稀硝酸氧化:SO32—+2H++NO3—= 3SO42—+2NO↑+H2O
72、等物质的量的氯气与二氧化硫不能使品红溶液褪色原理:Cl2+SO2+2H2O=2HCl+H2SO4(Cl2+SO2+2H2O=4H++SO42—+2Cl-)
73、亚硫酸与氯气的反应:Cl2+H2SO3+H2O=2HCl+H2SO4
(Cl2+H2SO3+H2O=4H++SO42—+2Cl-)
74、亚硫酸钠与氯气反应的离子方程式:Cl2+SO32—+H2O=2H++SO42—+2Cl-
硫代硫酸钠Na2S2O3(俗称“海波”或“大苏打”)与氯气反应:4Cl2+S2O32—+5H2O=10H++2SO42—+8Cl-
75、铜与浓硫酸反应:Cu + 2H2SO4 (浓) CuSO4 + 2H2O+SO2 ↑
CuSO4 + 2H2O+SO2 ↑
(Cu + 2H2SO4 (浓) Cu2++SO42-+ 2H2O+SO2 ↑)
Cu2++SO42-+ 2H2O+SO2 ↑)
76、碳与浓硫酸反应:C + 2H2SO4(浓) 2H2O+CO2↑+2SO2↑
2H2O+CO2↑+2SO2↑
77、单质碳充分燃烧:C+O2 CO2
CO2
78、单质碳不充分燃烧:2C+O2 2CO
2CO
79、单质碳还原氧化铜:C+2CuO 2Cu+CO2↑(C+CuO
2Cu+CO2↑(C+CuO Cu+CO↑碳过量)
Cu+CO↑碳过量)
80、工业制单质硅得到粗硅(碳在高温下还原二氧化硅):SiO2 + 2C  Si + 2CO↑
Si + 2CO↑
粗硅与氯气反应:Si+2Cl2 SiCl4 SiCl4+2H2
SiCl4 SiCl4+2H2 Si(纯硅)+4HCl
Si(纯硅)+4HCl
81、红热的碳与水蒸气反应:C+H2O CO+H2(水煤气成分为CO、H2)
CO+H2(水煤气成分为CO、H2)
82、CO还原氧化铁:3CO+Fe2O3 2Fe+3CO2
2Fe+3CO2
83、二氧化硅与HF反应:SiO2+4HF=SiF4↑+2H2O 纯碱与石英反应:SiO2+Na2CO3 Na2SiO3+CO2↑
Na2SiO3+CO2↑
84、二氧化硅与氧化钙反应:SiO2+CaO CaSiO3 石灰石与石英反应:SiO2+CaCO3
CaSiO3 石灰石与石英反应:SiO2+CaCO3 CaSiO3+CO2↑
CaSiO3+CO2↑
85、二氧化硅与氧化钠反应:SiO2+Na2O Na2SiO3纯碱与氧化铝反应:Al2O3+Na2CO3
Na2SiO3纯碱与氧化铝反应:Al2O3+Na2CO3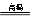 2NaAlO2+CO2↑
2NaAlO2+CO2↑
86、单质硅与氢氧化钠溶液的反应:Si+2NaOH+2H2O= Na2SiO3 +2 H2↑(Si+2OH—+2H2O= SiO32—+2 H2↑)
87、二氧化硅与氢氧化钠反应:SiO2 + 2NaOH = Na2SiO3 + H2O SiO2 + 2OH - = SiO32- + H2O
88、水玻璃通入少量二氧化碳气体:Na2SiO3 + CO2+ H2O= Na2CO3 + H2SiO3↓
89、水玻璃通入足量二氧化碳气体:Na2SiO3 +2CO2+2H2O= 2NaHCO3 + H2SiO3↓
91、氮气和氢气反应(工业合成氨):N2 + 3H2 2NH3
2NH3
92、实验室制氨气原理:Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
93、实验室简易制氨气原理:①加热浓氨水: NH3?H2O NH3↑+H2O
NH3↑+H2O
②浓氨水中加碱石灰或NaOH或生石灰CaO:(平衡移动原理)NH3+H2O?NH3?H2O?NH4++OH-
94、实验室简易制氧气原理之一:2H2O2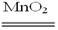 2H2O+O2↑
2H2O+O2↑
95、氮气和氧气放电下反应:N2 + O2 2NO 2NO + O2 =2NO2
2NO 2NO + O2 =2NO2
96、二氧化氮溶于水 3NO2 + H2O 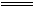 2HNO3 + NO
2HNO3 + NO
3NO2 + H2O 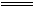 2H+ + 2NO3- + NO
2H+ + 2NO3- + NO
97、NO2 、O2 的混合气通入水中无剩余气体:4NO2 + O2 + 2H2O = 4 HNO3
98、NO 、O2 的混合气通入水中无剩余气体:4NO+ 3O2 + 2H2O = 4 HNO3
99、浓硝酸光照(或受热)分解:4 HNO3 4NO2↑ + O2 ↑+ 2H2O
4NO2↑ + O2 ↑+ 2H2O
100、SO2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体:
3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO↑+4H+
第二篇:必修1第四章 非金属化学方程式总结 人教版
第4章非金属及其化合物方程式
(硅及其化合物性质反应)
1、二氧化硅与氢氧化钠溶液反应 1、SiO2 +2NaOH=Na2SiO3 +H2O
2、二氧化硅与氢氟酸反应 2、SiO2 +4HF =SiF4 ↑+2H2O
3、高温下二氧化硅与氧化钙反应 3、SiO2 +CaO
高温 CaSiO3
4、高温下二氧化硅与碳酸钙反应 4、SiO2+CaCO3 高温 CaSiO3 +CO2↑
5、高温下二氧化硅与碳酸钠反应 SiO2+ Na2CO3 高温 Na2SiO3 +CO2↑
6、硅酸钠溶液与二氧化碳反应 Na2SiO3 +H2O +CO2=H2SiO3 ↓+Na2CO3
7、硅酸受热分解 7、H2SiO3 SiO2 +H2O
8、硅与氧气加热反应 8、Si + O2 △ SiO2
9、二氧化硅与碳高温反应 9、SiO2+2C 高温 Si+2CO↑
10、硅与氢氧化钠溶液反应10、Si +2NaOH +H2O = Na2SiO3 +2H2↑ (氯及其化合物性质反应)
1、实验室制氯气 MnO2 +4HCl(浓) △ MnCl2 +Cl2 ↑+2H2O
2、钠在氯气中燃烧 2Na + Cl2
3、铁在氯气中燃烧 2Fe + 3 Cl2
4、铜在氯气中燃烧 Cu + Cl2
5、氢气在氯气中燃烧 H2 + Cl2 2 NaCl 2 FeCl3 CuCl2 2HCl △
6、氯气与水反应 Cl2 + H2O == HClO +HCl
1
7、次氯酸光照分解 2HClO =
2HCl +O2↑
8、氯气与氢氧化钠溶液反应 Cl2+2NaOH = NaCl+NaClO+H2O
9、工业上制漂白粉 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
10、检验Cl-的反应 HCl +Ag NO3 =Ag Cl ↓+HNO3 (硫的氧化物、氮的氧化物反应)
1、硫和氧气反应 1、S + O2
SO2
2、硫与铁粉加热 2、S +Fe △ FeS
3、铜与硫加热 3、S +2Cu △ Cu2S
4、二氧化硫与水反应 4、SO2 +H2O === H2SO3
5、二氧化硫催化氧化 2 SO2 +O2 催化剂
△ 2SO3
6、溴水中通入二氧化硫褪色 SO2 + Br2 + 2 H2O = H2SO4 + 2HBr
7、二氧化硫与氢氧化钠溶液反应 7、SO2 +2NaOH =Na2SO3 +H2O
8、二氧化硫通入石灰水变浑浊 8、SO2 +Ca(OH)2 =CaSO3 ↓+H2O
9、一氧化氮与氧气反应 9、2NO +O2 =2NO2
10、二氧化氮与水反应 10、3NO2 +H2O =2HNO3 + NO
11、二氧化硫与氯水
SO2+Cl2+2H2O=H2SO4+2HCl(离子方程式)
12、二氧化硫与溴水
SO2+Br2+2H2O=H2SO4+2HBr(离子方程式)
13、二氧化硫与碘水
SO2+I2+2H2O=H2SO4+2HI(离子方程式)
14、二氧化硫通入氯化铁溶液
2
2FeCl3 + SO2 + 2H2O = 2FeCl2 + H2SO4 + 2HCl
15、二氧化硫通入酸性高锰酸钾溶液
5SO2 +2MnO4- +2H2O ==5SO42- +2Mn2+ +4H+
(氨气性质反应)
1、高温高压催化剂氮气和氢气反应
2、氨气溶于水溶液呈碱性
3、氨水加热分解 NH3·H2O△ NH3↑+H2O
4、氨气与氯化氢相遇产生白烟 NH3 + HCl = NH4Cl (固)
5、氨气与硝酸反应 NH3 +HNO3 = NH4NO3
催化剂
6、氨气催化氧化 4NH3 +5O2 △ 4NO + 6H2O
7、碳酸氢铵受热分解 NH4HCO3 △ NH3 ↑+CO2↑ +H2O
8、氯化铵与氢氧化钠反应 NH4Cl +NaOH △ NaCl +NH3 ↑+H2O
9、实验室制氨气 Ca(OH)2 +2NH4Cl △ CaCl2 +2NH3↑ +2H2O
10、铵离子的检验 NH4+ + OH- △ NH3 ↑+ H2O (硫酸和硝酸反应)
1、浓硫酸与铜加热反应
2H △
2SO4(浓 CuSO4+SO2↑+2H2O
2、浓硫酸与碳加热反应
2H(浓 △
2SO4 CO2 ↑ +2SO2+2H2O
3、稀硝酸与铜反应
3Cu +8HNO △
3Cu(NO3)2 +2NO ↑+4H2O
3
4、浓硝酸与铜反应 Cu +4HNO3 ==Cu(NO3)2 + NO2 ↑+ 2H2O
5、浓硝酸与碳反应 4HNO3(浓)+C==CO2↑+4NO2↑+2H2O
6、浓硝酸光照分解 4HNO3=4NO2↑+O2↑+2H2O(见光或受热分解)
7、铁与浓硫酸加热
6H(浓)+2Fe △
2SO4 Fe2(SO4)3+3SO2↑+6H2O
4
-
人教版高中化学必修1化学方程式总结知识点归纳
化学必修一知识大总结一教材中涉及的离子检验物质检验的一般步骤取试样加试剂观现象定结论1SO4的检验取待测液先用稀盐酸酸化再加BaC…
-
高中化学必修1化学方程式总结
高中化学必修1化学方程式总结一钠及其化合物的转化关系1钠在空气中燃烧2NaO2点燃Na2O22钠在氧气中燃烧4NaO2点燃2Na2…
- 高一化学必修1化学方程式及离子方程式汇总(背诵版)
-
高中化学 化学方程式总结 人教版必修1
高中化学必修1化学方程式总结1钠及其化合物的转化关系2NaCl2Na2O2HCl2NaClH2O2Na2HCl2NaClH2Na2…
-
高中化学必修1的化学方程式分类归纳
化学必修1全部化学方程式分类归纳一置换反应氧化还反应1还原性非金属单质与氧化物反应置换金属单质碳还原氧化铜2CuOC高温2CuCO…
-
高中化学必修一第三章金属及其化合物化学方程式或离子方程式总汇(完美编辑版)
高中化学必修一第三章金属及其化合物化学方程式或离子方程式总汇第一节金属的化学性质一、钠、镁、铝、铁、铜分别与氧气反应1、4Na+O…
-
高中必修1化学方程式大全
高中化学必修1化学方程式总结1、钠及其化合物的转化关系2②NaCl2①Na2O+2HCl=2NaCl+H2O②2Na+2HCl=2…
-
高中化学必修1化学方程式总结
1、钠及其化合物的转化关系2②NaCl2①Na2O+2HCl=2NaCl+H2O②2Na+2HCl=2NaCl+H2↑++++Na…
-
高中必修1化学方程式总结
一、教材中涉及的离子检验:背下来,必考物质检验的一般步骤:取试样→加试剂→观现象→定结论1、SO42-的检验:取样,加稀盐酸酸化,…
-
苏教版化学必修一化学方程式总结word版
一、复分解反应(非氧化还原反应)1、酸性氧化物与碱反应生成盐和水①.二氧化硅与氢氧化钠溶液反应SiO2+2NaOH=Na2SiO3…
-
超详细人教版必修一化学第三章金属及其化合物化学方程式总结
第三章金属及其化合物方程式总结加粗的是对应的离子方程式1金属钠的化学性质钠露置空气中变暗4NaO22Na2O白色钠的燃烧2NaO2…