初三上册重要的化学方程式汇总
初三化学复习资料
<重 要 化 学 方 程 式 汇 总>
 石灰石(或大理石)与稀盐酸反应(实验室制CO2):CaCO3 + 2HCl === CaCl2 + H2O+ CO2↑
石灰石(或大理石)与稀盐酸反应(实验室制CO2):CaCO3 + 2HCl === CaCl2 + H2O+ CO2↑
 二氧化碳通过澄清石灰水(检验CO2):Ca(OH)2 + CO2 =CaCO3↓+ H2O
二氧化碳通过澄清石灰水(检验CO2):Ca(OH)2 + CO2 =CaCO3↓+ H2O

 氯酸钾与二氧化锰的混合物共热:2KClO3
氯酸钾与二氧化锰的混合物共热:2KClO3 2KCl + 3O2↑
2KCl + 3O2↑
 加热高锰酸钾:2KMnO4
加热高锰酸钾:2KMnO4 K2MnO4 + MnO2 + O2↑
K2MnO4 + MnO2 + O2↑
一、 燃烧反应
1、木炭在氧气中燃烧:C + O2 CO2 (在氧气中:产生使石灰水变浑浊的无色气体)
CO2 (在氧气中:产生使石灰水变浑浊的无色气体)
2、木炭在空气中不充分燃烧:2C + O2 2CO
2CO
3、一氧化碳在氧气中燃烧:2CO + O2 2CO2 (产生蓝色火焰)
2CO2 (产生蓝色火焰)
4、硫粉在氧气中燃烧: S + O2 SO2 (在空气中:呈淡蓝色火焰;在氧气中:呈明亮的蓝紫色火焰,产生有刺激性气味的气体)
SO2 (在空气中:呈淡蓝色火焰;在氧气中:呈明亮的蓝紫色火焰,产生有刺激性气味的气体)
5、磷在氧气中燃烧:4P + 5O2 2P2O5 (产生浓厚的白烟)
2P2O5 (产生浓厚的白烟)
 6、铁在氧气中燃烧:3Fe + 2O
2
6、铁在氧气中燃烧:3Fe + 2O
2
 Fe
3O
4 (剧烈燃烧,火星四射,生成黑色固体)
Fe
3O
4 (剧烈燃烧,火星四射,生成黑色固体)
7、镁在空气中燃烧:2Mg + O2 2MgO (发出耀眼的白光,生成白色固体)
2MgO (发出耀眼的白光,生成白色固体)
8、铜在空气中加热;2Cu + O2 2CuO (红色固体变为黑色固体)
2CuO (红色固体变为黑色固体)
9、氢气在空气中燃烧:2H2 + O2 2H2O (产生淡蓝色火焰,干冷烧杯壁有小水株。或产生爆鸣声)
2H2O (产生淡蓝色火焰,干冷烧杯壁有小水株。或产生爆鸣声)
10、甲烷在空气中燃烧:CH4 + 2O2 CO2 + 2H2O
CO2 + 2H2O
11、酒精在空气中燃烧:C2H5OH + 3O2 2CO2 + 3H2O
2CO2 + 3H2O
二、制取气体
1、实验室用过氧化氢与二氧化锰的混合物制氧气:2H2O2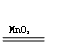 2H2O+ O2↑
2H2O+ O2↑
2、石灰石(或大理石)与稀盐酸反应(实验室制CO2):CaCO3 + 2HCl === CaCl2 + H2O+ CO2↑
 3、锌和稀硫酸反应(实验室制H2):Zn + H2SO4 = ZnSO4 + H2↑
3、锌和稀硫酸反应(实验室制H2):Zn + H2SO4 = ZnSO4 + H2↑
4、锌和稀盐酸反应:Zn + 2HCl = ZnCl2 + H2↑
5、镁和稀盐酸反应:Mg + 2HCl = MgCl2 + H2↑
6、高温煅烧石灰石:CaCO3 CaO + CO2↑(工业上制二氧化碳的方法)
CaO + CO2↑(工业上制二氧化碳的方法)
三、还原反应
1、木炭还原氧化铜:C+2CuO 2Cu + CO2↑(黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体)
2Cu + CO2↑(黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体)
2、焦炭还原氧化铁:3C+ 2Fe2O3 4Fe + 3CO2↑
4Fe + 3CO2↑
3、一氧化碳还原氧化铜:CO+CuO Cu + CO2(黑色固体变红色,产生使澄清石灰水变浑浊的气体)
Cu + CO2(黑色固体变红色,产生使澄清石灰水变浑浊的气体)
4、一氧化碳还原氧化铁:3CO+ Fe2O3 2Fe + 3CO2
2Fe + 3CO2
5、氢气还原氧化铜:H2 + CuO Cu + H2O
Cu + H2O
四、其他
1、水在直流电的作用下分解:2H2O 2H2↑+O2 ↑(电极:正氧负氢;体积比:氢二氧)
2H2↑+O2 ↑(电极:正氧负氢;体积比:氢二氧)
2、二氧化碳通过灼热碳层: C + CO2  2CO
2CO
3、二氧化碳和水反应 :CO2 + H2O =H2CO3(CO2通入紫色石蕊试液,试液由紫色变为红色):
4、碳酸不稳定而分解:H2CO3 =H2O + CO2↑(石蕊试液由红色变紫色)
第二篇:初三上册重要的化学方程式汇总
初三化学复习资料
<重 要 化 学 方 程 式 汇 总>
石灰石(或大理石)与稀盐酸反应(实验室制CO2): CaCO3 + 2HCl === CaCl2 + H2O+ CO2↑ 二氧化碳通过澄清石灰水(检验CO2): Ca(OH)2 + CO2 =CaCO3↓+ H2O 过氧化氢与二氧化锰混合制氧气: MnO

2H2O2 2H2O + O2↑
加热高锰酸钾:
2KMnO4 △ K2MnO4 + MnO2 + O2↑
一、 燃烧反应
1、木炭在氧气中燃烧: C + O2CO2 (在氧气中:产生使石灰水变浑浊的无色气体)
2、木炭在空气中不充分燃烧: 2C + O2 2CO 3、一氧化碳在氧气中燃烧: 2CO + O2 2CO2 (产生蓝色火焰)
4、硫粉在氧气中燃烧: S + O2 SO2 (在空气中:呈淡蓝色火焰;在氧气中:呈明亮的蓝紫色火焰,产生
有刺激性气味的气体) 5、磷在氧气中燃烧: 2



点燃 点燃 点燃 点燃
1
225 6、铁在氧气中燃烧: 3Fe + 2O2Fe3O4 (剧烈燃烧,火星四射,生成黑色固体)
瓶底留少量水或细沙,防止溅落的高温熔化物炸裂瓶底。
7、镁在空气中燃烧: 2Mg + O2 2MgO (发出耀眼的白光,生成白色固体) 8

2Cu + O2 2CuO (红色固体变为黑色固体) 9、氢气在空气中燃烧: 2H2 + O22H2O (产生淡蓝色火焰,干冷烧杯壁有小
水
株。)
10、甲烷在空气中燃烧: CH4 + 2O2CO2 + 2H2O 11、酒精在空气中燃烧: C2H5OH + 3O22CO2 + 3H2O
二、制取气体
1、实验室用过氧化氢与二氧化锰的混合物制氧气: 2H2O2 2H2O+ O2↑
点燃 点燃 点燃 点燃 点燃 点燃 MnO2
2
2CaCO3 + 2HCl === CaCl2 + H2O+ CO2↑ 3、锌和稀硫酸反应(实验室制H2):
Zn + H2SO4 = ZnSO4 + H2 产生大量
无色气体 4、锌和稀盐酸反应:Zn + 2HCl = ZnCl2 + H2↑ 5、镁和稀盐酸反应:Mg + 2HCl = MgCl2 + H2↑ 6、高温煅烧石灰石: CaCO3CaO + CO2↑(工业上制二氧化碳的方法)
三、其他 1、水在直流电的作用下分解: 2H2O 2H2↑+O2 ↑ (电极:正氧负氢;体积比:氢二氧一)
加入硫酸或氢氧化钠的目的:增强水的导电性。
2、二氧化碳和水反应 : CO2 + H2O =H2CO3 高温 通电
(CO2通入紫色石蕊试液,试液由紫色变为红色): 3、碳酸不稳定而分解: H2CO3 =H2O + CO2↑(石蕊试液由红色变紫色) 碳酸氢铵分解 碱式碳酸铜分解
3
4
-
初三化学上册化学方程式总结
初三化学1-9单元化学方程式总结24.CO+CuOCu+CO2一、物质与氧气的反应:(1)单质与氧气的反应:1.镁在空气中燃烧:2…
-
初三化学方程式总结(精品)
绝版初三化学方程式编者语这个总结的主要目的是帮助你应对初三化学的推断题也就是所谓的框图题的当你在做框图题的时候应该看到某一物质时能…
-
初三化学上册化学方程式总结※
初三化学19单元化学方程式总结一物质与氧气的反应1单质与氧气的反应点燃1镁在空气中燃烧2MgO22MgO点燃2铁在氧气中燃烧3Fe…
- 人教版九年级上册化学化学方程式汇总
-
初三上册重要的化学方程式汇总
成才热线86988878697778初三化学复习资料lt重要化学方程式汇总gt石灰石或大理石与稀盐酸反应实验室制CO2CaCO32…
-
初三化学上册化学方程式总结
初三化学1-9单元化学方程式总结24.CO+CuOCu+CO2一、物质与氧气的反应:(1)单质与氧气的反应:1.镁在空气中燃烧:2…
-
初三化学方程式总结(上期)
初三化学方程式上期小结1、与氧有关的化学方程式:点燃2Mg+O2====2MgO现象:燃烧、放出大量的热、同时放出耀眼的白光点燃S…
-
初三上册化学方程式总结
初三化学上册化学方程式及反应现象德江第六中学(张真老师编)1、2Mg+O22MgO剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量…
-
九年级上学期化学方程式 总结
九年级上学期化学方程式总结一、与氧有关的化学方程式:2Mg+O2点燃====2MgO现象:燃烧、放出大量的热、同时放出耀眼的白光S…
-
九年级上册化学方程式整理小结
九年级上册化学方程式整理小结一.化合反应1.镁带燃烧:2Mg+O2====2MgO2.铁丝燃烧3Fe+2O2====Fe3O4;3…
-
初三化学方程式总结
初三化学方程式及其现象与氧有关的化学方程式:2Mg+O2点燃====2MgO现象:燃烧、放出大量的热、同时放出耀眼的白光S+O2点…