高中化学必修二方程式总结(考试作弊专用)
高中化学(人教版)必修二相关化学方程式汇总
第一章 物质结构 元素周期律
1、Li与O2反应(点燃): 4Li + O2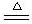 2Li2 O
2Li2 O
Na与O2反应(点燃): 2Na+O2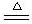 Na2O2
Na2O2
2、卤素单质F2 、Cl2 、Br2 、I2与氢气反应:
F2 + H2 === 2HF Cl2 + H2 === 2HCl
Br2 + H2 === 2Br I2 + H2 === 2HI
3、卤素单质间的置换反应:
(1)氯水与饱和溴化钠、氯水与饱和碘化钠溶液反应:
① Cl2+2NaBr===Br2+2NaCl
② Cl2+2NaI===I2+2NaCl
(2)溴水与碘化钠溶液反应:Br2+2NaI===I2+2NaBr
4、Mg与H2O反应:Mg+2H2O === Mg(OH)2+H2↑
Al与HCl反应: 2Al+6HCl===2AlCl3+3H2↑
Mg与HCl反应: Mg+2 HCl === MgCl2+ H2↑
 5、Na与Cl2反应(点燃):
5、Na与Cl2反应(点燃):
6、用电子式表示氯化氢的形成过程:
第二章 化学反应与能量
1、Ba(OH)2?8H2O与NH4Cl的反应 :
Ba(OH)2·8H2O+2NH4Cl==BaCl2+2NH3↑+10H2O
2、原电池原理
典型的原电池(Zn-Cu原电池)
负极(锌):Zn-2e-===Zn2+(氧化反应)
正极(铜):2H++2e-===H2↑(还原反应)
电子流动方向:由锌经过外电路流向铜。
总反应离子方程式:Zn+2H+===Zn2++H2↑
3、H2O2在催化剂作用下受热分解: 2H2O2  2H2O+O2↑
2H2O+O2↑
4、Na2SO4与CaCl2反应:Na2SO4+CaCl2===CaSO4↓+Na2CO3
5、高炉炼铁:2C + O2 === 2CO Fe2O3 + 3CO ==2Fe + 3CO2
第三章 有机化合物
1、甲烷的主要化学性质
(1)氧化反应(与O2的反应):CH4(g)+2O2(g) CO2(g)+2H2O(l)
CO2(g)+2H2O(l)
(2)取代反应(与Cl2在光照条件下的反应,生成四种不同的取代物):


2、乙烯的主要化学性质
(1)氧化反应(与O2的反应):C2H4+3O2 2CO2+2H2O
2CO2+2H2O
(2)加成反应((与Br2的反应): 
(3)乙烯还可以和氢气、氯化氢、水等发生加成反应:
CH2=CH2 + H2 CH3CH3
CH3CH3
CH2=CH2+HCl CH3CH2Cl(一氯乙烷)
CH3CH2Cl(一氯乙烷)
CH2=CH2+H2O CH3CH2OH(乙醇)
CH3CH2OH(乙醇)
(4)聚合反应:
 (乙烯制聚乙烯)①
(乙烯制聚乙烯)①
 (氯乙烯制聚氯乙烯)②
(氯乙烯制聚氯乙烯)②
3、苯的主要化学性质:
(1)氧化反应(与O2的反应):2C6H6+15O2 12CO2+6H2O
12CO2+6H2O
(2)取代反应:

 ① 与Br2的反应: + Br2
① 与Br2的反应: + Br2  + HBr
+ HBr
② 苯与硝酸(用HONO2表示)发生取代反应,生成无色、不溶于水、有苦杏仁气味、密度大于水的油状液体——硝基苯。反应方程式:

 + HONO2
+ HONO2  + H2O
+ H2O
(3)加成反应

 用镍做催化剂,苯与氢发生加成反应: + 3H2
用镍做催化剂,苯与氢发生加成反应: + 3H2 
4、乙醇的重要化学性质
(1)乙醇与金属钠的反应:2CH3CH2OH+2Na 2CH3CH2ONa+H2↑
2CH3CH2ONa+H2↑
(2)乙醇的氧化反应
①乙醇的燃烧: CH3CH2OH+3O2 2CO2+3H2O
2CO2+3H2O
②乙醇的催化氧化反应: 2CH3CH2OH+O2 2CH3CHO+2H2O
2CH3CHO+2H2O
③乙醇在常温下的氧化反应:
CH3CH2OH CH3COOH
CH3COOH
5、乙酸的重要化学性质
(1)乙酸的酸性
①乙酸能使紫色石蕊试液变红
②乙酸能与碳酸盐反应,生成二氧化碳气体
利用乙酸的酸性,可以用乙酸来除去水垢(主要成分是CaCO3):
2CH3COOH+CaCO3 (CH3COO)2Ca+H2O+CO2↑
(CH3COO)2Ca+H2O+CO2↑
乙酸还可以与碳酸钠反应,也能生成二氧化碳气体:
2CH3COOH+Na2CO3 2CH3COONa+H2O+CO2↑
2CH3COONa+H2O+CO2↑
上述两个反应都可以证明乙酸的酸性比碳酸的酸性强。
(2)乙酸的酯化反应
①反应原理(与乙醇的反应):
乙酸与乙醇反应的主要产物乙酸乙酯是一种无色、有香味、密度比水的小、不溶于水的油状液体。
6、①蔗糖水解反应:C12H22O11+H2O→C6H12O6+C6H12O6
②淀粉(纤维素)水解反应: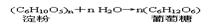
③油脂的重要化学性质——水解反应:
a)油脂在酸性条件下的水解: 油脂+H2O 甘油+高级脂肪酸
甘油+高级脂肪酸
b)油脂在碱性条件下的水解(又叫皂化反应):
油脂+H2O 甘油+高级脂肪酸
甘油+高级脂肪酸
蛋白质+H2O 各种氨基酸
各种氨基酸
第四章 化学与可持续发展
1、HgO受热分解:2HgO 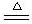 2Hg + O2↑
2Hg + O2↑
Ag2O受热分解:2Ag2O 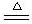 4Ag + O2↑
4Ag + O2↑
2、CO还原Fe2O3:Fe2O3 + 3CO  2Fe +3CO2 (高炉炼铁)
2Fe +3CO2 (高炉炼铁)
① C 还原ZnO :2 ZnO + C  2 Zn +CO2↑
2 Zn +CO2↑
② C 还原MgO : MgO +C  Mg + CO↑
Mg + CO↑
③ Al 还原Fe2O3(铝热反应): Fe2O3 + 2Al  2Fe + Al2O3
2Fe + Al2O3
④ Fe还原CuSO4: CuSO4 + Fe ==== FeSO4 +Cu (湿法炼铜)
3、电解
①电解NaCl:2NaCl(熔融)  2Na +Cl2↑
2Na +Cl2↑
②电解MgCl2: MgCl2(熔融)  Mg +Cl2↑
Mg +Cl2↑
③电解Al2O3: 2Al2O3(熔融)  4Al + 3O2↑
4Al + 3O2↑
4、石油的催化裂化
例如:C4H10  C2H4 + C2H6
C2H4 + C2H6
C16H34  C8H18 +C8H16
C8H18 +C8H16
C8H18  C4H10 +C4H8
C4H10 +C4H8
C4H10  CH4 +C3H6
CH4 +C3H6
C4H10  C2H4 +C2H6
C2H4 +C2H6
第二篇:高中化学必修1化学方程式总结
高中化学必修1化学方程式总结
化合价口诀:
一价氢氯钾钠银, 二价氧钙钡镁锌。 三铝四硅五价磷, 谈变价也不难, 二三铁,二四碳,
二四六硫都齐全, 铜汞二价最常见, 氢正一,氧负二,金属正价记心间, 莫忘单质价为零。
溶解度口诀: 钾钠铵盐硝酸盐,都能溶于水中间;盐酸除了银亚汞,硫酸难溶是钡铅;
碳酸磷酸亚硫酸,可溶只有钾钠铵;银盐只溶硝酸银,溶碱钡和钾钠铵。
常见的氧化剂与还原剂
常见氧化剂:(1)活泼的非金属单质;如卤素单质(X2)、O2、S等(2)高价金属阳离子;如Fe3+、Cu2+等(3)高价或较高价含氧化合物;如MnO2、浓H2SO4、HNO3、KMnO4等(4)过氧化物;如Na2O2、H2O2等
常见还原剂:①活泼或较活泼的金属;如K、Na、Zn、Fe等②一些非金属单质;如H2、C、Si等③较低态的化合物;CO、SO2、H2S、Na2SO3、FeSO4
【例1】氢化钠(NaH)是一种生氢剂,可发生如下反应:NaH + H2O == NaOH + H2↑对这一反应的描述正确的是( )
A.NaH是氧化剂 B. NaH是氧化产物 C.NaOH是还原产物 D.氧化产物与还原产物的质量比是1:1
考点二 氧化还原反应电子转移方向和数目的表示方法
1.双线桥表示法:
MnO2 + 4HCl === MnCl2 + Cl2↑+ 2H2O
注:桥上标:得(失)电子数,得失电子总数要相等
2.单线桥表示法:
MnO2 + 4HCl === MnCl2 + Cl2↑ + 2H2O
注:箭头线由还原剂中失去电子的元素指向氧化剂中得到电子的元素;桥上只标电子数,不写“得”、“失”等。
1、钠及其化合物的转化关系
① Na2O+2HCl=2NaCl+H2O ② 2Na+2HCl=2NaCl+H2↑
Na2O+2H+=2Na++H2O 2Na+2H+=2Na++H2↑ ③ 2Na2O2+4HCl=4NaCl+O2↑+2H2O ④ 4Na+O2=2Na2O 2Na2O2+4H+=4Na++O2↑+2H2O ※⑥ 2Na+2H2O=2NaOH+H2↑
※⑤ 2Na+O2 Na2O2 2Na+2H2O=2Na++2OH-+H2↑
⑦ Na2O+H2O=2NaOH ※⑧ 2Na2O2+2H2O=4NaOH+O2↑
Na2O+H2O=2Na++2OH- 2Na2O2+2H2O=4Na++4OH-+O2↑
⑨ Na2O+CO2=Na2CO3 ※⑩ 2Na2O2+
2CO2=2Na2CO3+O2
⑾2 NaOH+CO2=Na2CO3+H2O ⑿ Na2CO3+
Ca(OH)2=CaCO3↓+2NaOH
2OH-+CO2=CO32-+H2O CO32-+Ca2+=CaCO3↓
⒀ NaOH+CO2=NaHCO3 ※⒁ Na2CO3+H2O+CO2=2NaHCO3
OH-+CO2=HCO3- CO32-+H2O+CO2=2HCO3-
※⒂ 2NaHCO3 Na2CO3+H2O+CO2↑ 或 ※ NaHCO3+NaOH=Na2CO3+H2O
HCO3-+OH-=CO32-+H2O
⒃ Na2CO3+2HCl=2NaCl+H2O+CO2↑ ⒄ NaHCO3+HCl=NaCl+H2O+CO2↑
CO32-+2H+=H2O+CO2↑ HCO3-+H+=H2O+CO2↑
补充:①石灰水中加入少量NaHCO3 : Ca(OH)2+NaHCO3=CaCO3↓+NaOH+H2O
Ca2++OH-+HCO3-=CaCO3↓+H2O
②石灰水中加入过量NaHCO3 : Ca(OH)2+2NaHCO3=CaCO3↓+Na2CO3+2H2O
Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O
2、铝及其化合物的转化关系
① 2Al+6HCl=2AlCl3+3H2↑ ② 4Al+3O2 2Al2O3 2Al+6H+=2Al3++3H2↑
※③ 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ ④ Al2O3+6HCl=2AlCl3+3H2O
2Al+2OH-+2H2O=2AlO2-+3H2↑ Al2O3+6H+=2Al3++3H2O
※⑤ Al2O3+2NaOH=2NaAlO2+H2O ⑥ AlCl3+
3NH3?H2O=Al(OH)3↓+3NH4Cl
Al2O3+2OH-=2AlO2-+H2O Al3++3NH3?H2O = Al(OH)3↓+3NH4+
⑦ Al(OH)3+3HCl=AlCl3+3H2O ⑧ 2Al(OH)3 Al2O3+3H2O Al(OH)3+3H+=Al3++3H2O
☆⑨ NaAlO2+HCl+H2O =Al(OH)3↓+NaCl或NaAlO2+2H2O+CO2=Al(OH)3↓+NaHCO3
AlO2-+H++H2O=Al(OH)3↓ AlO2-+2H2O+
CO2=Al(OH)3↓+HCO3-
※⑩ Al(OH)3+NaOH = NaAlO2+2H2O ☆⑾ Al3++3H2O Al(OH)3胶体+3H+
Al(OH)3+OH-= AlO2-+2H2O 明矾净水
⑿ AlCl3+4NaOH = NaAlO2+3NaCl+2H2O Al3++4OH-= AlO2-+2H2O
3、铁及其化合物的转化关系
① Fe3O4+4CO 3Fe+4CO2 ※② 3Fe+4H2O(g) Fe3O4+4H2
③ Fe+2HCl=FeCl2+H2↑ 或3Fe+2O2 Fe3O4 Fe+2H+=Fe2++H2↑ ④2Fe+3Cl2 2FeCl3 ※⑤ 2FeCl2+Cl2 = 2FeCl3 ※⑥ Fe+2FeCl3 = 3FeCl2 2Fe2++Cl2 = 2Fe3++2Cl- Fe+2Fe3+= 3Fe2+ ⑦ FeCl2+2NaOH = Fe(OH)2↓+2NaCl ⑧ Fe(OH)2+2HCl = FeCl2+2H2O
Fe2++2OH-= Fe(OH)2↓ Fe(OH)2+2H+= Fe2++2H2O
※⑨ 4Fe(OH)2+O2+2H2O = 4Fe(OH)3 ⑩ FeCl3+3NaOH = Fe(OH)3↓+3NaCl
白色沉淀迅速变成灰绿色,最后变成红褐色 Fe3++3OH-= Fe(OH)3↓ ⑾ Fe(OH)3+3HCl = FeCl3+3H2O Fe3++3H2O Fe(OH)3胶体+3H+(净水)
Fe(OH)3+3H+= Fe3++3H2O ⑿ 2Fe(OH)3 Fe2O3+3H2O
⒀ Fe2O3+6HCl = 2FeCl3+3H2O ※⒁ FeCl3+3KSCN = Fe(SCN)3+3KCl
Fe2O3+6H+= 2Fe3++3H2O Fe3++3SCN-= Fe(SCN)3
4、硅及其化合物的转化关系
① Si+O2 SiO2 ② SiO2+2C Si+2CO↑
※③ SiO2+4HF = SiF4↑+2H2O(刻蚀玻璃)
④ Si+4HF = SiF4↑+2H2↑ ⑤ SiO2+CaO CaSiO3
SiO2+CaCO3 CaSiO3+CO2↑
※⑥ SiO2+2NaOH = Na2SiO3+H2O
SiO2+2OH-= SiO32-+H2O ※⑦ Na2SiO3+2HCl = H2SiO3↓+2NaCl
SiO2+Na2CO3 Na2SiO3+CO2↑ SiO32-+2H+= H2SiO3↓ ※⑦ Na2SiO3+H2O+CO2=H2SiO3↓+Na2CO3或Na2SiO3+2H2O+2CO2=H2SiO3↓+2NaHCO3
SiO32-+H2O+CO2=H2SiO3↓+CO32-或SiO32-+2H2O+2CO2=H2SiO3↓+2HCO3-
⑧ H2SiO3+2NaOH = Na2SiO3+2H2O ⑨ H2SiO3===H2O+SiO2 H2SiO3+2OH-= SiO32-+2H2O
5、氯及其化合物的转化关系
① 2Fe+3Cl2 2FeCl3 ② Cu+Cl2 CuCl2
③ 2FeCl3+Cu = 2FeCl2+CuCl2 2Fe3++Cu = 2Fe2++Cu2+
④ H2+Cl2 2HCl ※⑤ MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
※⑥ Cl2+H2O = HCl+HClO ※⑦ 2HClO 2HCl+O2↑ Cl2+H2O = H++Cl-+HClO 2HClO 2H++2Cl-+O2↑
※⑧ Cl2+2NaOH = NaCl+NaClO+H2O ※⑨ 2Cl2+2Ca(OH)2 = CaCl2+Ca(ClO)2+2H2O
Cl2+2OH-= Cl-+ClO-+H2O 工业制漂白粉
※⑩ Ca(ClO)2+H2O+CO2 = CaCO3↓+2HClO或Ca(ClO)2+2HCl = CaCl2+2HClO
Ca2++2ClO-+H2O+CO2= CaCO3↓+2HClO或ClO-+H+= HClO 漂白粉的漂白原理
向漂白粉溶液中通入过量的CO2:Ca(ClO)2+2H2O+2CO2 = Ca(HCO3)2+2HClO
ClO-+H2O+CO2 = HCO3-+HclO
6、硫及其化合物的转化关系
①S+O2 SO2
②2H2S+SO2=3S+2H2O ※③SO2+O2 2SO3
④SO3+H2O = H2SO4 ⑤SO2+CaO CaSO3 或 SO2+Ca(OH)2 = CaSO3↓+H2O
⑥SO3+CaO = CaSO4 SO2+Ca2++2OH-=CaSO3↓+H2O
SO3+Ca(OH)2 = CaSO4+H2O ⑦2CaSO3+O2 2CaSO4
※⑧SO2+Cl2+2H2O = H2SO4+2HCl ※⑨Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
SO2+Cl2+2H2O = 4H++SO42-+2Cl- Cu+2H2SO4(浓) Cu2++SO42-+SO2↑+2H2O
※⑩C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
7、氮及其化合物的转化关系
※① N2+O2 2NO
※② 2NO+O2 = 2NO2
※③ 3NO2+H2O = 2HNO3+NO
3NO2+H2O =2H++2NO3-+NO
以上三个反应为“雷雨发庄稼”原理
扩展反应有:4NO2+O2+2H2O = 4HNO3
4NO+3O2+2H2O = 4HNO3
※④ Cu+4HNO3(浓) = Cu(NO3)2+2NO2↑+2H2O 上面两个反应主要用于气体溶于水时的计算
Cu+4H++2NO3-=Cu2++2NO2↑+2H2O 或 4HNO3 4NO2↑+ O2↑+ 2H2O
C+4HNO3(浓) CO2↑+2NO2↑+2H2O 浓硝酸见光易变黄的原因
※⑤ 3Cu+8HNO3(稀) = 3Cu(NO3)2+2NO↑+4H2O ⑥N2+3H2 2NH3 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O 合成氨反应是人工固氮的主要途径
⑦ NH3+HCl = NH4Cl ⑧ NH4Cl NH3↑+HCl↑ NH3+H+ = NH4+(水溶液中) 补充:NH4HCO3
NH3↑+H2O+CO2↑
氨气与酸均能反应生成铵盐,且与挥发性酸 铵盐受热都易分解,但并不是所有的铵盐
(如浓HCl、浓HNO3)相遇时空气中有白烟 都分解出氨气,如NH4NO3、(NH4)2SO4
※⑧ NH4Cl+NaOH NaCl+NH3↑+H2O NH4++OH- NH3↑+H2O
所有的铵盐都能与碱作用放出氨气,可利用此反应鉴别铵离子。
※⑧2NH4Cl+2Ca(OH)2 CaCl2+2NH3↑+2H2O 实验室制氨气,此反应为固体反应,不能写成离子方程式。
☆⑨4NH3+5O2 4NO+6H2O 氨的催化氧化反应,工业制硝酸的第一步。 注:带“※”的反应为重要反应,必须熟记;带“☆”的反应只需了解。
-
必修二有机化学方程式归纳+答案
必修二有机化学方程式归纳班级姓名一写出下列反应的方程式除燃烧外有机物必须用结构简式表示1甲烷与氯气混合光照光照光照CH4Cl2CH…
-
高中化学人教版必修二有机化合物化学方程式总结
高中化学人教版必修二有机化合物单元知识点总结甲烷燃烧CH4+2O2→CO2+2H2O(条件为点燃)甲烷隔绝空气高温分解甲烷分解很复…
-
高中化学必修二方程式总结
高中化学人教版必修二相关化学方程式汇总第一章物质结构元素周期律1Li与O2反应点燃4LiO22Li2ONa与O2反应点燃2NaO2…
-
高中化学必修2化学方程式总汇
高中化学必修2化学方程式总汇(知识点总结)第一章物质结构元素周期律1、Li与O2反应(点燃)P6Na与O2反应(点燃)P6Na与H…
-
化学必修二化学方程式总结
必修二化学方程式第一章物质结构元素周期律1Li与O2反应点燃4LiO2Na与O2反应点燃2NaO22Li2ONa2O2Na与H2O…
-
高中化学人教版必修二有机化合物化学方程式总结
高中化学人教版必修二有机化合物单元知识点总结甲烷燃烧CH4+2O2→CO2+2H2O(条件为点燃)甲烷隔绝空气高温分解甲烷分解很复…
-
高中化学必修二方程式总结(全面精确排版)
高中化学必修二化学方程式汇总1、Li与O2反应(点燃):2、K与H2O的反应:3、卤素单质氟与氢气反应:4、卤素单质氯与氢气反应:…
-
高中化学必修二方程式总结
高中化学人教版必修二相关化学方程式汇总第一章物质结构元素周期律1Li与O2反应点燃4LiO22Li2ONa与O2反应点燃2NaO2…
-
高中化学必修二重点方程式总结
高中化学必修二化学方程式汇总1Li与O2反应点燃2K与H2O的反应3卤素单质氟与氢气反应4卤素单质氯与氢气反应5卤素单质溴与氢气反…
-
高中化学必修一、二相关方程式汇总
高中化学必修一必修二相关化学方程式1硫酸根离子的检验BaCl2Na2SO4BaSO42NaCl2碳酸根离子的检验CaCl2Na2C…