仪器分析实验
《仪器分析》实验教学大纲
编写:胡继勇 审核:

一、课程简介
《仪器分析实验》是化学工程与工艺专业与《仪器分析》理论课程同步且紧密联系的实验课程。本课程的任务是培养学生的手、观察、记忆、思维、想象和表达等能力,促进学生的全面发展。具体到教学内容上则是重在使学生掌握常用分析仪器的基本原理、基本操作及应用等,掌握仪分析中处理数据的基本方法,了解仪器分析领域的最新发展动向及其趋势,巩固课堂所学理论知识,培养学生发现、分析、处理、解决问题的能力,加强学生素质教育,激发学生的创新精神,把学生培养成为适应社会发展要求的新型人才。
二、课程实验教学目的与要求
1、实验教学目的
通过仪器分析实验,使学生加深对有关仪器分析方法基本原理的理解,掌握仪器分析实验的基本知识和技能;学会正确地使用分析仪器;合理地选择实验条件;正确处理数据和表达实验结果;培养学生严谨求是的科学态度、勇于科技创新和独立工作的能力。
2、实验教学要求
通过本课程教学,要求学生对常用的仪器分析方法,如红外光谱法、原子吸收光谱法、分子荧光光谱法、紫外-可见吸收光谱法、气象色谱法、液相色谱法、电位分析法等方法的基本原理、仪器结构有比较深入的了解,基本掌握各种常用仪器的使用和操作方法,初步学会测试结果的分析处理和误差评估,并使学生的分析问题和独立解决实际问题的能力得到提高,扩大学生对仪器分析方法的知识面。
三、实验项目
实验一、 邻二氮菲分光光度法测定水中总铁
一、目的要求
1. 学习测定实验条件的方法和测定铁的分光光度法。
2. 掌握721型分光光度计的使用方法。
二、实验原理
根据朗伯-比尔定律,用紫外分光光度法可方便的测定在该光谱区域内有简单吸收峰的某一物质含量。若有两种不同成分的混合物共存,但一种物质的存在并不影响另一共存物的光吸收性质,则可以利用朗伯-比尔定律及吸光度的加合性,通过解联立方程组的方法对共存混合物分别测定。
紫外-可见吸光光谱法又称紫外-可见分光光度法,是以溶液中物质分子对光的选择性吸收为基础而建立起来的一类分析方法。紫外-可见吸收光谱的产生是由于分子的外层电子跃迁的结果,但是电子能级跃迁的同时,不可避免地亦伴随有分子振动能级和转动能级的跃迁,因此,紫外-可见吸收光谱为带光谱。
紫外-可见吸收光谱法进行定量分析的依据是朗伯-比尔定律,其数学表达式为:  =
=  bc
bc
其中:A为吸光度;I0和I分别为入射光强度和透射光强度; 为摩尔吸光系数,b为物质吸收层的厚度,c为物质的浓度。
为摩尔吸光系数,b为物质吸收层的厚度,c为物质的浓度。
根据朗伯-比尔定律,物质的浓度可通过测量吸光度的方法测定。光度分析时,分别将空白溶液和待测溶液装入厚度为b的两个洗手池中,让一束一定波长的平行光分别照射空白溶液和待测溶液,以通过空白溶液的透过光强为I0,通过待测溶液的透过光强为I,根据上式,又仪器直接给出吸光度。当吸收池及入射光的波长和强度一定时,吸光度正比于被测物的浓度,因此,可根据测得的吸光度值求出待测溶液的浓度。
在可见光区分光光度法测量中。通常是将被测物质于显色剂反应,使之生成有色物质,然后测其吸光度。进而求得被测物质的含量。因此,显色反应的完全程度和吸光度的测定条件都会影响到测定结果的准确性。为了使测定有较高的灵敏度和准确度,必须选择适宜的显色反应条件和仪器测量条件。通常所研究的显色反应条件有显色温度和时间,显色剂用量,显色液酸度,干扰物质的影响及消除等。通常所研究的测量条件主要是测量波长和参比溶液的选择。
条件实验的一般步骤为改变其中一个因素,暂时固定其他因素,显色后测量相应溶液的吸光度,通过吸光度-pH曲线确定显色反应的适宜酸度范围。其他因素的适宜值,也可按这一方式分别确定。本实验以邻二氮菲为显色剂,选择测定微量铁的适宜显色条件和测量条件,并用于工业盐酸中全铁含量的测定。邻二氮菲是光度法测定铁的优良试剂,在PH 2~9范围内(一般5~6),邻二氮菲与二价铁生成稳定的红色配合物,用盐酸羟胺将三价铁还原成二价,用邻二氮菲作显色剂,可测定试样中总铁含量。

三、仪器与试剂
(1)仪器:岛津UV—2100紫外-可见分光光度计;pH计;25ml容量瓶10个;1ml吸量管2支,其中一支用于移取铁标准溶液,另一支用于移取盐酸羟胺溶液;2ml吸量管1支,用于移取邻二氮菲溶液;5ml吸量管1支,用于移取醋酸钠溶液;25ml碱式滴定管1支,用于移取氢氧化钠溶液;洗耳球。
(2)试剂:
1)铁标准溶液(100.0цg/ml):准确称取0.8634g ,置于烧杯中,加入20mlHCl(1:1)和少量水,溶解后转移至1L容量瓶中,用水稀释至刻度,摇匀。
,置于烧杯中,加入20mlHCl(1:1)和少量水,溶解后转移至1L容量瓶中,用水稀释至刻度,摇匀。
2)盐酸羟胺溶液:10%(临用时配置)
3)邻二氮菲溶液:0.15%,先用少量水溶解,再用水稀释至所需溶度(避光保存,两周内有效)
4)醋酸钠溶液:1.0mol/L
5)氢氧化钠溶液:0.1mol/L
6)未知溶度的铁溶液(自来水、井水或河水)
四、实验步骤
(1)绘制吸收曲线:取两个25ml容量瓶,其中一个加入0.3ml贴标准溶液。然后在两容量瓶中各加入0.5ml盐酸羟胺溶液,摇匀,放置约2min。各加入1.0ml邻二氮菲和2.5ml出酸钠溶液,用水稀释至刻度,摇匀。用水做参比溶液,分别绘制上述两种溶液的吸收曲线。再用不含铁的试剂溶液做参比溶液,绘制有色配合物的吸收光谱。比较上述三种吸收光谱,选取最大吸收波长 为测定波长。
为测定波长。
(2)稳定性试验:在25ml容量瓶中,用上述方法配置含铁有机配合物溶液和试剂溶液,迅速摇匀,放置约2min,用1cm吸收池,以不含铁的试剂溶液做参比溶液,在选定的 下测定吸光度。记下吸光度和时间。以后间隔2.5min,10min,30min,60min,120min测定一次,记下相应的吸光度数值。
下测定吸光度。记下吸光度和时间。以后间隔2.5min,10min,30min,60min,120min测定一次,记下相应的吸光度数值。
(3)显色剂用量试验:在8个25ml容量瓶中,加入0.3ml贴标准溶液和0.5ml盐酸羟胺溶液,然后分别加入邻二氮菲溶液0ml,0.1ml,0.3ml,0.5ml,0.7ml,1.0ml,1.5ml和2.0ml。最后在个瓶中再加入2.5ml醋酸钠溶液,用水稀释至刻度,摇匀。用1cm吸收池,以不含显色剂的溶液做参比溶液,在选定的 下测定吸光度,记下咯吸光度值。
下测定吸光度,记下咯吸光度值。
(4)pH值得影响:在7个25ml容量瓶中,均加入0.3ml贴标准溶液、0.5ml。盐酸羟胺溶液、1.0ml邻二氮菲溶液,然后用滴定管依次假日0ml,2.5ml,5.0ml,7.5ml,10.0ml,12.5ml,15.0ml氢氧化钠溶液,用水稀释至刻度。摇匀。用pH及测定上列溶液的pH值,记下器数值。再用1cm吸收池,以水做参比溶液,在选定的波长下测定吸光度,记下吸光度值。
(5)测定不同溶度铁的吸光度:在6个25ml容量瓶中分别加入0.5ml盐酸羟胺溶液、10ml邻二氮菲溶液、2.5ml醋酸钠溶液,然后依次加入铁标准溶液0ml,0.2ml,0.4ml,0.6ml,0.8ml,1.0ml,用水稀释至刻度,摇匀。用1cm吸收池,以不含铁的试剂溶液做参比溶液,在选定波长下测定各溶液的吸光度,记下其数值。
【注意事项】
(1)为使盐酸羟胺将Fe3+还原成Fe2+反应进行完全,放置时间不应小于2min。
(2)在考察同一因素对显色反应的影响时,应保持一仪器的测定条件(例如光谱带通、扫描速度等)不变。
【结果处理】
(1)从实验步骤(1)的吸收曲线中,选取测定有色配合物的 。
。
(2)根据实验步骤(2)所记录数据,以时间为横坐标,吸光度为纵坐标,绘制吸光度—时间曲线,从曲线确定有色配合物的稳定时间。
(3)根据实验步骤(3)所记录数据,以邻二氮菲溶液体积为横坐标,吸光度为纵坐标,绘制吸光度—显色剂用量曲线,确定测定中显色剂的用量。
(4)根据实验步骤(4)所记录数据,以pH为横坐标,吸光度为纵坐标,绘制吸光度—pH值曲线,找到测定铁的适宜的pH值范围。
(5)根据实验步骤(5)所记录数据,以铁标准溶液溶度为横坐标,吸光度为纵坐标,绘制标准曲线。
(6)根据水样测得的吸光度茶得水中含铁量,按下式计算含铁量:

用最小二乘法求得回归方程及相关系数,即可得到水样中铁的总含量。
(7)计算铁—邻二氮菲配合物的摩尔吸收系数。
实验二、 循环伏安法测定铁氰化钾的电极反应过程
一、实验目的:
1.学习循环伏安法测定电极反应参数的基本原理及方法。
2.熟悉伏安仪使用技巧。
3.学习固体电极表面的处理方法。
二、实验原理:
循环伏安法(CV)是最重要的电分析化学研究方法之一。在电化学、无机化学、有机化学、生物化学等研究领域 得到了广泛应用。由于其设备价廉、操作简便、图谱解析直观,因而一般是电分析化学的首选方法。
CV方法是将循环变化的电压施加于工作电极和参比电极之间,记录工作电极上得到的电流与施加电压的关系曲线。这种方法也常称为三角波线性电位扫描方法。图1中表明了施加电压的变化方式:起扫电位为+0.8V,反向/起扫电位为-0.2V,终点又回扫到+0.8V,扫描速度可从斜率反映出来,其值为50mV/s。虚线表示的是第二次循环。一台现代伏安仪具有多种功能,可方便地进行一次或多次循环,任意变换扫描电压范围和扫描速度。

当工作电极被施加的扫描电压激发时,其上将产生响应电流。以该电流(纵坐标)对电位(横坐标)作图,称为循环伏安图。典型的循环伏安图如图2所示。该图是在1.0mol/L的KNO3电解质溶液中,6×10-3mol/L 的K3Fe(CN)6在Pt工作电极上反应得到的 结果。
从图可见,起始电位Ei为+0.8V(a点),电位比较正的目的是为了避免电极。

图 2 6×10–3 mol/L在1 mol/L的KNO3溶液中的循环伏安图
扫描速度:50 mV/s 铂电极面积:2.54 mm2
对可逆体系的正向峰电流,由Randles-savcik方程来表示:
ip= 2.69 ×105n3/2AD1/2V1/2C
方程式中:ip为峰电流(A) n为电子转移数
A为电极面积(cm2) D为扩散系数(cm2/s)
V为扫描速度(V/s) c为浓度 (mol/L)
三、仪器与试剂:
1)仪器:CHI电化学分析仪(包括计算机)、玻碳电极,辅助电极、参比电极组成电极系统。
2) 试剂:2.0 × 10–2 mol·L–1的铁氰化钾溶液;1.0 × 10–2 mol·L–1的硝酸钾溶液。
四、实验内容与步骤:
参见实验讲义。
五、数据处理:
1. 列表总结铁氰化钾的测量结果(Epa, Epc, ▽Ep, ipa,ipc)。
2. 绘制铁氰化钾的ipa,ipc与相应浓度c的关系曲线;绘制ipa,ipc与相应V1/2的关系曲线。
3. 求算铁氰化钾电极反应的n和Eθ。
实验四 、薄层色谱法对有机物的分离及定性分析
实验目的:
1. 学习薄层色谱分析的基本原理及其在有机化合物分析中的应用。
2. 掌握薄层色谱法的操作。
二、实验原理:
薄层层析法也称薄层色谱法(thin—layer chromatography),是快速分离和定性分析少量物料的一种非常重要的技术,常用TLC表示。其依然应用的是色谱分析法的基本原理,利用混合物中各组分作相对运动时,使各组分在两相中反复的多次受到上述作用力的作用而得到分离。TLC是色谱技术的一种,与经典的分离提纯手段(重结晶、升华、萃取和蒸馏等)相比,薄层色谱法具有微量、快速、分离效率高和灵敏度高等优点。
薄层色谱是可以提供大量定性定量信息的方法之一,但对其色谱的质量应进行精心的研究,薄层色谱绝大多数为正相色谱,操作简单,快速,可同时比较、鉴别多种样品,独具特色。吸附薄层色谱是使用最为广泛的方法,其原理概括起来是:由于混合物中的各个组分对吸附剂(固定相)的吸附能力不同,当展开剂(流动相)流经吸附剂时,发生无数次吸附和解吸过程,吸附力弱的组分随流动相迅速向前移动,吸附力强的组分滞留在后,由于各组分具有不同的移动速度,最终得以在固定相薄层上分离。
一个化合物在薄层板上上升的高度与展开剂上升的高度的比值称为该化合物的Rf值:化合物移动的距离 展开剂前沿移动的距离 Rf的意思是“ration to front”(即与前沿之比)。当测量条件全部规定好后(包括:所用的展开剂体系,吸附剂,吸附剂的厚度,点在板上的试样的相对数量等),任何一种稳定化合物的Rf值是个常数,而且它相当于该化合物的一个物理性质。

三、仪器与试剂:
点样用毛细管,硅胶层析板两块硅胶层析板两块硅胶层析板两块硅胶层析板两块,卧式层析槽一个。
四、实验步骤:
1、薄层板的制备
然后将糊状浆液倒在洁净的载玻片上,用手轻轻振动,使涂层均匀平整,大约可铺8×3 cm 载玻片6-8块。室温下晾干,然后在110 ℃烘箱内活化0.5 h。 用低沸点溶剂(如乙醚、丙酮或氯仿等)将样品配成1%左右的溶液,然后用内径小于l mm 的毛细管点样。
2、点样
点样前,先用铅笔在层析上距末端l cm处轻轻画一横线,然后用毛细管吸取样液在横线上轻轻点样,如果要重新点 -样,一定要等前一次点样残余的溶剂挥发后再点样,以免点样斑点过大。一般斑点直径大于2 mm。如果在同一块薄层板上点两个样,两斑点间距离应保持1-1.5 cm为宜。干燥后就可以进行层析展开。 以广口瓶作展开器,进入展开剂,其量以液面高度0.5 cm为宜。在展开剂中靠瓶壁放人一张滤纸,使器皿内易于达到气液平衡。滤纸全部被溶剂润湿后,将点过样的薄层板斜置于其中,使点样一端朝下,保持点样斑点在展开剂液面之上,盖上盖子。
3、定位及定性分析
当展开剂上升至离薄层板上端约l cm 处时,将薄层板取出,并用铅笔标出展开剂的前沿位置。然后计算各斑点的Rf值。
4、实验注意事项
A)铺板时一定要均匀,特别是边、角部分,晾干时要平整的放;
B) 点样时点要细,直径不要大于2 mm,间隔0.5 cm以上,浓度不可过大,以免出现拖尾、混杂现象;
C)展开用的烧杯要洗净、烘干,放入板之前,要先加展开剂,盖上表明皿,让烧杯内形成一定的蒸汽压。点样的一端要侵入展开剂中0.5 cm,但展开剂不可没过原点。
五、结果处理:
参见实验讲义。
实验五、气相色谱法测定醇的同系物
一、目的要求:
1.熟悉色谱分析的原理及色谱工作站的使用方法。
2.用保留时间定性;用归一化法定量;用分辩率对实验数据进行评价。
二、实验原理:
不同组分在同一分离色谱柱上,与色谱柱的作用力大小会有差异,分配系数不一样,会在分离柱中一个差速移动的过程,从而以不同的时间从分离柱流出,进而在相同实验条件下有不同的保留行为,其保留时间的差异可以用来定性分析,每一组分的质量与相应色谱峰的积分面积成正比,因此可以公式计算,用归一化方法测定每一组分的质量百分含量。
 ×100%
×100%
本实验是用气相色谱测定乙醇、丙醇、丁醇、异戊醇及其混合试样,检测器用FID。用色谱软件进行谱图处理和定量计算,让学生掌握用已知物对照定性、用归一化法测定混合物组分定量的实验。
用乙醇、丙醇、丁醇、异戊醇及其混合物为测定样品,经大量实验优化筛选,此时用HMDS:PEG-20000 = 100:15为固定相,分析效果良好。将填充好的长2 m内径2 mm的色谱柱的进口端接入色谱仪,出口端放空,在0.3 Mpa的载气和200 oC的柱温下老化8 h。老化好的色谱柱出口端接通FID。
 混和试样的成功分离是气相色谱法定量分析的前提和基础,衡量一对色谱峰分离的程度可用分离度: ,式中
混和试样的成功分离是气相色谱法定量分析的前提和基础,衡量一对色谱峰分离的程度可用分离度: ,式中 和Y1、Y2分别指两组分的保留时间和峰底宽度,R=1.5时两组分完全分离,实际中R=1.0(分离度98%)即可满足要求。
和Y1、Y2分别指两组分的保留时间和峰底宽度,R=1.5时两组分完全分离,实际中R=1.0(分离度98%)即可满足要求。
三、实验步骤:
1)打开氢气、空气发生器,仪器载气,启动色谱仪器。
2)点火,设置仪器测试参数。
3)恒温测试:设置气化室、色谱柱、检测器的温度,进行恒温测试。
4)程序升温:设置色谱柱的初始温度,终止温度,升温速率,停留时间等参数,进行混合样品的分离,并筛选具有较好分离效果的条件。
5)利用第4步筛选的实验条件,做标样的色谱图。
四、 数据处理:
定性:利用纯物质的保留时间来进行混合物中各组分的定性,给出混合样中相应组分的名称,使色谱定性简单、准确。
 定量:归一化法是最简便、最常使用的色谱定量方法,归一法的条件要求是被测样品中的所
定量:归一化法是最简便、最常使用的色谱定量方法,归一法的条件要求是被测样品中的所
都必须出峰,要得到某组分的含量: × 100%,就必须知道所有组分的峰面积Ai和相应的校正因子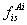 。
。
五、注意事项:
1.工作站各设备开、关次序。
2.注射器的正确使用:小心插针/快速注入/匀速拔出/及时归位。
3.氢气使用安全问题。
实验七 红外光谱法测定有机化合物的结构
一、目的要求:
1、了解运用红外光谱法鉴定未知物的一般过程,掌握用标准谱库进行化合物鉴定的一般方法;
2、了解红外光谱仪的结构和原理,掌握红外光谱仪的操作方法。
二、实验原理:
红外光谱的三要素:
1)谱带位置:红外光谱的位置即谱带所对应的频率,对应着化合物中分子或基团的振动形式,如3756 cm–1,3657 cm–1,对应着OH–键的伸缩振动, 1430 cm–1对应着CO32–的伸缩振动,1120 cm–1对应着SO4–2的伸缩振动。因此,谱带位置是指示某一分子或某一基团存在的标志。对于同一基团来说,伸缩振动频率较高,弯曲振动频率较低。对不同基团来说,价键越强,振动频率就越高;同一价键连接的原子就越轻,振动频率就越高。
2)谱带形状:红外谱带的形状也是由物质的分子内或基团价键的振动形式决定的。每一物态,每一基团,每一振动形式对应着一定的谱带形状。因此,红外光谱带的形状也能揭示物质结构的信息。结晶好的物质吸收谱带较尖较窄,无机物基团的吸收谱带大而宽,有机物的吸收谱带尖而窄;对称性高的分子或基团图谱带连续完整,对称性低者出现分裂谱带。因此,物质的红外吸收谱带位置能指示基团的存在,而谱带的形状能反应物质的状态和结构细节。
3)相对强度:红外光谱的相对强度是指某物质的所有红外吸收谱带相对于某一吸收的比值。每一物质,每一吸收谱带的相对强度都是一定的,它同样的是由该吸收谱带所对应的价键的振动而决定的。当价键振动时,引起偶极矩的变化大,红外吸收的谱带强度大;对于同一基团来说,伸缩振动吸收谱带强度大,弱极性基团的谱带强度小。因此,每一种物质的各个红外吸收谱带的相对强度变化是有一定规律的,可以检验结构基团或化合物存在的证据。同时,要正确理解电子诱导效应,空间结构对红外基团振动频率的影响。
三、仪器与试剂:
1)Bruker 33型红外光谱仪、压片和压膜设备、镊子,脱脂棉等。
2)分析级试剂:苯甲酸;苯乙酮;对硝基苯甲酸;溴化钾粉末;乙醇。
四、实验步骤:
1.制样:样品的准备并用压片法,或液膜法来制样。
2.打开仪器主机和仪器工作站,带指示灯变绿且闪烁时为仪器进入测试状态,打开红外光谱仪工作站。
3.确定扫描谱图的格式是透过率还是吸光度及扫描次数,然后扫描机器的背景。
4.扫描样品,在得到谱图后,进行基线校正,谱图平滑,标峰等系列操作。
五、结果处理:
1.在测绘的谱图上标出所有吸收峰的波数位置。
2.对确定的化合物,列出主要吸收峰并指认归属。
3.区分饱和烃和饱和烃的主要标志是什么。
4.羰基化合物谱图的主要特征。
5.芳香烃的特征吸收在什么位置。
实验八、荧光分析法测定药品中的羟基苯甲酸异构体含量
一、目的要求
1.掌握荧光分析法的基本原理和操作。
2.用荧光分析法进行多组分含量的测定。
二、实验原理
分子轨道是由原子轨道,基态的有机化合物分子在吸收了量子化的能量以后,分子轨道上的就会由较低轨道能级跃迁到较高轨道能级,由基态变为激发态的分子。激发态的分子可以以辐射跃迁的形式释放能量,在此过程中会有发光现象;激发态的分子也可以非辐射跃迁的形式到达基态,如外转换、内转换、系间跨越、振动弛豫等形式,在这些过程中没有发光现象发生。邻-羟基苯甲酸(亦称水杨酸)和间-羟基苯甲酸分子组成相同,均含一个能发射荧光的苯环,但因其取代基的位置不同而具有不同的荧光性质。在pH=12的碱性溶液中,二者在310nm附近紫外光的激发下均会发射荧光;在pH=5.5的近中性溶液中,间-羟基苯甲酸不发射荧光,邻-羟基苯甲酸由于分子内形成氢键增加了分子刚性而有较强的荧光,且荧光强度与pH=12时相同。利用这一性质,可在pH=5.5测定二者混合物中邻-羟基苯甲酸的含量,间-羟基苯甲酸不干扰。另取同样量的混合物溶液,测定pH=12的荧光强度,减去pH=5.5时测得的邻-羟基苯甲酸的荧光强度,即可求出间-羟基苯甲酸的含量。
三、仪器与药品
CRT970型荧光分光光度计;10ml比色管;分度吸量管;
邻-羟基苯甲酸标准溶液:60 (水溶液);间-羟基苯甲酸标准溶液:60
(水溶液);间-羟基苯甲酸标准溶液:60 (水溶液);NaOH水溶液:0.1mol/L;
(水溶液);NaOH水溶液:0.1mol/L;
pH=5.5的HAc-NaAc缓冲溶液:47g NaAc和6g冰醋酸溶于水并稀释至1L即得。
四、实验步骤
1. 标准系列溶液的配制:
2.荧光激发光谱和发射光谱的测定:激发波长 和发射波长
和发射波长 。
。
3. 荧光强度测定:标准系列各溶液和未知溶液的荧光强度If。
五、仪器操作步骤:
1、工作曲线的测定和未知液测定时应保持仪器设置参数的一致;
2、开机时先开氙灯再开计算机;关机时先关计算机再关主机电源;
六、结果处理:
以各标准溶液的If为纵坐标,分别以邻-羟基苯甲酸或间-羟基苯甲酸的浓度为横坐标制作工作曲线。根据pH=5.5的未知液的荧光强度,可以从邻-羟基苯甲酸的工作曲线上确定邻-羟基苯甲酸在未知液中的浓度;根据pH=12时未知液的荧光强度与pH=5.5时未知液的荧光强度的差值,可从间-羟基苯甲酸的工作曲线上确定未知液中间-羟基苯甲酸的浓度。
四、实验项目学时分配表

五、实验报告格式
实验完毕,应用专门的实验报告本,根据预习和实验中的现象及数据记录等,及时而认真地写出实验报告。仪器分析实验报告一般应包含以下内容:
实验(编号) 实验名称
(一)实验目的
(二)实验原理:简要地用文字或化学反应式说明实验涉及的化学反应及原理;画出实验仪器的简单装置图,并简要地画出实验流程图。
(三)仪器和试剂:标出使用仪器的型号及主要部件的规格、仪器使用条件; 指明主要试剂的规格。
(四)实验步骤:简明扼要地写出仪器操作方法、实验步骤流程,并写明实验现象。
(五)实验数据及其处理:应用文字或表格或图形将实验数据表示出来,将实验得到的原始图全部或选取具有代表性的部分附在实验报告上。根据实验要求及计算公式计算出分析结果,并对分析结果进行有关数据和误差处理,尽可能地使记录表格化。
(六)问题讨论: 包括实验教材上的思考题,结合仪器分析理论教学中的有关知识,对实验现象、产生的误差等进行讨论和分析。
六、考核方式及成绩评定标准
1.考核内容:实验前的预习报告、实验操作、实验报告及实验表现。
2.考核方法:每次实验单独记分,实验报告占70%,其它各项占30%。
七、教材及参考书
教 材:《仪器分析实验》,李志富主编、华中科技大学出版社,2012.1
参考书:
1、《仪器分析实验》,刘志广主编,大连理工大学出版社,20##年
2、《仪器分析》,万惠群、于俊生、史坚编,科学出版社,北京,2002
3、《基础分析化学实验》,北京大学化学系仪器分析教学组编,北京大学出版社,北京,1993
-
仪器分析实验报告
仪器分析实验报告1质谱仪的简介质谱仪是通过对样品电离后产生的具有不同质荷比mz的离子来进行分离分析的先将待分析样品变成气态在具有一…
-
仪器分析实验1——实验报告
原子吸收分光光度法测定水样中钠离子含量班级09化工3班姓名肖普学号0910370315一实验目的1掌握原子吸收分光光度法测定水样中…
-
仪器分析实验报告书写
每人一份复印后按照要求认真写出实验报告液相色谱实验一实验报告的书写要求实验题目液相色谱仪的结构和工作原理实验目的掌握液相色谱仪的结…
-
仪器分析实验报告
实验一紫外可见分光光度计的性能检验一实验目的1掌握紫外可见分光光度计性能的检验方法2学会UV1100型紫外可见分光光度计的使用方法…
-
仪器分析实验报告
现代分析仪器观摩见习实习报告姓名朱亚伟学号15124059院系生物化学系年级专业12级化学工程与工艺现代分析仪器观摩见习实习报告作…
-
仪器分析实验教学总结
20xx-20xx学年第二学期仪器分析化学实验总结仪器分析法是测定物质化学组成、状态、结构的重要方法,也是监测物理、化学等过程的重…
-
仪器分析实验总结
仪器分析实验总结1014061525虞梦娜一红外光谱仪实验报告1仪器结构仪器设备SHIMADZUIRPresting21型傅立叶变…
-
仪器分析实验2——实验报告
气相色谱法测定空气中氧气与氮气的浓度班级09化工3班姓名肖普学号0910370315一实验目的1掌握气相色谱法测定物质浓度的基本原…
-
仪器分析实验1——实验报告
原子吸收分光光度法测定水样中钠离子含量班级09化工3班姓名肖普学号0910370315一实验目的1掌握原子吸收分光光度法测定水样中…
-
仪器分析实验. 预习报告答案(1)
一取代基电效应对芳烃吸收带的影响1紫外吸收光谱是由何种跃迁产生的有哪几种跃迁类型分为哪几个吸收带电子能级跃迁振动转动能级跃迁紫外吸…