实验四 混合碱中NaOH Na2CO3含量的测定
实验四 混合碱中NaOH Na2CO3含量的测定
总学时:4学时
一、实验目的
1. 掌握HCl标准溶液的配制和标定方法
2. 了解测定混合碱中NaOH Na2CO3含量的原理和方法
3. 掌握在同一份溶液中用双指示剂法测定混合碱中NaOH Na2CO3含量的测定
二、实验原理
碱液易吸收空气中的CO2形成Na2CO3,苛性碱实际上往往含有Na2CO3,故称为混合碱,在标定时,反应如下:
NaOH + Hcl ==== NaCl + H2O
Na2CO3 + Hcl ==== NaHCO3 + H2O
NaHCO3 + Hcl ==== NaCl + CO2 + H2O
可用酚酞及甲基橙来分别作指示剂,当酚酞变色时,NaOH全部被中和,而Na2CO3只被中和到一般,在此溶液汇总再加甲基橙指示剂,继续滴加到终点,则滴定完成
三、实验仪器及试剂
1. HCl标准溶液 酚酞
2. 0.2%乙醇溶液
3. 0.2%甲基橙指示剂
四、实验注意事项、特别提示
1. 在溶解混合碱试样时一定要用新煮沸的冷蒸馏水,使其充分的溶解,然后再移入容量瓶里,最后再用新煮沸的冷蒸馏水稀释至刻度
2. 如果待测试样为混合碱溶液,则直接用移液管准确吸取25ml试液三分,分别加入冷蒸馏水,按同法进行测定
3. 测定速度要慢,接近终点时每加一滴后摇匀,至颜色稳定后再加入第二滴,否则,因为颜色变化太慢,容易过量
五、思考题
1. 什么叫双指示剂法?
2. 为什么可以用双指示剂法测定混合碱的含量?
六、教学实施经验小记
有了上次实验的基础,同学做这个实验比较轻松,主要是在接近终点时有的同学滴加速度较快,影响了对终点的判断。还有就是对终点颜色的判断存在问题。
分析化学实验报告
班级 _________ 姓名___________ 报告日期_____________
实验四 混合碱中NaOH Na2CO3含量的测定
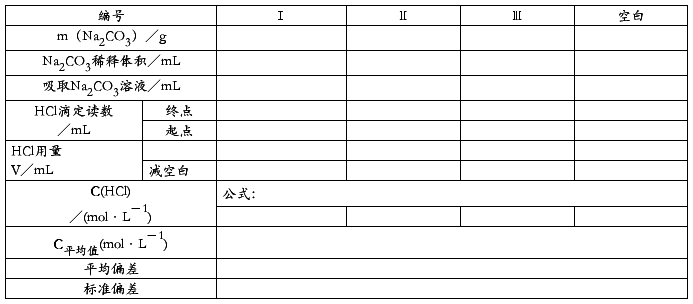
(一)HCl溶液浓度的标定
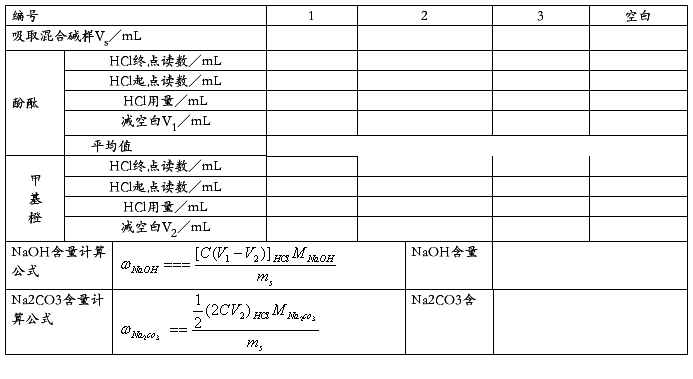
(二)混合碱中NaOH Na2CO3含量的测定
结果与讨论:
第二篇:混合碱的测定
实验九 混合碱的分析(双指示剂法)
1、实验目的
①了解酸碱滴定法的应用。
②掌握双指示剂法测定混合碱的原理和组成成份的判别及计算方法。
2、实验原理
混合碱是Na2CO3与 NaOH 或Na2CO3与NaHCO3的混合物。欲测定同一份试样中各组份的含量,可用HCl标准溶液滴定,选用两种不同指示剂分别指示第
一、第二化学计量点的到达。根据到达两个化学计量点时消耗的HCl标准溶液的体积,便可判别试样的组成及计算各组份含量。
在混合碱试样中加入酚酞指示剂,此时溶液呈红色,用HCl标准溶液滴定到溶液由红色恰好变为无色时,则试液中所含NaOH完全被中和,Na2CO3则被中和到NaHCO3,若溶液中含 NaHCO3,则未被滴定,反应如下:
NaOH + HCl = NaCl + H2O
Na2CO3 + HCl = NaCl + NaHCO3
设滴定用去的HCl标准溶液的体积为 V1(mL) ,再加入甲基橙指示剂,继续用HCl标准溶液滴定到溶液由黄色变为橙色。此时试液中的 NaHCO3 (或是Na2CO3第一步被中和生成的,或是试样中含有的)被中和成CO2和H2O。
NaHCO3 + HCl = NaCl + CO2 - + H2O
此时,又消耗的HCl标准溶液(即第一计量点到第二计量点消耗的)的体积为V2(mL)。
当 V1 > V2 时,试样为Na2CO3与NaOH的混合物,中和Na2CO3所需HCl是分两批加入的,两次用量应该相等。即滴定Na2CO3所消耗的HCl的体积为2V2 ,而中和 NaOH 所消耗的 HCl的体积为(V1 –V2) ,故计算NaOH和Na2CO3的浓度公式应为:
CNaOH = (V1 –V2)·CHCl/10.00
CNa2CO3 = V2·CHCl/10.00
当V1 < V2时,试样为Na2CO3与NaHCO3的混合物,此时V1为中和Na2CO3时所消耗的HCl的体积,故Na2CO3所消耗的HCl的体积为2V1,中和NaHCO3消耗的HCl的体积为(V2–V1),计算NaHCO3和Na2CO3浓度的公式为:
CNaHCO3 = (V2–V1) ·CHCl/10.00
CNa2CO3 = V1·CHCl/10.00
3、试剂
①无水碳酸钠(基准试剂)。
②甲基橙指示剂:0.2%水溶液。
③酚酞指示剂:0.2%乙醇溶液。
④混合指示剂:3 份0.1%溴甲酚绿乙醇溶液加1份0.2%甲基红乙醇溶液。 ⑤浓HCl:约12 mol/L 。
4、分析步骤
① 0.1 mol/L HCl 标准溶液的配制与标定
用小量筒量取所需体积的浓HCl,倒入洗净的试剂瓶中,加蒸馏水稀释至 500 mL,充分摇匀。
无水碳酸钠放在称量瓶中,于烘箱中在150oC 下烘 l 小时。在干燥器中冷却后,用减量法准确称取 0.06~0.10 g 三份(称量速度要快些,称量瓶要盖严)于 250 mL 锥形瓶中,加水 10~15 mL,溶解后,加甲基橙指示剂 1~2 滴,用HCl溶液滴定至溶液由黄色变为橙色即为终点。计算HCl溶液的浓度及相对平均偏差。
②混合碱的测定
用10.00 mL的移液管平行移取试液10.00 mL三份于250 mL锥形瓶中,加水10~15 mL,酚酞指示剂1~2滴,用标定好的HCl标准溶液滴定至溶液恰好由红色褪至无色,记下消耗的HCl标准溶液的体积V1。再加入甲基橙指示剂1~2 滴(或加甲基红-溴甲酚绿指示剂),继续用HCl标准溶液滴定至溶液由黄色变为橙色(用混合指示剂则由蓝绿色变为酒红色),又消耗的HCl溶液的体积记为V2。按原理部分判断试样的组成并计算各组份的含量及相对平均偏差。
5、预习思考题
①双指示剂法测定混合碱,在同一份溶液中测定,判断在下列五种情况下试样的组成:(a) V1 = 0 (b) V2 = 0 (c) V1 > V2 (d) V1 < V2 (e) V1 = V2
②测定混合碱时,酚酞褪色前,由于滴定速度太快,摇动不均匀,使滴入的 HCl 局部过浓致使 NaHCO3 迅速转变为 H2CO3 并分解为 CO2 ,当酚酞恰好褪色时,记下HCl体积 V1,这对测定结果有何影响?
-
混合碱的组成及其含量的测定
多元酸的滴定用强碱滴定多元酸时首先根据cKa108的原则判断它是否能准确进行滴定然后看相邻两级Ka的比值是否大于105再判断它能否…
- 混合碱含量的分析测定
-
实验九 混合碱中各组分含量的测定
实验九混合碱中各组分含量的测定微型滴定法一实验目的1了解利用双指示剂法测定Na2CO3和NaHCO3混合物的原理和方法2学习用参比…
-
混合碱的分析实验报告
实验姓名一实验目的班混合碱的分析实验报告级柜号日期二原理三实验步骤流程图四实验结果与讨论1molL1HCl溶液浓度的标定滴定序号无…
-
实验四 混合碱中NaOH Na2CO3含量的测定
实验四混合碱中NaOHNa2CO3含量的测定总学时4学时一实验目的1掌握HCl标准溶液的配制和标定方法2了解测定混合碱中NaOHN…
-
钻井液中固相含量的测定实验报告
中国石油大学油田化学实验报告实验日期成绩班级学号姓名教师同组者实验四钻井液中固相含量的测定一实验目的1掌握固相含量测定仪的操作方法…
-
土壤含水量的测定实验报告书
1实验二土壤含水量的测定烘干法与酒精燃烧法一目的意义进行土壤含水量的测定有两个目的一是为了解田间土壤的实际含水情况以便及时进行播种…
-
混合碱的分析实验报告
实验姓名一实验目的班混合碱的分析实验报告级柜号日期二原理三实验步骤流程图四实验结果与讨论1molL1HCl溶液浓度的标定滴定序号无…
-
混合碱的组成及其含量的测定
多元酸的滴定用强碱滴定多元酸时首先根据cKa108的原则判断它是否能准确进行滴定然后看相邻两级Ka的比值是否大于105再判断它能否…
-
实验九 混合碱中各组分含量的测定
实验九混合碱中各组分含量的测定微型滴定法一实验目的1了解利用双指示剂法测定Na2CO3和NaHCO3混合物的原理和方法2学习用参比…
-
大学物理化学实验报告-燃烧热的测定
物理化学实验报告院系化学化工学院班级化学061学号13姓名实验名称燃烧热的测定日期20##.5.20同组者姓名室温气压成绩一、目的…