原电池电动势的测定及其应用实验报告
原电池电动势的测定及其应用实验报告
林传信 高分子101 1017051012
一、实验目的
1、理解电极、电极电势、电池电动势、可逆电池电动势的意义
2、掌握用对消法测定电池电动势的基本原理和数字式电子电位差计的使用方法
3、学会几种电极和盐桥的制备方法
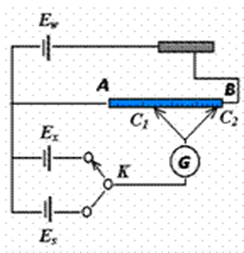
二、对消法侧电动势的基本原理:
测量电动势只能在无电流通过电池的情况下进行,因此需要用对消法(补偿法)来测定电
动势。对消法测定电动势就是在所研究的电池的外电路上加一个方向相反的电压。当两者
相等时,电路的电流为零(通过检流计指示)。对消法测电动势常用的仪器为电位差计,
其简单原理如图所示

电极电势的测定原理:
原电池是化学能转变为电能的装置,在电池放电反应中,正极(右边)起还原反应,负极起
氧化反应。电池的电动势等于组成的电池的两个电极电位的差值。即:
E=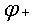 —
—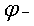 =
=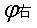 —
—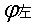
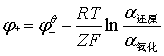
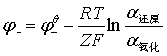 R=8.314J
R=8.314J
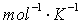
F=96500C 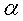 为参与电极反应的物质的活度。纯固体物质的活度为1。
为参与电极反应的物质的活度。纯固体物质的活度为1。
浓差电池:
一种物质从高浓度(或高压力)状态向低浓度(或低压力)状态转移,从而产生电动势,而
这种电池的标准电动势为零。
三、电池组合:
⑴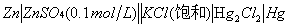
⑵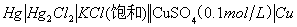
⑶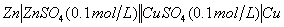
⑷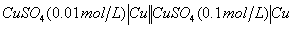
四、数据处理
实验室温度T=281.15 标准电动势Es=1000.03mV
电池电极电动势:
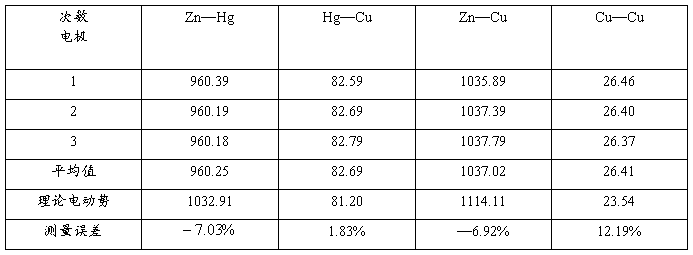
五、误差分析
在较长的电极电势测量过程中,工作回路中电流发生变化,导致测量误差
部分电解质溶液在测量过程中发生电解,浓度变化影响测量的结果
第二篇:原电池电动势的测定实验报告
实验九 原电池电动势的测定及应用

一、实验目的
1.测定Cu-Zn电池的电动势和Cu、Zn电极的电极电势。
2.学会几种电极的制备和处理方法。
3.掌握数字电位差计的测量原理和正确的使用方法。
二、实验原理
电池由正、负两极组成。电池在放电过程中,正极起还原反应,负极起氧化反应,电池内部还可以发生其它反应,电池反应是电池中所有反应的总和。
电池除可用来提供电能外,还可用它来研究构成此电池的化学反应的热力学性质。从化学热力学知道,在恒温、恒压、可逆条件下,电池反应有以下关系:
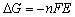 (9-1)
(9-1)
式中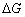 是电池反应的吉布斯自由能增量;n为电极反应中得失电子的数目;F为法拉第常数(其数值为96500
是电池反应的吉布斯自由能增量;n为电极反应中得失电子的数目;F为法拉第常数(其数值为96500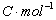 );E为电池的电动势。所以测出该电池的电动势E后,进而又可求出其它热力学函数。但必须注意,测定电池电动势时,首先要求电池反应本身是可逆的,可逆电池应满足如下条件:
);E为电池的电动势。所以测出该电池的电动势E后,进而又可求出其它热力学函数。但必须注意,测定电池电动势时,首先要求电池反应本身是可逆的,可逆电池应满足如下条件:
(1)电池反应可逆,亦即电池电极反应可逆;
(2)电池中不允许存在任何不可逆的液接界;
(3)电池必须在可逆的情况下工作,即充放电过程必须在平衡态下进行,亦即允许通过电池的电流为无限小。
因此在制备可逆电池、测定可逆电池的电动势时应符合上述条件,在精确度不高的测量中,常用正负离子迁移数比较接近的盐类构成“盐桥”来消除液接电位。
在进行电池电动势测量时,为了使电池反应在接近热力学可逆条件下进行,采用电位计测量。原电池电动势主要是两个电极的电极电势的代数和,如能测定出两个电极的电势,就可计算得到由它们组成的电池的电动势。由(9-1)式可推导出电池的电动势以及电极电势的表达式。下面以铜-锌电池为例进行分析。电池表示式为:
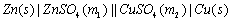
符号“|”代表固相(Zn或Cu)和液相(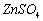 或
或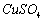 )两相界面;“‖”代表连通两个液相的“盐桥”;
)两相界面;“‖”代表连通两个液相的“盐桥”;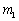 和
和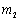 分别为
分别为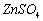 和
和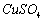 的质量摩尔浓度。
的质量摩尔浓度。
当电池放电时,
负极起氧化反应: 
正极起还原反应: 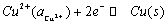
电池总反应为: 
电池反应的吉布斯自由能变化值为:
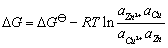 (9-2)
(9-2)
上述式中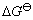 为标准态时自由能的变化值;
为标准态时自由能的变化值;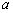 为物质的活度,纯固体物质的活度等于1,即
为物质的活度,纯固体物质的活度等于1,即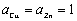 。而在标态时,
。而在标态时,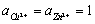 ,则有:
,则有:
 (9-3)
(9-3)
式中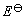 为电池的标准电动势。由(9-1)至(9-1)式可得:
为电池的标准电动势。由(9-1)至(9-1)式可得:
 (9-4)
(9-4)
对于任一电池,其电动势等于两个电极电势之差值,其计算式为:
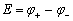 (9-5)
(9-5)
对铜-锌电池而言 
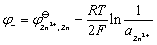
式中 和
和 是当
是当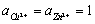 时,铜电极和锌电极的标准电极电势。
时,铜电极和锌电极的标准电极电势。
对于单个离子,其活度是无法测定的,但强电解质的活度与物质的平均质量摩尔浓度和平均活度系数之间有以下关系: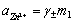
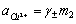
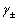 是离子的平均离子活度系数,其数值大小与物质浓度、离子的种类、实验温度等因数有关。
是离子的平均离子活度系数,其数值大小与物质浓度、离子的种类、实验温度等因数有关。
在电化学中,电极电势的绝对值至今无法测定,在实际测量中是以某一电极的电极电势作为零标准,然后将其它的电极(被研究电极)与它组成电池,测量其间的电动势,则该电动势即为该被测电极的电极电势。被测电极在电池中的正、负极性,可由它与零标准电极两者的还原电势比较而确定。通常将氢电极在氢气压力为101325Pa,溶液中氢离子活度为1时的电极电势规定为零伏,即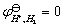 ,称为标准氢电极,然后与其它被测电极进行比较。
,称为标准氢电极,然后与其它被测电极进行比较。
由于氢电极使用不便,常用另外一些易制备、电极电势稳定的电极作为参比电极,常用的参比电极有甘汞电极。
以上所讨论的电池是在电池总反应中发生了化学变化,因而被称为化学电池。还有一类电池叫做浓差电池,这种电池在净作用过程中,仅仅是一种物质从高浓度(或高压力)状态向低浓度(或低压力)状态转移,从而产生电动势,而这种电池的标准电动势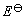 等于零伏。
等于零伏。
例如电池 就是浓差电池的一种。
就是浓差电池的一种。
电池电动势的测量工作必须在电池可逆条件下进行,必须指出,电极电势的大小,不仅与电极种类、溶液浓度有关,而且与温度有关。本实验是在实验温度下测得的电极电势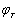 ,由(9-6)式和(9-7)式可计算
,由(9-6)式和(9-7)式可计算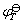 。为了比较方便起见,可采用下式求出298K时的标准电极电势
。为了比较方便起见,可采用下式求出298K时的标准电极电势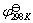 。
。

式中 、
、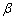 为电极电势的温度系数。对于Cu-Zn电池来说:
为电极电势的温度系数。对于Cu-Zn电池来说:
铜电极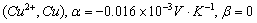
锌电极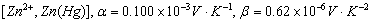
三、仪器和试剂

四、实验步骤
1.电极的制备
(1)锌电极:将锌电极在稀硫酸溶液中浸泡片刻,取出洗净,再浸入汞或饱和硝酸亚汞溶液中约10s,表面上即生成一层光亮的汞齐,用水冲洗晾干后,插入0.1000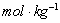
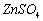 中待用。
中待用。
(2)铜电极:将铜电极在6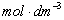 的硝酸溶液中浸泡片刻,取出洗净,将铜电极置于电镀烧杯中作为阴极,另取一个经清洁处理的铜棒作阳极,进行电镀,电流密度控制在20
的硝酸溶液中浸泡片刻,取出洗净,将铜电极置于电镀烧杯中作为阴极,另取一个经清洁处理的铜棒作阳极,进行电镀,电流密度控制在20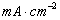 为宜。其电镀装置如图9-1所示。电镀半小时,使铜电极表面有一层均匀的新鲜铜,洗净后放入0.1000
为宜。其电镀装置如图9-1所示。电镀半小时,使铜电极表面有一层均匀的新鲜铜,洗净后放入0.1000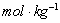
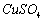 中备用。
中备用。
2.电池组合
将饱和KCl溶液注入50mL的小烧杯内,制盐桥,再将上面制备的锌电极和铜电极
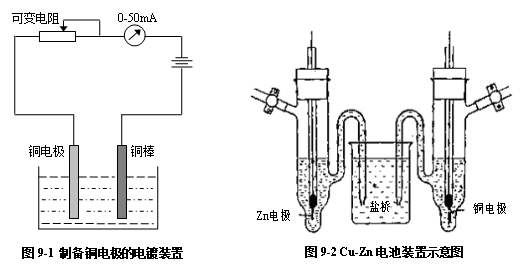 置于小烧杯内,即成Cu-Zn电池:
置于小烧杯内,即成Cu-Zn电池:
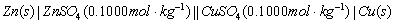
电池装置如图9-2所示。
同法组成下列电池:
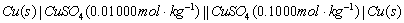
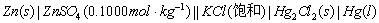
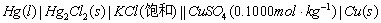
3.电动势的测定
(1)按照电位差计电路图,接好电动势测量线路。
(2)根据标准电池的温度系数,计算实验温度下的标准电池电动势。以此对电位差计进行标定。
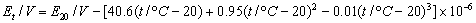
(3)分别测定以上电池的电动势。
五、数据记录及处理
1.将试验数据列表。
标准溶液NaoH浓度为0.102mol/L
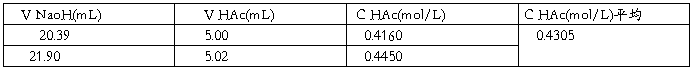
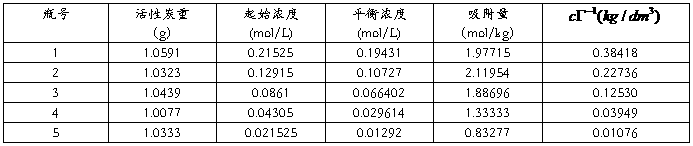
2.计算各瓶中醋酸的起始浓度c0,平衡浓度c及吸附量?(mol? kg-1)。
计算结果如上表。
由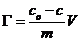 计算吸附量。
计算吸附量。
3.吸附量对平衡浓度作等温线。

4.作c/?-c图,并求出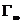 和常数K。
和常数K。
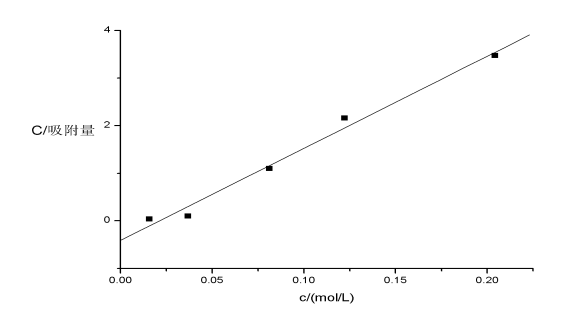
由直线斜率得: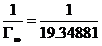
 =0.05168mol/kg
=0.05168mol/kg
由直线截距得: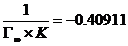
K=-47.29
5.由 计算活性炭的比表面。
计算活性炭的比表面。

=756.006
● 结果与讨论
1.比表面测定与哪些因素有关,为什么?
a. 测定固体比表面时所用溶液中溶质的浓度要选择适当,即初始溶液的浓度以及吸附平衡后的浓度都选择在合适的范围内。既要防止初始浓度过高导致出现多分子层吸附,又要避免平衡后的浓度过低使吸附达不到饱和。如次甲基蓝在活性炭上的吸附实验中原始溶液的浓度为2g·dm-3左右,平衡溶液的浓度不小于1mg·dm-3。
b. 按朗格谬尔吸附等温线的要求,溶液吸附必须在等温条件下进行,使盛有样品的三角瓶置于恒温器中振荡,使之达到平衡。本实验是在空气浴中将盛有样品的三角瓶置于振荡器上振荡。实验过程中温度会有变化,这样会影响测定结果。
2.由于实验酸碱滴定过程中,滴定的体积存在一定的偏差,所以导致实验结果1和3瓶所测得结果存在偏差,故在酸碱滴定中需要操作规范,使实验结果更精准.
六、注意事项
1.制备电极时,防止将正负极接错,并严格控制电镀电流。
2.甘汞电极使用时请将电极帽取下,用完后用氯化钾溶液浸泡。
七、思考题
1.电位差计、标准电池各有什么作用?如何保护及正确使用?
2.参比电极应具备什么条件?它有什么功用?
3.若电池的极性接反了有什么后果?
附录 SDC-Ⅲ数字电位差计
一、SDC-Ⅲ数字电位差计的特点
一体设计:将UJ系列电位差计、光电检流计、标准电池等集成一体,体积小,重量轻,便于携带。
数字显示:电位差值七位显示,数值直观清晰、准确可靠。
内外基准:即可使用内部基准进行测量,又可外接标准作基准进行测量,使用方便灵活。
误差较小:保留电位差计测量功能,真实体现电位差计对检测误差微小的优势。
性能可靠:电路采用对称漂移抵消原理,克服了元器件的温漂和时漂,提高测量的准确度。
二、使用条件
电源:~220V±10%;50Hz
环境:温度-10℃~40℃;湿度≤85%
三、使用方法
1.开机
用电源线将仪表后面板的电源插座与~220V电源连接,打开电源开关(ON),预热15分钟。
2.以内标或外标为基准进行测量
(1)将被测电动势按“+、-”极性与测量端子对应连接好。
(2)采用“内标”校验时,将“测量选择”至于“内标”位置,将100位旋置于1,其余旋钮和补偿旋钮逆时针旋到底,此时“电位指标”显示为“1.00000V”,待检零指示数值稳定后,按下“采零”键,此时,检零指示应显示“0000”。
(3)采用“外标”校验时,将外标电池的“+、-”极性按极性与“外标”端子接好,将“测量选择”置于“外标”,调节“100~10-4”和补偿电位器,使“电位指示”数值与外标电池数值相同,待“检零指示”数值稳定之后,按下“采零”键,此时“检零指示”为“0000”。
(4)仪器用“内标”或“外标”,校验完毕后将被测电动势按“+、-”极性与“测量”端子接好,将“测量选择”置于“测量”,将“补偿”电位器逆时针旋到底,调节“100~10-4”五个旋钮,使“检零指示”为“-”,且绝对值最小时,再调节补偿电位器,使“检零指示”为“0000”,此时,“电位指示”数值即为被测电动势的大小。
3.关机:首先关闭电源开关(OFF),然后拔下电源线。
四、注意事项
1.置于通风、干燥、无腐蚀性气体的场合。
2.不宜放置在高温环境,避免靠近发热源如电暖气或炉子等。
3.为了保证仪表工作正常,请勿打开机盖进行检修,更不允许调整和更换元件,否则将无法保证仪表测量的准确度。
4.若波段开关旋纽松动或旋纽指示错位,可打开旋纽盖,用备用呆扳手对准槽口拧紧即可。
-
物理化学实验报告-电池电动势的测定及其应用
电池电动势的测定及其应用摘要在本实验中我们利用对消法测量电池电动势并计算相关热力学常数首先我们通过测量电池AgsAgClsKClm…
-
电动势的测定及其应用实验报告思考题
电动势的测定及其应用实验报告思考题1电位差计标准电池检流计及工作电池各有什么作用如何保护及正确使用答电位差计对消法补偿法测定电池电…
-
大学物理化学实验报告-原电池电动势的测定
物理化学实验报告院系化学化工学院班级学号姓名实验名称原电池电动势的测定日期同组者姓名史黄亮室温1684气压1017kPa成绩一目的…
-
物化实验报告7-电动势的测定及应用
一实验目的1通过实验加深对可逆电池可逆电极盐桥等概念的理解2掌握对消法测定电池电动势的原理及电位差计的使用方法3通过电池AgAgN…
-
原电池电动势的测定及其应用实验报告
原电池电动势的测定及其应用实验报告林传信高分子1011017051012一实验目的1理解电极电极电势电池电动势可逆电池电动势的意义…
-
物化实验报告7-电动势的测定及应用
一实验目的1通过实验加深对可逆电池可逆电极盐桥等概念的理解2掌握对消法测定电池电动势的原理及电位差计的使用方法3通过电池AgAgN…
-
大学物理化学实验报告-原电池电动势的测定
物理化学实验报告院系化学化工学院班级学号姓名实验名称原电池电动势的测定日期同组者姓名史黄亮室温1684气压1017kPa成绩一目的…
-
物理化学实验报告-电池电动势的测定及其应用
电池电动势的测定及其应用摘要在本实验中我们利用对消法测量电池电动势并计算相关热力学常数首先我们通过测量电池AgsAgClsKClm…
- 电池电动势及温度系数的测定-实验报告(四川理工学院)
-
原电池电动势的测定及其应用
电动势的测定及其应用姓名学号学院班级一实验目的1掌握对消法测定电池电动势的原理及电位差计的使用2学会银电极银氯化银电极的制备和盐桥…
-
原电池电动势的测定实验报告 浙江大学
实验报告课程名称:大学化学实验p实验类型:中级化学实验实验项目名称:原电池电动势的测定同组学生姓名:无指导老师##一、实验目的和要…