实验二讨论报告
醋酸电离常数的测定——酸碱滴定讨论报告
完成日期:20##年10月3日
作者:刘春宏 徐璐颖 吴亦歌 刘薇 戴安婧 刘树青
生命科学学院
指导老师:王睿博
一、摘要
本文主要围绕在酸碱滴定实验中可能产生的误差进行讨论和罗列,并对5号实验室于20##年9月24日上午酸碱滴定实验产生的数据进行分析归纳,探索实际实验数据与真实值产生偏差的原因。
二、前言
讨论背景:实验二(Ⅰ)醋酸电离常数测定——酸碱滴定 实际操作中发现各组数据与助教给出的真实值之间存在或多或少的误差
讨论意义:明确滴定实验中各步骤可能产生的误差,增强同学们在化学实验中严谨的意识;认真分析实验数据,寻求合理的解释和偏差的原因,培养同学们对待实验数据的认真求实态度
三、内容
(一)、误差讨论
在酸碱滴定实验中,以下操作中容易引入误差(在此展开讨论的均系由操作不当引起的系统误差。而读数偏差、终点颜色辨别等偶然误差因人而异,分析较为困难,且能通过平行实验尽量克服,故在此略去):
I移液管使用部分
1.移液管定容中因仰视俯视而造成误差。若定容时仰视,则导致所取溶液体积偏大,标定氢氧化钠时会使测得氢氧化钠浓度偏低,滴定醋酸时会使测得的醋酸溶液浓度偏高;若定容时俯视,则导致所取溶液体积偏小,标定氢氧化钠时会使测得的氢氧化钠浓度偏高,滴定醋酸时会使测得的醋酸溶液浓度偏低。
2.移液管定容后未用滤纸擦干管颈下端外壁的溶液,可能导致所取溶液体积偏大。标定氢氧化钠时会使测得的氢氧化钠浓度偏低,滴定醋酸时会使测得的醋酸溶液浓度偏高。
3.移液管在移动过程中有溶液漏出或放液时待液体不再流出后未等待15秒,两种情况均会导致所取溶液体积偏小,标定氢氧化钠时会使测得的氢氧化钠浓度偏高,滴定醋酸时会使测得的醋酸溶液浓度偏低
Ⅱ滴定管使用部分
4.滴定管调零后未将滴定管下口尖嘴靠一下小烧杯的内壁,即滴定管尖嘴外残留有滴定液,则导致滴定液的读数偏小,标定氢氧化钠时会使测得的氢氧化钠浓度偏高,滴定醋酸时会使测得的醋酸溶液浓度偏低。
5.滴定后读数因仰视俯视或滴定管中有气泡引起的误差。因具体情况较复杂,在这里总结为读数大于实际放液体积和读数小于实际放液体积两种情况。若读数大于实际放液体积,标定氢氧化钠时会使测得的氢氧化钠浓度偏低,滴定醋酸时会使测得的醋酸溶液浓度偏高;若读数小于实际放液体积,标定氢氧化钠时会使测得的氢氧化钠浓度偏高,滴定醋酸时会使测得的醋酸溶液浓度偏低。
Ⅲ滴定终点部分
6.判断滴定终点时放液过快,滴定结束时已超过终点。则所用的滴定溶液偏多,标定氢氧化钠时会使测得的氢氧化钠浓度偏低,滴定醋酸时会使测得的醋酸溶液浓度偏高。
7.滴定过程中震荡过于激烈,使空气中二氧化碳溶于溶液中,导致所用的滴定溶液偏多,标定氢氧化钠时会使测得的氢氧化钠浓度偏低,滴定醋酸时会使测得的醋酸溶液浓度偏高。
8.半滴法滴定时没有用去离子水冲洗锥形瓶内壁,即锥形瓶内壁上残留溶液,导致所用的滴定溶液偏多,标定氢氧化钠时会使测得的氢氧化钠浓度偏低,滴定醋酸时会使测得的醋酸溶液浓度偏高。
Ⅳ连带误差
9.滴定所得醋酸溶液浓度受标定出的氢氧化钠浓度影响。若不考虑实验中的其他误差,若标定的氢氧化钠浓度偏高,则醋酸溶液浓度偏高;标定的氢氧化钠浓度偏低,则醋酸溶液浓度偏低。
(二)、数据分析
1.标定氢氧化钠浓度的实验中,本实验室所得的十组数据中,只有一组偏小,一组为真实值,其余八组均较真实值偏大,最大相对误差为1.04%,实验数据精确度及准确度均较高。导致实验数据较真实值偏大的原因可能是操作误差,如移液管定容时俯视或移液管移动过程中有溶液漏出等(详见误差分析)。
2.滴定醋酸溶液浓度的实验中,本实验室所得的十组数据中,七组数据偏大,三组数据偏低,最大相对误差为1.46%,精确度较滴定氢氧化钠浓度的实验低,主要的原因是滴定的氢氧化钠浓度误差会影响该实验测得的数据,使误差增大,同时操作误差也有影响。
四、结论
本次滴定实验测得的数据均不可避免地存在误差,主要是操作误差,导致氢氧化钠溶液浓度测定值普遍较真实值偏高,醋酸溶液浓度测定时大部分较真实值偏高。本次实验所得数据精确度及准确度均较高。
五、参考文献和原始数据
1.《20##年“普通化学实验B”讲义》24—34页 实验二(I):醋酸电离常数的测定。
2.原始数据(第五实验室)
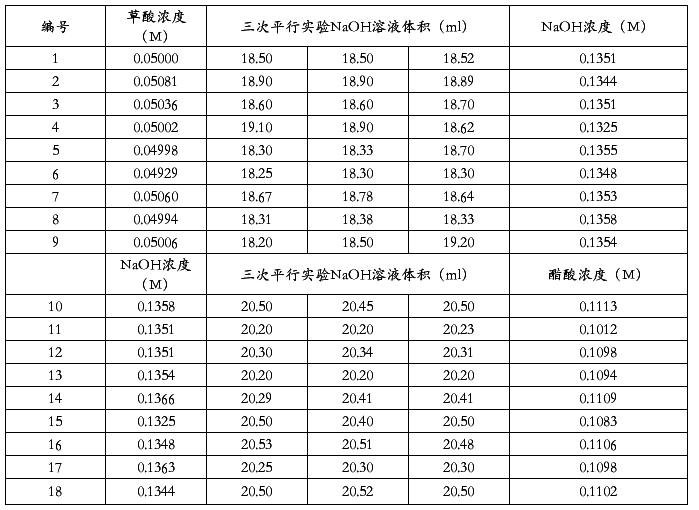
NaOH溶液标准浓度:0.1344mol/L HAc溶液标准浓度:0.1097mol/L
六、小组分工表
第二篇:实验十一讨论报告
结合Fe3+配合物的颜色变化讨论配合物溶液具有丰富的颜色变化的原因。
完成日期:20##年12月9日
刘树青 戴安婧 刘春宏 刘薇 吴亦歌 徐璐颖
生命科学学院
指导教师:王睿博
一、摘要
本文主要分析配合物溶液具有丰富颜色的原因,讨论配位场理论和分裂能的定义,产生分裂能的因素,并进一步讨论影响分裂能的一些因素。
二、前言
讨论背景: d区元素化合物呈多姿多彩的颜色,被氧化态,酸度,配体,异构体的不同所影响。他们之所以呈现五颜六色,d-d跃迁吸收能量恰好在可见光区是其内在原因之一。
讨论意义:加深对配合物的了解,了解配位场理论和分裂能的原理。
三、内容
配合物溶液具有丰富的颜色变化的原因
物质之所以呈现不同的颜色,是因为它对可见光(波长为400~750 nm的混合光)的吸收、透射、反射情况的不同。当可见光照射在物质上,全部被吸收则物质呈黑色;若吸收可见光中某些波条的光,同时散射其余波长的光,则物质呈现出散射光的颜色;若完全不吸收可见光,则物质为无色。
一般说来,吸收光的波长愈短,呈现的颜色愈浅;吸收光的波长愈长,呈现的颜色愈深。物质吸收可见光并呈现一定的颜色,是由于构成物质的分子、原子和离子中电子的跃迁。即电子从基态跃迁到激发态时所吸收的能量正处于可见光能量范围19.9×10-20 ~ 59.6×10-20J(波数为10000~30000 cm-1),它们就能够选择性地吸收可见光中的某种色光而呈现出一定的颜色。
1.配位场理论与分裂能
配位场理论是在晶体场理论的基础上与分子轨道理论相结合而发展起来的一种理论。它涉及d轨道及过渡金属化合物的化学键理论。配位场理论在结构化学中占有很重要的地位,是研究配合物颜色的理论依据。
过渡金属配合物常有一定的颜色。其原因是过渡金属离子常具有未充满的d轨道,它们在配位场的作用下,发生能级分裂。在八面体场中,中心离子d轨道分裂成两组。即能量较高的dx²和dx²-y² (称为eg轨道)、能量较低的 dxy, dyz, dxz(称为t2g轨道)。这两组轨道的能量差用△0表示,移为分裂能。
d轨道中的电子吸收可见光中某些具有一定波长的光,电子就从能量低的场轨道跃迁到能量较高的eg轨道(称d-d跃迁),被吸收的光的颜色就决定了△0值的大小(见表1)。
根据光子的能量与频率的关系
E 
则有 △0 
由于 λ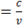 可有
可有 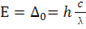
上式中。h为普朗克常数、c为光速、λ为光的波长。可以看出,分裂能△0值愈大,波长愈短,颜色也呈规律性的变化。见表1。
表1 物质颜色与分裂能、吸收光波长的关系
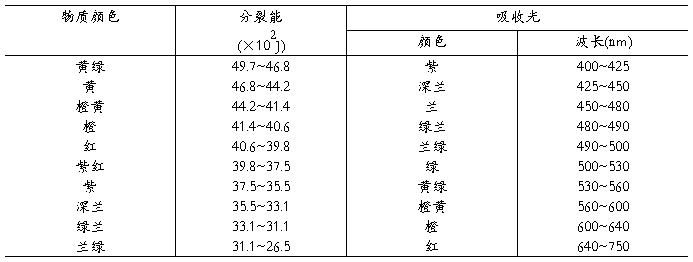
2决定分裂能大小的有关因素
2.1配位体对分裂能的影响
中心离子与配位体之间除有静电作用外,还有一定程度的共价结合,这也影响了配位休的场强。
配位体对中心离子的d电子的影响是很大的,它不仅影响d电子云的分布,也影响到d轨道能量的变化。
同一中心离子,根据配位体不同所引起的分裂程度强弱,可排成光潜光学顺序:
CN- > en > NH3 > NcS- > H20 > OH- > F- > Cl- > Br- > I-
2.2中心离子对分裂能的影响
(1)中心离子半径对分裂能有一定影响。一般说来,对一定配位体,相同价数的同族元素的金属离子组成配离子时,随过渡系的不同其分裂能△0值也不同。
一般认为,第二过渡系比第一过渡系△。值增大约40~50%,第三过渡系比第二过渡系增大20~25%。如Co3+、 Rh3+、Ir3+的乙二胺配合物,其分裂能△0值分别为46.3×10-20J、68.3×10-20J、81.83×10-20J。
中心离子的半径若大,d轨道离核则远,愈易受配位体场的影响,分裂能则增大,相应的吸收光的波长则短。
因此,当不同的中心离子与同一配位体形成配合物时,所呈现的颜色是不同的,见表3。
(2)中心离子的电荷数对分裂能也有一定的影响。
配位体相同时,同种元素中心离子的电荷数愈高,分裂能也愈大。
因为中心离子的电荷愈高,对配位体的吸引愈强,中心离子与配位体愈接近,其d轨道受配位体场的排斥作用愈强,故分裂能e。
值也愈大,相应的吸收光的波长则愈短,见表3。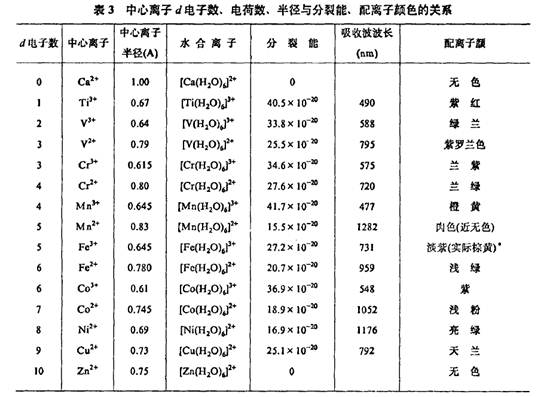
[Fe(H2O)6]3+离子的颜色:当pH=O时,溶液呈浅绿紫色。
当pH>2~3时,因水解程度增大,产生新的物质[Fe(OH)x(H2O)6-x]3-x,呈黄色。
若继续增大pH位则水解程度增大,颜色会变成棕黄色或棕红,还可能析出红棕色胶状Fe(OH)3沉淀。
由表3可见,中心离子半径和电荷数对分裂能的影响是比较明显的,而分裂能的大小直接关系到配合物的颜色。
在表3中,价数相同的同一过渡系元素的离子半径似应随核电荷的增加而减小,但实际上是随d电子数目的增多不是依次减小,而是出现“不规则”现象。
如第一过渡系M2+离子的半径变化较复杂。
这是由于正八面体配合物中中心离子的d电子有t2g和eg之别。
t2g电子云插在配位体之间,使中心离子半径减小。因此,t2g轨道中电子数目愈多,中心离子一半径则愈小。
但eg电子云与配位体的电子云相接触,eg电子的增加要把配位体推开一些,从而引起离子半径增大。
因此,eg电子数愈多,中心离子半径则愈大。
从Ti3+到V3+场电子增多,半径则减小。
从V2+到Mn2+, eg电子增多,离子半径增大。
从Mn2+到Ni2+,又因场电子增多其半径减小。
到Cu2+、Zn2+,又因eg电子增多,半径逐渐增大。
配合物中由于d-d跃迁产生分裂能。
分裂能的大小与配合物的颜色有密切关系。
但是,配合物的颜色有的时候不仅仅决定于d-d跃迁产生的分裂能。
当配合物中存在荷移跃迁时,也能影响其颜色。
配合物的荷移跃迁又称为电荷转移,也是电子跃迁的一种形式。
某些配合物的光谱呈现两种吸收带:高强度紫外线的吸收带(电荷转移的结果)。
可见光区域的低强度吸收带(d-d跃迁的结果)和由金属离子与阴离子配位体形成的配合物,往往可吸收可见(或紫外)区的某一部分波长的光,而发生电荷转移。
荷移跃迁可以是电子从配位体的某一轨道跃迁到中心离子的某一轨道,也可以是电子从中心离子的某一轨道跃迁到配位体的某一轨道。
荷移跃迁吸收波波长范围,决定于中心离子与配位体相应电子轨道的能量差。
[Fe(CNS)6]3-离子,电子从配位体跃迁到中心离子,因近紫外区的强电荷转移峰扩展进人了可见光谱区,而将弱的d-d跌迁掩盖,使该配合物的颜色呈现血红色。
另外,配位体内部的电子跃迁也可引起配合物颜色的变化。
四、结论
总之,就八面体配合物而言,d轨道的分裂能是决定其颜色的主要原因。
金属离子是否有d电子和是否存在d空轨道,是产生d-d跃迁的先决条件。
如t2g轨道中无电子(d0)或eg轨道无空缺(d0),这样也就不存在d-d跃迁,因此其配合物通常是不呈现颜色的。
像Ca2+, Zn2+, Cu+, Ga3+等离子,它们的水合物均无色。
当d轨道分裂能△0值与可见光区的能量相当,因而它们的d-d跃迁能吸收某些可见光,而呈现与之互补的颜色。
第五、第六周期中具有d1-d9电子结构的离子与水(H20)等配合时,在外界能量作用下虽然也发生d-d跃迁,但由于原子序数的增加,分裂能△0值的增高,d-d跃迁需吸收的能量也很大,一般相当于紫外光区电磁辐射的能量。
所以即使发生了d-d跃迁,我们肉眼看去还是无色的。分裂能愈大,d-d跃迁愈困难。
分裂能的大小也受配离子空间构型的制约。
由于中心离子d轨道在不同方向所受斥力不同,所以分裂能值也有区别。
相对次序为:△。平面正方形>△。直线型>△。正八面体>△。正四面体。
对于同一类型的配合物,分裂能的大小主要与配位体场的强弱有关,还与中心离子的电荷、半径及d电子数有关。
π键的形成对分裂能也有一定的影响。配合物中如果还存在其它类型的跃迁,也会影响配合物的颜色
五、参考文献
过渡金属元素八面体配合物的颜色与分裂能关系的探讨,沈和娟,湖北汽车工业学院学报,82-87,1989。
六、小组分工表

-
实验报告 范本
研究生实验报告范本实验课程实验名称实验地点学生姓名学号指导教师范本实验时间年月日一实验目的熟悉电阻型气体传感器结构及工作原理进行基…
-
实验报告范本
学生实验报告书实验课程名称开课学院指导教师姓名学生姓名学生专业班级200200学年第学期实验教学管理基本规范实验是培养学生动手能力…
-
实验报告要求及范文
滁州市政府组织退耕还林(黑体,小二,1.5倍行距,段前段后0.5行)——5060451007范雪花(学号,TimesNewRoma…
-
有关实验报告的书写格式
有关实验报告的书写格式江苏省泗阳县李口中学沈正中一、完整实验报告的书写完整的一份实验报告一般包括以下项目:实验名称:实验目的:实验…
-
实验报告范本
学生实验报告书实验课程名称开课学院指导教师姓名学生姓名学生专业班级200200学年第学期实验教学管理基本规范实验是培养学生动手能力…
-
小组讨论实验报告
小组讨论实验报告讨论主题:如何提高课堂质量?主持人:1名分组:(1)男五名(2)女五名环节一:主持人点明本次讨论的主要目的环节二:…
-
PCR扩增实验
1、PCR扩增试验原理:利用特异的引物,以重组质粒pGEX-4T-1〔His〕6-C-X为模板扩增X基因。n扩增反应1〕扩增引物2…
-
实验一讨论报告
实验一固体称量和溶液的配置讨论题一讨论报告完成日期20xx年9月23日作者张雪阳朱时雨邢继尧黄宇童葛欣宜医学部基础医学院指导教师杨…
-
##借鉴内容怎么写的实验报告
交通与汽车工程学院实验报告课程名称程序设计基础课程代码学院直属系交通与汽车工程学院年级专业班20xx汽车服务2班学生姓名张凤学号实…
-
实验九 讨论报告
实验九讨论题2讨论报告完成日期20xx年11月25日作者郭沫凡姚珊珊柳京伯钟无限冯宇轩后四位排名不分先后医学部公共卫生学院一摘要本…