实验 甲酸铜的制备
甲酸铜的制备及其组成的测定
2011级化院环境科学二班——张雷
学号---20116113
前言
①用废铜屑制备甲酸铜可以节省精铜的用量,环保,而且还可以废物利用
②由废铜屑制得五水硫酸铜有很多的方法,都不近相同,但也都有本质的区别,可以将废铜屑→硝酸铜→硫酸铜。但在转化成硝酸铜时会产生污染性气体,会对环境产生危害。再比如废铜屑→氧化铜→硫酸铜,在转化成氧化铜时就相当困难,铜的性质相当稳定,普通的酒精灯几乎是很难办到的。而废铜屑用硫酸和过氧化氢却可以实施。但其唯一的缺点是反应速度过慢。
③在测定其组成成份的时候,可以用吸光光度法,也可以用EDTA准确测定铜盐中铜的含量。而第二种方法所需试剂颇多,而且方法繁冗,实施起开较为困难。但是第一种方法是前几次实验课做过的,所需数据也有所记录,所以本实验用的是吸光光度法进行分析实验。
实验药品的配制
(1)KMnO4溶液的配制:准确称取0.9 g的KMnO4,置于500 mL烧杯中,加入200 mL蒸馏水,加热至沸,使其溶解,冷却后,稀释至300 mL摇匀,在暗处放置6到7天,用玻璃砂芯漏斗过滤,除去MnO2沉淀,储存在棕色试剂瓶中,摇匀后即可标定使用。
(2)Na2S2O3溶液的配制:称取12.5 g的Na2S2O3;5H2O于烧杯中,加入100mL250 mL的蒸馏水将其溶解,加入0.05 g的碳酸钠,再稀释至500mL,储存在暗处3到5天后标定。
(3)淀粉溶液:称取0.5 g可溶性淀粉用少量水搅拌溶解,加入100mL沸水,煮沸2到3 min
(4)用溶质质量分数为98%的浓硫酸(密度为1.84g/cm3),配制50mL 20%的稀硫酸(密度为1.14g/cm3),应先在烧杯中倒入水45.4 mL,再将6.3 mL 98%的浓H2SO4慢慢注入水中,并不断搅拌。
实验方案
一、甲酸铜的制备
(1)、五水硫酸铜的制备
称取5g废铜屑、50 mL 20% H2SO4溶液和30%H2O2,溶解于100mL烧杯中,待反应完全后减压过滤,抽滤,至干,称重。
(2)、碱式碳酸铜的制备
称取CuSO4·5H2O和NaHCO3比例为12.5:9.5于研钵中,磨细和混合均匀。在快速搅拌下将混合物分多次小量缓慢加入到100mL近沸的蒸馏水(此时停止加热)。混合物加完后,再加热至沸数分钟。静置澄清后,用倾析法洗涤沉淀。抽滤,用水淋洗至溶液无SO42-,称重。得到蓝绿色晶体(所得产物为碱式碳酸铜)。
(3)、甲酸铜的制备
将前面所制得的产品放入烧杯内,加入约20mL蒸馏水,加热搅拌至323K左右,逐滴加入适量甲酸至沉淀完全溶解(所需甲酸量自行计算),趁热过滤。滤液在通风橱下蒸发至原体积的1/3左右。冷至室温,减压过滤,用少量乙醇洗涤晶体2次左右,抽滤,至干,得Cu(HCOO)2·4H2O产品,称重,计算产率。
二、甲酸铜中铜的测定
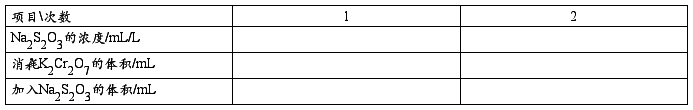
(1)Na2S2O3溶液的标定
用指定称量法称取1.2258 g K2Cr2O7于小烧杯中,加水溶解定量转移至250 mL容量瓶中加水稀释至刻度线,摇匀。准确移取25.00 mL标准溶液于锥形瓶中,加入5 mL 6 mol/L HCl溶液,5 mL 200g/L KI溶液摇匀放在阴暗处5分钟,待反应完全后,加入100 mL蒸馏水,用待标定的Na2S2O3滴定至淡黄色,然后加入3 mL 5 g/L 淀粉指示剂,继续滴定至呈现亮绿色为终点。计算Na2S2O3的东渡浓度。
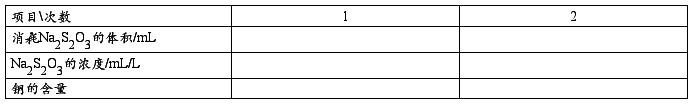
(2)铜盐中铜含量的测定
准确称取甲酸铜0.6 g 溶解于小烧杯中,定量转移至250 mL容量瓶中,取25.00mL于锥形瓶中,8 mL(1:1) 醋酸溶液,加入1 g NH4HF2加入10 mL KI 溶液,用Na2S2O3滴定至浅黄色,再加入3 mL 5 g/L 淀粉至浅蓝色,再加入10mL KSCN(100 g/L),滴定至蓝色消失,计算铜的含量。
三、甲酸铜中加酸根的测定
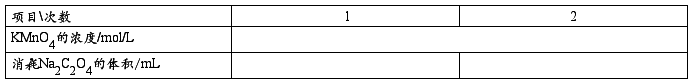
(1)KMnO4-溶液的标定
准确称取Na2C2O4(0.15-0.18g),分别放于250mL锥形瓶中,加入50mL蒸馏水,溶解后,加入15mL 的稀硫酸,从滴定管中放出10.00mL KMnO4,水浴加热80度左右至红色退去,再用KMnO4滴定至微红色30s内不褪色,计算其浓度。

(2)甲酸根含量的测定
用移液管移取25.00 mL的甲酸铜标准溶液和0.2 g无水碳酸钠,50.00 mL KMnO4溶液用水浴加热至80度左右至颜色变浅为止,加入10 mL 4 mol/L硫酸,2.0 g碘化钾,在暗处放置5 min,再加淀粉指示剂,用Na2S2O3标准溶液滴定。趁热用Na2C2O4滴定至刚好蓝色消失。
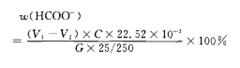
 1
1
数据处理与讨论
1、
 。其余全部出自教材。
。其余全部出自教材。
第二篇:实验 甲酸铜的制备
实验 甲酸铜的制备
一、碱式碳酸铜的制备
称取12.5gCuSO4·5H2O和9.5gNaHCO3于研钵中,磨细和混合均匀。在快速搅拌下将混合物分多次小量缓慢加入到100mL近沸的蒸馏水(此时停止加热)。混合物加完后,再加热近沸数分钟。静置澄清后,用倾析法洗涤沉淀至溶液无SO42-。抽滤至干,称重。
二、甲酸铜的制备
将前面制得的产品放入烧杯内,加入约20mL蒸馏水,加热搅拌至323K左右,逐滴加入适量甲酸至沉淀完全溶解(所需甲酸量自行计算),趁热过滤。滤液在通风橱下蒸发至原体积的1/3左右。冷至室温,减压过滤,用少量乙醇洗涤晶体2次,抽滤至干,得Cu(HCOO)2·4H2O产品,称重,计算产率。
实验 甲酸铜的制备
一、碱式碳酸铜的制备
称取12.5gCuSO4·5H2O和9.5gNaHCO3于研钵中,磨细和混合均匀。在快速搅拌下将混合物分多次小量缓慢加入到100mL近沸的蒸馏水(此时停止加热)。混合物加完后,再加热近沸数分钟。静置澄清后,用倾析法洗涤沉淀至溶液无SO42-。抽滤至干,称重。
二、甲酸铜的制备
将前面制得的产品放入烧杯内,加入约20mL蒸馏水,加热搅拌至323K左右,逐滴加入适量甲酸至沉淀完全溶解(所需甲酸量自行计算),趁热过滤。滤液在通风橱下蒸发至原体积的1/3左右。冷至室温,减压过滤,用少量乙醇洗涤晶体2次,抽滤至干,得Cu(HCOO)2·4H2O产品,称重,计算产率。
-
实验 甲酸铜的制备
甲酸铜的制备及其组成的测定20xx级化院环境科学二班张雷学号20xx6113前言用废铜屑制备甲酸铜可以节省精铜的用量环保而且还可以…
-
由废铜屑制备甲酸铜及组成测定实验报告
综合设计实验由废铜屑制备甲酸铜及其组成测定实验目的综合设计实验是锻炼学生综合运用所学基础知识和基本技能进行科学研究工作的重要途径通…
-
阿司匹林铜制备实验报告.doc
氢氧化钠对阿司匹林铜制备的影响一实验目的1了解阿司匹林铜的一般特性2掌握水浴加热结晶减压过滤和晶体洗涤等基本操作3掌握碘量法测定铜…
-
阿司匹林铜制备实验报告2
20xx20xx学年秋冬学期探究性实验大学化学实验G影响学号131401005212姓名1王嫱2学号34姓名34学号姓名5指导教师…
-
制取硫酸铜晶体实验报告
制取硫酸铜晶体实验报告一实验准备实验仪器药品材料棉线丝线200ML烧杯两个硬纸片一张滤纸若干酒精灯一个石棉网带铁圈的铁架台温度计硫…
-
有机化学实验报告 苯甲酸的重结晶
苯甲酸的重结晶一、实验目的:1、了解重结晶原理,初步学会用重结晶方法提纯固体有机化合物;2、掌握热过滤和抽滤操作。二、基本原理:1…
-
苯甲酸的红外光谱实验报告
班级食品质安1202班姓名季瑶学号3120xx6040dingqingzhi苯甲酸的红外吸收光谱图的测定一实验目的1掌握红外光谱分…
-
苯甲酸乙酯的制备实验报告
苯甲酸乙酯的制备班级姓名学号摘要苯甲酸乙酯C9H10O2为无色透明液体其能与乙醇乙醚环己烷混溶不溶于水用于配制香水香精和人造精油等…
-
苯甲酸乙酯的制备实验报告
苯甲酸乙酯的制备高分子11309苯甲酸乙酯C9H10O2稍有水果气味用于配制香水香精和人造精油也大量用于食品中也可用作有机合成中间…
-
苯甲酸乙酯的合成_实验报告
有机化学实验报告20##年11月8日第一部分:实验预习部分一、实验目的(要求)1.学习苯甲酸乙酯的制备原理及操作方法。2.了解共沸…