002苯甲酸摩尔质量测定实验的实验报告
湖南省首届大学生化学实验竞赛
实 验 报 告
选手姓名: 选手编号:
实验A1-2 苯甲酸摩尔质量的测定
注:实验过程中,用黑色钢笔或圆珠笔在实验报告指定的位置,记录试题要求或者你认为应该记录的原始数据、实验现象、数据处理过程及结果。写在其他地方无效。勿将任何内容写在答卷背面。伪造数据者,以零分计。
一、实验原理(5分)
二、实验步骤(8分)

实验A1-2 实验报告 页码:1/3
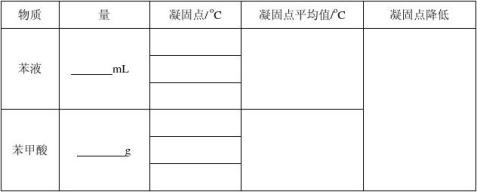
三、实验数据(10分)
室温
原始数据记录
四、数据处理(12分)
计算苯甲酸摩尔质量和缔合度。(苯甲酸摩尔质量的理论值为122.1232g/mol)
实验A1-2 实验报告 页码:2/3
开始实验时间: 完成实验时间: 监考教师签字: 日 期: 年 月 日
实验A1-2 实验报告 页码:3/3
第二篇:凝固点降低法测定摩尔质量。实验报告
华南师范大学实验报告
学生姓名 吴俊烽 学 号 20112401019
专 业 化学教育 年级班级 11化四
课程名称 物理化学实验 实验项目 凝固点降低法测定摩尔质量
指导老师 肖信 时 间 2013年11月26日
【实验目的】
1.用凝固点降低法测定尿素的摩尔质量;
2.掌握固点降低法测摩尔质量的原理;
3. 理解、绘制冷却曲线,并通过冷却曲线校正凝固点。
【实验原理】
假设溶质在溶液中不发生缔合和分解,也不与固态纯溶剂生成固溶体,则由热力学理论出发,可以导出理想稀薄溶液的凝固点降低值?Tf(即纯溶剂和溶液的凝固点之差)与溶质质量摩尔浓度bB之间的关系:
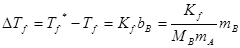 (1)
(1)
由此可导出计算溶质摩尔质量MB的公式: (2)
(2)
以上各式中: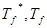 分别为纯溶剂、溶液的凝固点,单位K;mA、mB分别为溶剂、溶质的质量,单位kg;Kf为溶剂的凝固点降低常数,与溶剂性质有关,单位K·kg·mol-1;若已知溶剂的Kf值,通过实验测得?Tf,便可用式(2)求得MB。也可由式(1)通过?Tf-mB的关系,线性回归以斜率求得MB。
分别为纯溶剂、溶液的凝固点,单位K;mA、mB分别为溶剂、溶质的质量,单位kg;Kf为溶剂的凝固点降低常数,与溶剂性质有关,单位K·kg·mol-1;若已知溶剂的Kf值,通过实验测得?Tf,便可用式(2)求得MB。也可由式(1)通过?Tf-mB的关系,线性回归以斜率求得MB。
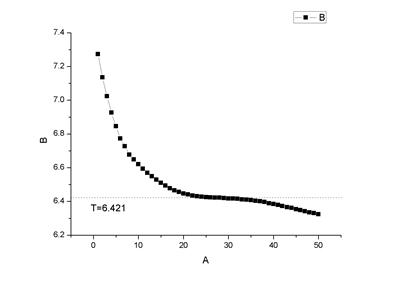
通常测定凝固点的方法是将溶液逐渐冷却,使其结晶。但是,实际上溶液冷却到凝固点,往往并不析出晶体,这是因为新相形成需要一定的能量,故结晶并不析出,这就是所谓过冷现象。然后由于搅拌或加入晶种促使溶剂结晶,由结晶放出的凝固热,使体系温度回升。从相律看,溶剂与溶液的冷却曲线形状不同。对纯溶剂,固-液两相共存时,自由度f=1-2+1=0,冷却曲线出现水平线段,其形状如图1(1)所示。对溶液,固-液两相共存时,自由度f=2-2+1=1,温度仍可下降,但由于溶剂凝固时放出凝固热,使温度回升,回升到最高点又开始下降,所以冷却曲线不出现水平线段此时应按图1(3)所示方法加以校正。

(1)理想状态下的溶剂 (2)有过冷的溶剂 (3)有过冷的溶液
【仪器和试剂】
凝固点测定仪,精密电子温差测量仪,电子天平,移液管(50mL),环己烷,萘
【操作步骤】
1. 打开测温仪,调节寒剂温度低于溶液凝固点2-3℃(约4.5-3.5℃),然后将空气套管插入槽中。
2. 准确量取25ml环己烷加入凝固点测试试管中,塞紧橡胶塞,插入传感器
3. 将凝固点试管插入寒剂槽中,观察温度和温差,待温度在10℃以下且温差为正值时按下锁定键,温度稳定时,此温度即为环己烷的凝固点
4. 取出凝固点测定试管,使环己烷熔化(最好留有少量晶种),再次插入寒剂中,搅拌。当温度降低到高于初测凝固点的0.5℃,把试管移到空气管中,每10秒记录一次温度
5. 重复第4部2次
6. 称取约0.23g的萘加入凝固点测定试管中,完全溶解后,重复3、4部
【数据的记录和处理】
1.由水的密度,计算所取水的重量WA。
2.将饰演数据填入表中。
3.计算分子量,并计算域理论值的相对误差。
环己烷 1
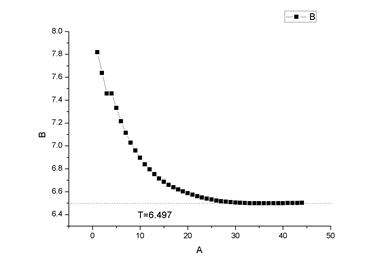
环己烷 2

环己烷 3
================================================================================
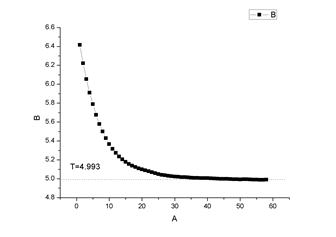
环己烷+萘 1
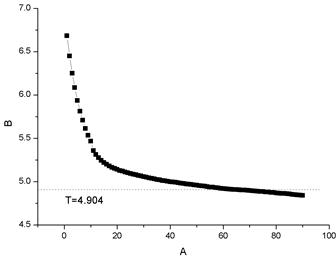
环己烷+萘 2
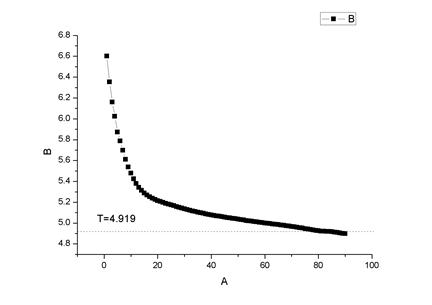
环己烷+萘 3

得萘的相对分子质量为 144.63
文献值为 128.18
相对误差=12.83%
【结果讨论】
1. 从温度变化曲线可以看到,没有出现较明显的“平台”,可能是
A、 寒剂的温度太低,导致溶液的温度下降得太快,溶液到达凝固点时稳定的时间太短,很快就继续降温。
B、 也可能是由于,环己烷和萘都含有较多的杂质。
?上述两点也可能是相对误差较大的原因
2. 从环己烷2和环己烷3的曲线可以看到,温度在到达凝固点后上升了,这是由于溶液凝固是放热过程,而它放热速度大于寒剂吸热的速度,因此导致温度上升。
【思考题】
1.根据什么原则考虑加入溶质的量?太多或太少影响如何?
答:根据稀溶液依数性, 溶质加入量要少;太多不符合稀溶液,太少凝固点下不明显。
2.什么叫凝固点?凝固点降低的公式在什么条件下才适用?它能否用于电解质溶液?
答:固体溶剂与溶液成平衡的温度称为溶液的凝固点。含非挥发性溶质的双组分稀溶液的凝固点低于纯溶剂的凝固点,当确定了溶剂的种类和数量后,溶剂凝固点的降低值仅取决与所含溶质分子的数目。对于理想溶液或浓度很稀的溶液,根据范特霍夫凝固点降低公式知道:在溶液浓度很稀时,如果溶质与溶剂不生成固溶体,溶液的凝固点降低值 与溶质的质量摩尔浓度 (mol·kg-1)成正比。一般只适用于强电解质稀溶液。其次凝固点不应太高或太低,应在常温下易达到。
【参考文献】
[1]何广平,南俊民,孙艳辉等.物理化学实验.化学工业出版社.2007.12
-
实验报告格式-有机酸摩尔质量的测定
实验报告格式:实验日期:实验地点:指导教师:实验名称:有机酸摩尔质量的测定一、实验目的:(1)掌握用基准物标定NaOH溶液浓度的方…
- 实验4 有机酸摩尔质量的测定
-
有机酸摩尔质量的测定
有机酸摩尔质量的测定的实验报告班级实验参与者1有机酸摩尔质量的测定一实验目的1掌握NaOH溶液的配制方法2掌握用邻苯二甲酸氢钾基准…
-
实验三 有机酸摩尔质量的测定
实验三有机酸摩尔质量的测定一实验目的与要求1掌握用基准物标定NaOH溶液浓度的方法2了解有机酸摩尔质量测定的原理和方法二实验原理绝…
-
有机酸摩尔质量的测定
有机酸摩尔质量的测定伍登磴一实验目的1学习有机酸摩尔质量的测定方法2熟悉微量滴定操作3了解基准物质KHP性质及应用二实验原理1大多…
-
物化实验报告_凝固点降低法测定摩尔质量
凝固点降低法测定摩尔质量丛乐20xx011007生51实验日期20xx年10月13日星期六提交报告日期20xx年10月27日星期六…
-
无机化学实验第四版置换法测定镁的摩尔质量实验报告
实验名称置换法测定镁的摩尔质量实验日期温度气压一实验目的1了解置换法测定镁的相对原子质量的原理和方法2掌握气态方程和分压定律的有关…
-
物化实验报告_凝固点降低法测定摩尔质量[1]
凝固点降低法测定摩尔质量11实验目的12用凝固点降低法测定萘的摩尔质量通过实验掌握溶液凝固点的测量技术并加深对稀溶液艺术性之的理解…
-
粘度法测定高聚物的相对摩尔质量实验报告
粘度法测定高聚物的相对摩尔质量一实验目的1掌握乌氏粘度计测量粘度的原理和方法2掌握粘度法测定聚乙烯分子量的原理过程和数据处理方法二…
-
凝固点降低法测定摩尔质量。实验报告
凝固点降低法测定摩尔质量一实验目的1用凝固点降低法测定尿素的摩尔质量2掌握固点降低法测摩尔质量的原理3理解绘制冷却曲线并通过冷却曲…
-
物理化学实验报告 - 凝固点降低法测定摩尔质量
C6凝固点降低法测定摩尔质量实验日期年月日姓名学号班级一实验目的一用凝固点降低法测定萘的摩尔质量二掌握精密电子温差仪的使用方法二原…