普化实验B论文实验十二铬、锰、铁、钴、镍
各种氧化态的锰之间的转化
一、摘要
针对锰的氧化态多样,颜色变化丰富的特点,我们讨论了多种氧化态锰之间的转化,并对影响转化的实验条件进行了具体分析,经过查阅文献资料,我们得出了锰的各种氧化态的性质和锰在各种氧化态之间转化的原理以及反应条件对其的影响。
二、前言
锰是一种多氧化态的金属元素,有二价,三价,四价,六价,七价五种常见氧化态。在生活中具有广泛应用,研究它各种氧化态之间的相互转化对工业生产具有重大意义,是推动我国冶金工业的关键。在上次的实验中,我们进行了锰二价、四价、六价和七价之间的相互转化和反应。发现对于同一个氧化态的锰在不同的条件下发生了不同的反应,于是我们针对这一现象进行了深入探讨。
三、内容
1、通过自由能来解释
在酸性溶液中

(1)图中最低点为Mn2+的点,表明相比于锰的其他氧化态,Mn2+是该条件下(pH=0)最稳定的热力学状态。事实也如此,在酸性介质中,若使Mn2+参与氧化还原反应,需极强氧化剂如S2O32-、PbO2、NaBiO3等与之作用才行。
(2)Mn3+点位置高于相邻点Mn(Ⅱ)、Mn(Ⅳ)点的连线,即处于“凸点”。是热力学不稳定状态,能发生歧化反应而转变成两个相邻质点。2Mn3++2H20=Mn2++MnO2+4H+由于发生歧化反应,使该点(Mn3+)的△G由所在点垂直下降到两个相邻质点的连线上,使两条连线斜率相等,电动势为零,反应达到平衡态。同理该条件,MnO42-也不稳定,歧化生成Mno2和MnO4-。
(3)Mn(Ⅳ)点的位置处在相邻质点连线下方,即处于“凹”点位置。说明它比相邻质点的共存体系稳定。反应向归中反应方向进行。如在Mn2+过量情况下:
2MnO4-+3Mn2++2H20=5MnO2+4H+
(4)从氧化态看,在酸性介质中,可以稳定存在的Mn3+、MnO2、MnO4-都有一定的氧化能力,以MnO4-点的位置最高,氧化性最强,在酸性介质中是强氧化剂。
在碱性溶液中
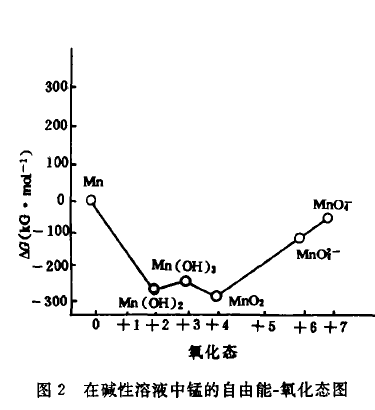
在pH=14时,MnO42-点位置处在MnO2、MnO4-连线上,因而三者可以共存,MnO42-在碱性介质中能够稳定存在;Mn(Ⅳ)点比Mn(II)点位置低,因而Mn(Ⅳ)比Mn(Ⅰ)稳定。
我们上次所做的实验也证明了此结论:
在碱性介质中,
Mn2++2OH-=Mn(oH)2↓(白色)
由于暴露在空气中,很快会发生转化:
2Mn(OH)2+02=2MnO2·H2O↓(棕色)
由此可见,介质不同,锰的各种氧化态的氧化还原行为不同,其自由能一氧化态图也不同。
2、不同反应条件对锰各种氧化态之间相互转化的影响
(1)NaOH的用量对K2MnO4生成的影响
实验现象如图
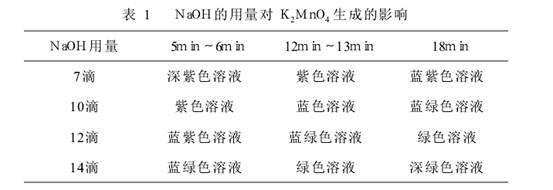
在一般碱性的溶液里,锰的+VII、+VI、+IV氧化态对应的离子能够以相当的浓度共存。当碱性增强时,反应向有利于MnO42-生成的方向移动,随着MnO42-的不断生成,溶液的颜色发生上述一系列变化。
(2)KMnO 4的用量对K2MnO4生成的影响
取1/4米粒大小的MnO2固体于试管中,加入14滴6 mol·L -1NaOH溶液和一定量的0.01 mol·L-1KMnO4溶液,在80℃ ~90℃的水浴中加热,观察溶液颜色的变化。
实验现象如图:

反映出在NaOH的用量一定,KMnO4的用量相对较少时,得到绿色溶液的速度快,KMnO4过量时,它本身的紫红色会影响K2MnO4绿色溶液的观察(溶液长时间呈现蓝绿色)。故应使NaOH和KMnO4的用量相当。
将由1滴KMnO4生成的绿色溶液离心分离,转移清液至小试管中,用2 mol·L-1的H2SO4酸化得不到紫红色的溶液,溶液呈较浅的桔红色。采用3滴KMnO4进行实验时,很快得到紫红色的溶液,因此取用3滴KMnO4较为适宜。
(3)反应温度对实验现象的影响
K2MnO4绿色溶液的生成需要加热,振荡很难使溶液由紫色变成绿色,而温度的高低对绿色溶液的生成也会有较大的影响。取1/4米粒大小的MnO2固体于试管中,加入14滴6 mol·L-1 NaOH溶液和3滴0.01 mol·L-1KMnO4溶液,在不同的温度条件下加热反应,实验结果如图:
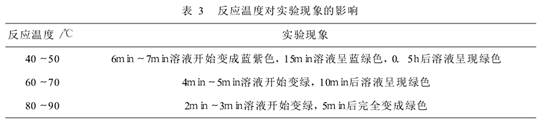
可知,温度越高,KMnO4向K2MnO4转化的速度越快。酒精灯直接加热时,溶液颜色变化快;水浴加热时,离心试管受热比较均匀,而且溶液一系列的颜色变化比较容易观察。所以实验时采取高温水浴加热(90℃左右)得到绿色溶液。
(4)酸的用量对K2MnO4歧化反应的影响
取1/4米粒大小的MnO2固体于离心试管中,加入14滴6 mol·L -1NaOH溶液和3滴0.01 mol·L-1KMnO4溶液,在80℃~90℃水浴加热后得到深绿色K2MnO4溶液。离心分离,将清液转移到小试管中,逐滴加入2mol·L-1~3 mol·L-1~H2SO4酸化,考察K2MnO4的歧化情况。
实验现象见图:

可知,快速加入H2SO4得到的是红色溶液,放置一段时间后再加H2S04易得紫红色溶液。而用2mol·L-1~3 mol·L-1的硫酸都能得到紫红色溶液,即在这个浓度范围内硫酸的浓度对实验现象的影响不大,影响实验现象的主要因素是加人酸的速度。
综上所述,可得K2MnO4生成与歧化的实验方案:取1/4米粒大小的MnO2固体于离心试管中,加入12滴~14滴6 mol·L-1 NaOH溶液和3滴0.01 mol·L-1~KMnO4溶液,在80℃ ~90℃ 水浴加热后得到绿色K2MnO4溶液。离心分离,将清液转移到小试管中,逐滴加入2mol·L-1或3 mol·L-1H2SO 4酸化,放置,观察K2MnO4的歧化情况。
(5)Mn3+生成与歧化实验
通常实验中用MnSO4在冷的、强酸性环境下与KMnO4反应,观察红色溶液,即Mn3+的生成。再加碱中和,观察实验现象。实际操作过程中,许多条件对实验现象都有明显的影响。
仿照K2MnO4生成与歧化的研究思路,研究反应的温度、浓硫酸的用量、KMnO4溶液的用量等因素对Mn3+生成与歧化实验结果的影响,得到M3+生成与歧化反应的实验方案:取5滴0.2mol·L-1MnSO4溶液于试管中,加入5滴浓H2SO4后,放人冰水中冷却,再加入1滴~2滴0.01 mol·L-1KMnO4溶液,振荡后观察深红色溶液的生成。再用6 mol·L-1的NaOH中和,逐滴加入至20滴左右,观察溶液颜色变化及棕色沉淀的生成。
四、结论
锰各种氧化态之间的转化可以由自由能的大小解释,其中酸碱度、反应物用量、温度都会对锰各种氧化态之间的转化造成影响。
五、参考文献
[1]《普通化学实验(B)讲义》
[2]《对无机化学教材中引进锰的自由能——氧化态图的探讨》 黄如丹 赵宁 1991
[3]《氧化态锰相互转化的实验教学研究》 吕银华,付勤,余新武,刘江燕(湖北师范学院化学与环境工程系,湖北黄石 435002) No 3,2005
六、小组分工
第二篇:实验八 铁钴镍
铁、钴、镍
1. 实验目的
试验并掌握二价铁、钴、镍的还原性和三价铁、钴、镍的氧化性。试验并掌握铁、钴、镍配合物的生成及性质。
2. 实验用品
仪器:试管、离心试管
固体药品:硫酸亚铁铵、硫氰酸钾
液体药品:H2SO4(6mol·L-1,1mol·L-1)、HCl(浓)、NaOH(6mol·L-1,2mol·L-1)、(NH4)2Fe(SO4)2(0.1mol·L-1)、CoCl2(0.1mol·L-1)、NiSO4(0.1mol·L-1)、KI(0.5mol·L-1)、K4[Fe(CN)6](0.5mol·L-1)、氨水(6mol·L-1,浓)、氯水、碘水、四氯化碳、戊醇、乙醚、H2O2(3%)、FeCl3(0.2mol·L-1)、KSCN(0.5mol·L-1)。 材料:碘化钾淀粉试纸
3. 实验原理
铁、钴、镍是周期系第(Ⅷ)族元素的第一个三元素组,性质很相似,在化合物中常见的氧化值为+2、+3。
铁、钴、镍的+2价氢氧化物都是呈碱性,具有不同颜色,空气中氧对它们的作用情况各不相同,Fe(OH)2很快被氧化成红棕色Fe(OH)3,但是在氧化过程中可以生成绿色到几乎黑色的各种中间产物,而Co(OH)2缓慢地被氧化成褐色Co(OH)3,Ni(OH)2与氧则不起作用,若用强氧化剂,如溴水,则可使Ni(OH)2氧化成Ni(OH)3。
NiSO4 + Br2 + 3NaOH = Ni(OH)3 ↓+ NaBr + Na2SO4
除Fe(OH)3外,Ni(OH)3、Co(OH)3与HCl作用,都能产生氯气: 2Ni(OH)3 + 6HCl = 2NiCl2 + Cl2 ↑+6H2O
2Co(OH)3 + 6HCl = 2CoCl2 + Cl2 ↑+6H2O
由此可以得出+2价铁、钴、镍氧化物的还原性及+3价铁、钴、镍氢氧化物的氧化性的变化规律。
Fe(Ⅱ、Ⅲ)盐的水溶液易水解。Fe2+为还原剂,而Fe3+为弱氧化剂。 铁、钴、镍都能生成不溶于水而易溶于稀酸的难溶物质。 铁、钴、镍能生成很多配合物,其中常见的有K4[Fe(CN)6]、K3[Fe(CN)6]、
[Co(NH3)6]Cl3、K3[Co(NO2)]6、[Ni(NH3)]SO4等,Co(II)的配合物不稳定,易被氧化为Co(Ⅲ)的配合物:
4Co(NH3)6 2+ + O2 + 2H2O = 4Co(NH3)62+ + 4OH-
而Ni的配合物则以+2价的稳定。
在Fe3+溶液中加入K4[Fe(CN)6]溶液,在Fe2+溶液中加入K3[Fe(CN)6]溶液都能产生“铁蓝”沉淀。
Fe3+ + [Fe(CN)6]4- + K+ +H2O = KFe[Fe(CN)6Fe.H2O] ↓
Fe2+ + [Fe(CN)6]3- + K+ +H2O = KFe[Fe(CN)6Fe.H2O] ↓
在Co2+溶液中加入饱和KNCS溶液生成蓝色配合物[Co(SCN)4]2-配合物在水溶液中不稳定,易溶于有机溶剂中,如丙酮,它能是蓝色更为显著。 Ni2+溶液与二乙酰二肟在溶液中作用,生成鲜红色鳌合物沉淀:
通常,利用形成配合物的特征颜色来鉴定Fe3+、Fe2+、Co2+、Ni2+
4. 实验内容
(一) 铁(Ⅱ)、钴(Ⅱ)、镍(Ⅱ)的化合物的还原性
1)铁(Ⅱ)的还原性
(1)酸性介质 往盛有0.5mL氯水的试管中加入3滴6mol·L-1H2SO4溶液,然后滴加(NH4)2Fe(SO4)2溶液,观察现象,写出反应式(如现象不明显,可滴加1滴KSCN溶液,出现红色,证明有Fe3+生成)。
(2)碱性介质 在一试管中放入2mL蒸馏水和3滴6mol·L-1H2SO4溶液煮沸,以赶尽溶于其中的空气,然后溶入少量硫酸亚铁铵晶体。在另一试管中加入3ml 6mol·L-1NaOH溶液煮沸,冷却后,用一长滴管吸取NaOH溶液,插入(NH4)2Fe(SO4)2溶液(直至试管底部),慢慢挤出滴管中的NaOH溶液,观察产物颜色和状态。振荡后放置一段时间,观察又有何变化,写出反应方程式。产物留作下面实验用。
2)钴(Ⅱ)的还原性
(1)往盛有CoCl2溶液的试管中加入氯水,观察有何变化。
观察沉淀的生成。(2)在盛有1mL CoCl2溶液的试管中滴入稀NaOH溶液,
所得沉淀分成两份,一份置于空气中,一份加入新配制的氯水,观察有何变化,第二份留作下面实验用。
3)镍(Ⅱ)的还原性
用NiSO4溶液按2(1)、(2)实验方法操作,观察现象,第二份沉淀留作下面实验用。
(二)铁(Ⅲ)、钴(Ⅲ)、镍(Ⅲ)的化合物的氧化性
1)在前面实验中保留下来的氢氧化铁(Ⅲ)、氢氧化钴(Ⅲ)和氢氧化镍(Ⅲ)沉淀中均加入浓盐酸,振荡后各有何变化,并用碘化钾淀粉试纸检验所放出的气体。
2)在上述制得的FeCl3溶液中加入KI溶液,再加入CCl4,振荡后观察现象,写出反应方程式。
(三) 配合物的生成
1)铁的配合物
(1)往盛有1mL亚铁氰化钾(六氰合铁(Ⅱ)酸钾)溶液的试管中,加入约0.5mL的碘水,摇动试管后,滴入数滴硫酸亚铁铵溶液,有何现象发生?此为Fe2+的鉴定反应。
(2)向盛有1mL新配制的(NH4)2Fe(SO4)2溶液的试管中加入碘水,摇动试管后,将溶液分成两份,各滴入数滴硫氰酸钾溶液,然后向其中一支试管中注入约0.5mL 3% H2O2溶液,观察现象。此为Fe3+的鉴定反应。
(3)往FeCl3溶液中加入K4[Fe(CN)6]溶液,观察现象,写出反应方程式。这也是鉴定Fe3+的一种常用方法。
(4)往盛有0.5mL 0.2mol·L-1FeCl3的试管中,滴入浓氨水直至过量,观察沉淀是否溶解。
2)钴的配合物
(1)往盛有1mL CoCl2溶液的试管里加入少量硫氰酸钾固体,观察固体周围的颜色。再加入0.5mL戊醇和0.5mL乙醚,振荡后,观察水相和有机相的颜色,这个反应可用来鉴定Co2+。
(2)往0.5mL CoCl2溶液中滴加浓氨水,至生成的沉淀刚好溶解为止,静置一段时间后,观察溶液的颜色有何变化。
3)镍的配合物
往盛有2mL 0.1mol·L-1NiSO4溶液中加入过量6mol·L-1氨水,观察现象。静置片刻,再观察现象,写出离子反应方程式。把溶液分成四份:一份加入2mol·L-1NaOH溶液,一份加入1mol·L-1H2SO4溶液,一份加水稀释,一份煮沸,观察有何变化。
5. 实验注意事项
在CoCl2溶液中滴加稀NaOH溶液,先生成蓝色Co(OH)2沉淀,放置一段时间(或加热),沉淀便转变成更稳定的粉红色的Co(OH)2沉淀。