电解质安全风险分析报告
安全风险分析报告
设计项目名称:电解质(Na、K、Cl)测定试剂盒
设计安全类别:第二类产品
设计参照标准:GB/T191-2000《包装储运图示标志》
YY/T0316-2003《医疗器械风险管理对
医疗器械的应用》
设计单位:合肥华今生物科技有限公司
电解质(Na、K、Cl)测定试剂盒
安全风险分析报告
一、用于判定医疗器械可能影响安全性的特征的问题
1、什么是预期用途、预期目的和怎样使用医疗器械?
答:电解质(Na、K、Cl)测定试剂盒(以下简称试剂盒)主要用于人体内主要存在的正负电解质(Na、K、Cl),在检测电解质水平判断有无水、电解质紊乱和做出相关诊断,由医院检验人员按照说明书使用。
2、医疗器械是否预期和患者或其它人员接触?
答:无接触。
3、在医疗器械中包含有何种材料或组分或与其共同使用、或与医疗器械接触?
答:试剂盒内含三种试液:ISE参比液,ISE稀释液和ISE内标液,ISE参比液为1mol/L氯化钾溶液,ISE稀释液由10mmol/L 三羟甲基氨基甲烷缓冲液、7mmol/L三乙醇胺和防腐剂组成,ISE内标液由10mmol/L三羟甲基氨基甲烷缓冲液、7mmol/L三乙醇胺、3.06mmol/L氯化钠、1.45mmol/L醋酸钠、0.16mmol/L氯化钾和防腐剂组成。试剂盒检测时不与其它医疗器械接触。
4、是否有能量给予患者或从患者身上提取?
答:否。
5、是否有物质给予患者或从患者身上提取?
答:从患者体内抽取血样。
6、是否由医疗器械处理生物材料然后再次使用?
答:否。
7、医疗器械是否以无菌形式提供或准备由使用者灭菌、或用其他微生物控制方法灭菌?
答:无需灭菌。
8、医疗器械是否预期由用户进行常规清洁和消毒?
答:否。
9、医疗器械是否预期改善患者的环境?
答:否。
10、医疗器械是否进行测量?
答:否。
11、医疗器械是否进行分析处理?
答:否。
12、医疗器械是否预期和医药或其它医疗技术联合使用?
答:否。
13、是否有不希望的能量或物质输出?
答:无。
14、医疗器械是否对环境敏感?
答:否。
15、医疗器械是否影响环境?
答:否。
16、医疗器械是否有基本消耗品或附件?
答:无。
17、是否需要维护和校准?
答:否。
18、医疗器械是否有软件?
答:否。
19、医疗器械是否有储存寿命限制?
答:有效期为12个月。
20、是否有延迟和(或)长期使用效应?
答:否。
21、医疗器械承受何种机械力?
答:无需承受。
22、是什么决定医疗器械的寿命?
答:PH稳定性。
23、医疗器械是否预期一次性使用?
答:是。
24、医疗器械是否需要安全的退出运行或处置?
答:否。
25、医疗器械的安装或使用是否需要专门的培训?
答:否。
26、是否需要建立或引入新的生产过程?
答:否。
27、医疗器械的成功使用,是否决定性的取决于人为因素,例如使用者接口?
(1) 医疗器械是否有连接部分或附件?
答:否。
(2) 医疗器械是否有控制接口?
答:否。
(3) 医疗器械是否显示信息?
答:否。
(4) 医疗器械是否由菜单控制?
答:否。
28、医疗器械是否预期为移动式或便携式?
答:是。
二. 风险种类认定
1、能量危害
说明:本试剂盒不产生电能、热能、机械力、电离辐射等能量和能力,也不产生磁场、振动和声压等,本试剂盒也没有组件、支持物等附件,不会出现非预期性运动,因此没有能量危害。
2、生物学危害
说明:本试剂盒不含致病性菌株以及有活性的微生物,也不含高分子化合物,试剂盒成分主要由一般化学试剂组成,在使用过程中应注意以下几点:
(1)接触皮肤:一旦接触皮肤,立即用大量凉水冲洗皮肤,然后脱掉受污染的衣服,避免扩散到健康皮肤上,用无菌纱布覆盖伤处,定时观察症状,如果出现疼痛、灼伤或红肿现象,应及时去医院就诊。
(2)溅入眼睛:溅入眼睛后,用手指撑开眼睑,再用温水冲洗眼睛15分钟,如果戴隐形眼镜的话摘去隐形眼镜。严重的话,去医院就诊。
(3)吸入危害:一旦吸入,应立即转移至通风处,吸收新鲜空气,出现呼吸困难、咳嗽或其它症状应立即去医院就诊。
(4)吞入危害:如果吞入的话,应立即用清水吞入稀释,严重的话,去医院就诊。
3、环境危害
说明:本试剂盒不产生电磁场和能量,也没有使用冷却剂;冷藏或室温下储存,室温下使用,对环境条件的要求不高,在极端环境条件下,试剂成分可能会失效,但不会对环境造成危害。
4、有关使用的危害
说明:本试剂盒由三种试剂组成,标记清晰,操作简单,并附操作说明书,检测人员不需具备专业技能和不需进行操作培训,按操作说明书上的步骤进行操作即可,本试剂盒不接触人体,不会对人体产生副作用。
5、功能性失效、维护及老化引起的危害
说明:本试剂盒应在有效期内使用,效期后应判定为失效,应作为医疗废弃物统一处理,效期内本试剂盒应放置在室温下贮藏,不需特别维护。
三、风险抑制与分析
通过对上述5种风险的分析,本试剂盒可以根据这几种风险类型有针对性的进行风险抑制。第一:试剂盒应按照要求进行贮藏和使用,避免有效成份失效或活性降低;第二:试剂使用时,应严格按照说明书上的操作步骤进行检测,主要避免因操作不当导致试剂接触到人体或人体某个器官;第三:该试剂使用完后,应作为医疗废弃物统一处理,不应放置在台面、冰箱或试剂盒内,避免重复使用。
四、结论
通过对本试剂盒的风险分析,可以确定,按照说明书上的要求进行操作,该试剂盒在贮藏和使用过程中对患者以及检验人员基本没有
危害,但在使用过程中,需要注意的是:
1、检验人员要按照说明书上的步骤进行操作。
2、如果某个试剂瓶内液体接近用完,不要用这个瓶子再装新鲜试剂使用,应废弃老的试剂及残留液体。
3、如果试剂中含有大量的溶解性气体,检验将会出现问题,所以使用前,应轻轻摇匀。
第二篇:安全风险分析报告
**产品
风险分析报告
**公司
编制: 日期:
审核: 日期:
批准: 日期:
目录
1. 编制依据................................................................. 2
1.1. 相关标准........................................................... 2
1.2. 产品的有关资料..................................................... 2
2. 目的和适用范围........................................................... 3
3. 产品描述................................................................. 3
4. 产品风险识别............................................................. 3
4.1. 产品预期用途....................................................... 3
4.2. 产品风险分析....................................................... 3
4.3. 产品风险清单....................................................... 9
5. 风险评价和风险控制...................................................... 15
5.1. 风险评价准则...................................................... 15
5.2. 风险水平综合表.................................................... 15
5.3. 风险控制表........................................................ 16
5.4. 剩余风险评价..................................................... 19
a) 产生的其他危害...................................................... 19
b) 风险评价的完整性.................................................... 19
c) 全部剩余风险的评价.................................................. 19
6. 结论.................................................................... 19
产品名称
**产品
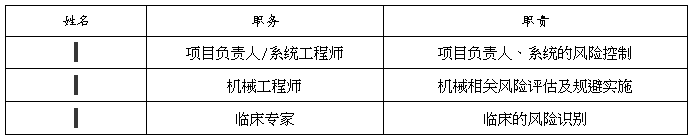
风险分析主要人员及职责
1. 编制依据
1.1. 相关标准
涵盖该产品到目标市场上市需遵循的所有国内或国际标准。
1) YY/T 0316-2008 医疗器械 风险管理对医疗器械的应用
2) *********
1.2. 产品的有关资料
1) 使用说明书
2) 技术文档
2. 目的和适用范围
此风险分析是针对**公司的**产品进行的,目的在于识别和控制该产品在设计研发阶段可遇见的风险。报告列出了该款产品所有已识别的危害和每个危害产生的原因,并对每种危害可能产生损害的严重度和危害的发生概率进行了估计,报告还列出了在研发过程中对各个风险采取的控制措施和验证方法,并对采取降低风险措施后的剩余风险重新进行了评价。
本报告适用于**公司的**产品。
3. 产品描述
**公司的**产品*******等组成。
4. 产品风险识别
4.1. 产品预期用途
该产品适用于***症
**产品的预期操作者为有临床经验的医生,而且在操作仪器前,需经过培训。需由**公司指定的客服人员完成。
**产品的使用环境**科等。
4.2. 产品风险分析
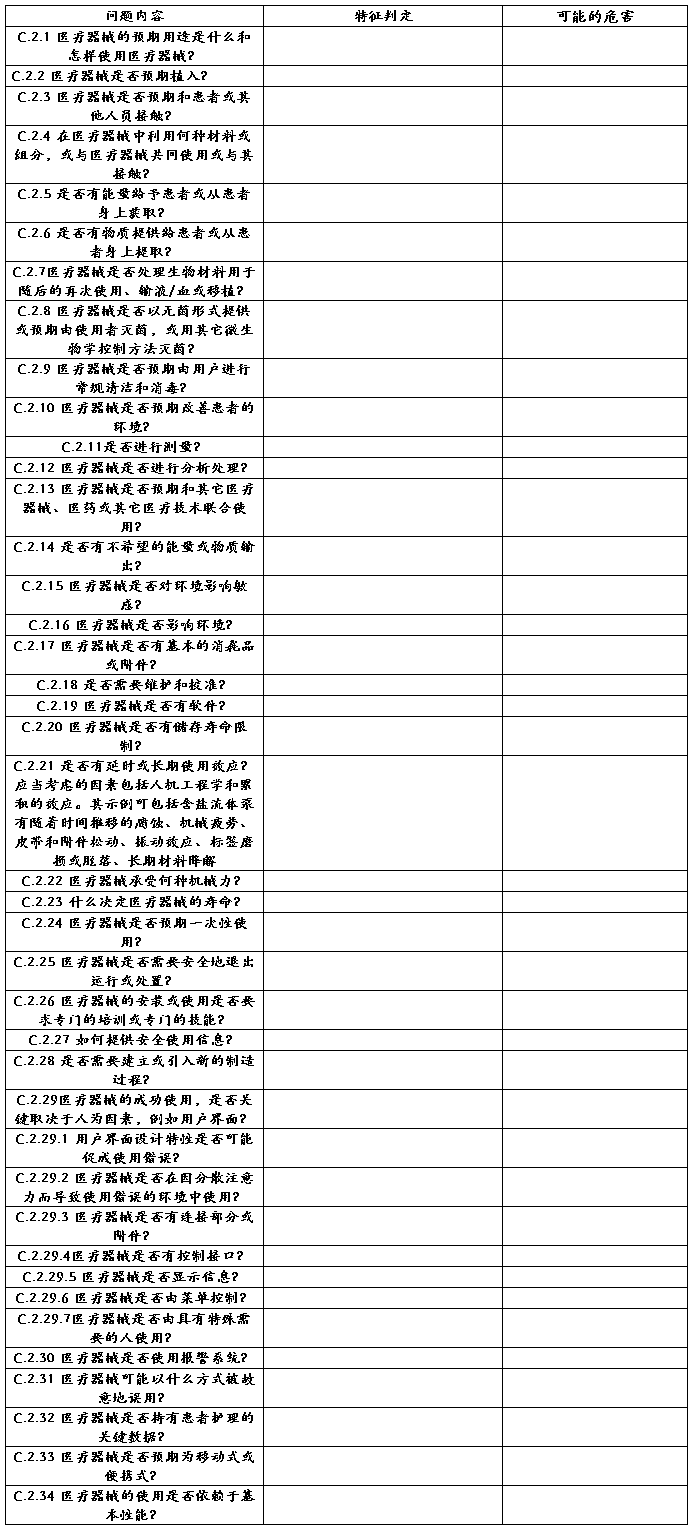
根据产品的预期用途,对ISO14971附录C问题进行回答;并根据问题结果,按照附录E列出初始已认知的和可预见的危害清单,并给出设计和开发中所采用的对策。
附录C:
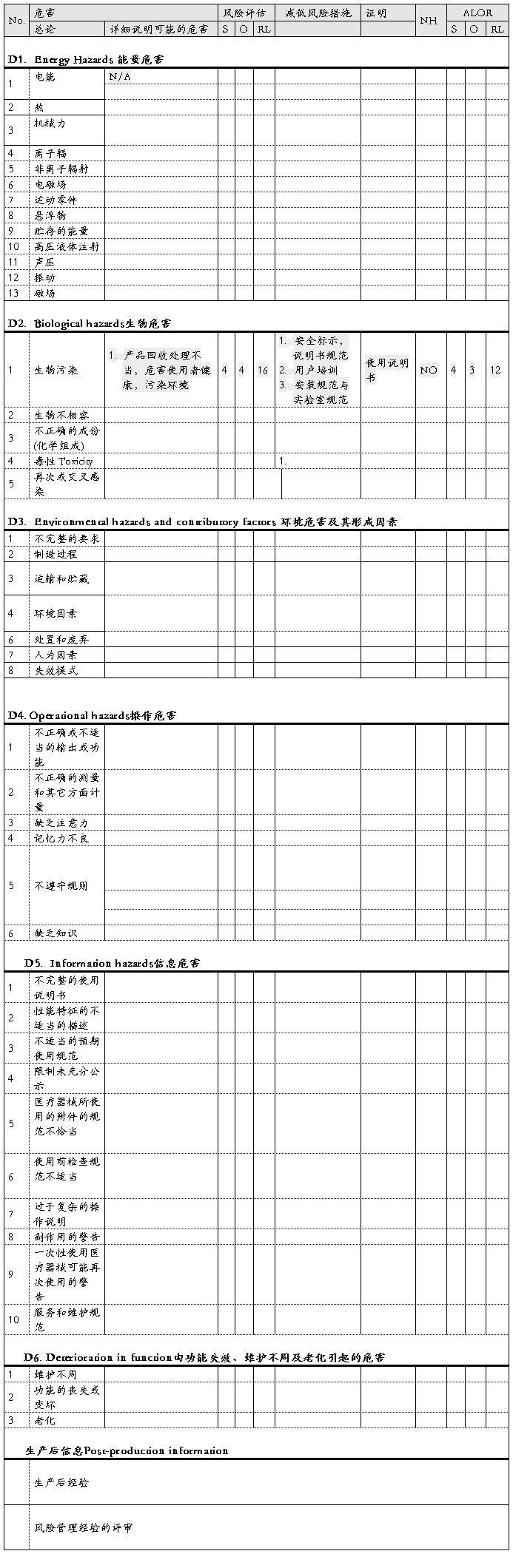
4.3. 产品风险清单
表1. 缩略词及含义

对包括能量危害、生物学危害、环境危害、有关使用的危害和由功能失效、维护不周及老化引起的危害等五个方面的分析以及相应的防范措施。
表2. 产品风险清单
5. 风险评价和风险控制
5.1. 风险评价准则
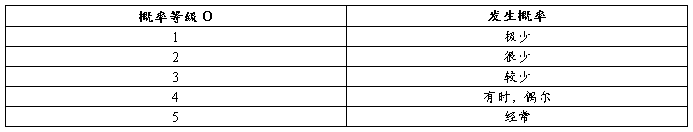
严重度分级

发生概率分级
风险可接受准则
风险=严重等级×概率等级
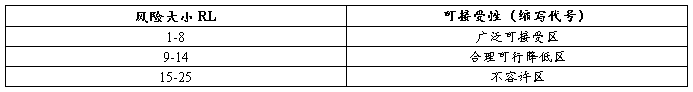
5.2. 风险水平综合表
以下风险水平表中,灰色区域为合理可降低区以及不容许区,需要进一步进行风险降低。

5.3. 风险控制表
通过对**产品产品风险的识别,依据风险评价准则,对降低风险所采取的措施在实施前后的风险大小进行分析,见下表。

5.4. 剩余风险评价

a) 产生的其他危害
采取的风险控制措施未产生新的危害。
b) 风险评价的完整性
所有已判定危害的风险已经得到了评价。
c) 全部剩余风险的评价
所有风险控制措施得到实施并加以验证,所有风险均降低至广泛可接受区,无剩余风险。
6. 结论
我们对**产品所有可能的危害以及每一个危害产生的原因进行了判定。对于每种危害可能产生损害的严重度和危害发生的概率进行了估计,并对危害采取了措施,最后所有风险均控制在广泛可接受区。已投产的**产品安全有效。
根据生产和生产后信息对试生产及投产的产品进行后续跟踪,作为风险管理文档保存。
-
安全风险分析报告模板
安全风险分析报告产品名称注册标准上的名称风险评价人员及背景项目组长医学角度的大夫技术角度的设计人员应用角度的市场角度的并提供人员资…
-
安全风险分析报告(模板)
血清碱性磷酸酶测定试剂盒ALP安全风险分析报告1总则血清碱性磷酸酶测定试剂盒以下简称ALP测试盒是一种临床检验体外诊断化学试剂中酶…
-
医用手动病床安全风险分析报告
安全风险管理分析报告缩略词说明用于判定可能影响安全性的医疗器械特征的问题用于判定可能影响安全性的医疗器械特征的问题安全风险分析NO…
-
20xx年安全生产风险分析报告模板
20XX年安全生产风险分析报告120XX年安全生产风险管控工作总体情况要求:(1)介绍公司和本单位年度风险控制措施任务完成情况,未…
-
安全风险评估报告
本企业安全风险评估报告一评估目的为保障全处生产经营任务的正常进行根据国家有关法律法规和企业的有关规定我处组织了对全处危险作业环境和…
-
医疗器械产品风险分析报告范例
产品风险分析报告广州市XX医疗器械有限公司20XX年6月一、产品预期用途/预期目的和与安全性有关的特征的判定按照《YY/T0316…
-
安全风险分析报告模板
安全风险分析报告产品名称注册标准上的名称风险评价人员及背景项目组长医学角度的大夫技术角度的设计人员应用角度的市场角度的并提供人员资…
-
NE103医用气体雾化器安全风险管理报告
安全风险管理分析报告缩略词说明用于判定可能影响安全性的医疗器械特征的问题用于判定可能影响安全性的医疗器械特征的问题安全风险管理分析…
-
安全风险分析报告
产品风险分析报告编制审核批准公司日期日期日期目录1编制依据211相关标准212产品的有关资料22目的和适用范围33产品描述34产品…
-
医用手动病床安全风险分析报告
安全风险管理分析报告缩略词说明用于判定可能影响安全性的医疗器械特征的问题用于判定可能影响安全性的医疗器械特征的问题安全风险分析NO…
-
安全生产风险分析报告
安全生产风险分析报告在矿党委、矿行政的正确领导下,矿井认真贯彻上级文件精神,以“一通三防”和防突管理为重点,严抓现场重点环节、薄弱…