有机化学实验十五甲基橙的制备
实验十五 甲基橙的制备Preparation of methyl orange
一.实验目的:
1. 了解偶联反应在有机合成中的应用。
2.掌握重氮盐和甲基橙的制备原理及方法。学会用冰水浴控温,巩固抽滤、重结晶、干燥等操作。
二.实验重点和难点:
1. 甲基橙制备反应原理。
2. 制备反应的操作方法。
实验类型:基础性 实验学时:4学时
三.实验装置和药品:
主要实验仪器:烧杯 酒精灯 试管 玻棒 温度计 抽滤瓶
布氏漏斗
主要化学试剂:对氨基苯磺酸晶体 亚硝酸钠 N,N--二甲苯胺 浓盐酸
氢氧化钠 95%乙醇 乙醚 冰醋酸 冰块 淀粉---碘化钾试纸
四. 实验装置图:


五.实验原理:
甲基橙是一种指示剂,它是由对氨基苯磺酸重氮盐与N,N--二甲基苯胺的醋酸盐。在弱酸性介质中偶合得到的。偶合首先得到的是嫩红色的酸式甲基橙,称为酸性黄。在碱中酸性黄转变为橙黄色的钠盐,即甲基橙。

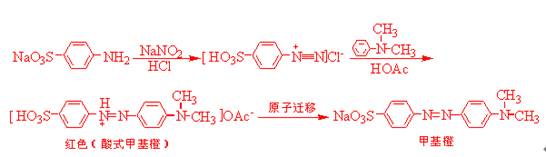
本实验主要运用了芳香伯胺的重氮化反应及重氮盐的偶联反应。由于原料对氨基苯磺酸本身能生成内盐,而不溶于无机酸,故采用倒重氮化法,即先将对氨基苯磺酸溶于氢氧化钠溶液,再加需要量的亚硝酸钠,然后加入稀盐酸。

六.实验內容及步骤:
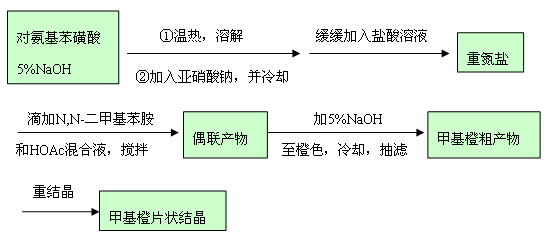
1. 重氮盐的制备:
在烧杯中放置10mL 5% NaOH 溶液及2.1g 对氨基苯磺酸晶体,温热使之溶解,然后冷却至室温。另溶解0.8g NaNO2 于6mL 水中,加入到上述烧杯内,用冰盐浴冷至0-50C。在不断搅拌下,将3mL 浓盐酸与10mL 水配成的溶液缓缓滴加到上述混合液中,(观察现象),并控制温度在50C 以下,滴加完后,用淀粉---碘化钾试纸检验(注意观察现象)。在冰盐浴中放置15min ,以保证反应完全。
2. 偶合反应:
在试管内混合1.3mL N,N--二甲苯胺和1mL 冰醋酸,在不断搅拌下,将此溶液慢慢加到上述冷却的重氮盐溶液中(观察现象),加完后,继续搅拌10min ,此时为红色液体,然后慢慢加入25mL 5%NaOH ,直至反应物变为橙色,这时反应液呈碱性。将反应物在沸水浴上加热5min,冷却至室温后,再在冰水浴中冷却,使甲基橙晶体析出完全。抽滤收集晶体,依次用水,乙醇分别洗涤两次,抽滤,烘干,称量所得甲基橙产物质量。
3. 溶解少许甲基橙于水中,分两支试管,分别滴加盐酸、氢氧化钠溶液,观察颜色变化。
七.实验注意事项:
0. 要注意试剂的加入次序。
1. 反应时控制好温度于0--5℃。
2. 反应时注意控制好试剂的滴加速度---缓慢滴加。
3. 对氨基苯磺酸是两性化合物,酸性比碱性强,以酸性内盐存在,所以它能与碱作用成盐而不能与酸作用成盐。
4. 若淀粉---碘化钾试纸不显蓝色,尚需补充亚硝酸钠溶液。
5. 重结晶操作应迅速,否则由于产物呈碱性,在温度高时易使产物变质,颜色变深。用乙醇、乙醚洗涤的目的是使其迅速干燥。
6. 湿的甲基橙在空气中受光的照射后,颜色很快变深,所以一般得紫红色粗产物。
7. 若反应物中含有未作用的n,n--二甲基苯胺醋酸盐,在加入氢氧化钠后,就会有难溶于水的n,n--二甲基苯胺析出,影响产物的纯度。
1、对氨基苯磺酸是两性化合物,其酸性略强于碱性,所以它能溶于碱中而不溶于酸中。但重氮时,又要在酸性溶液中进行,因此生氨时,首先将对氨基苯磺酸与碱作用变成水溶性较大的细盐。
2、重氮化反应中,溶液酸化时生成亚硝酸,同时,对氨基苯磺酸钠变为对氨基苯磺酸从溶液中以细粒状沉淀析出,并立即与亚硝酸作用,发生重氮化反应,生成粉末状的重氮盐。为了使对氨基苯磺酸完全重氮化,反应过程必须不断搅拌。
3、重氮化反应过程中控制温度很重要,若温度高于5℃,则生成的重氮盐易水解成酚类,降低产率。
4、滴加(1)完毕用淀粉-碘化钾试纸检验,若不显蓝色,尚需酌情补加亚硝酸钠溶液。若亚硝酸已过量,可用尿素水溶液使其分解。2HNO2+2KI+2HCl→I2+2NO+2H2O+2KCl
5、偶合反应结束后反应液呈弱碱性,若呈中性,则继续加入少量碱液至恰呈碱性,因强碱性又易产生成树脂状聚合物而得不到所需产物。
6、重结晶操作要迅速,否则由于粗产物呈碱性,在温度高时易变质,颜色变深。用乙醇和乙醚洗涤的目的是使其迅速干燥。
7、湿的甲基橙在空气中受光照射后,颜色会很快变深,故一般得紫红色粗产物,如再依次用水、乙醇、乙醚洗涤晶体,可使其迅速干燥。
8、溶解少许产品于水中,加几滴稀盐酸,然后再用稀氢氧化钠溶液中和,观察溶液颜色有何变化。
操作要点与说明
1. 本反应温度控制相当重要,制备重氮盐时,温度应保持在10℃以下。如果重氮盐的水溶液温度升高,重氮盐会水解生成酚,降低产率。
2. 对氨基苯磺酸是两性化合物,酸性比碱性强,以酸性内盐存在,所以它能与碱作用成盐而不与酸作用成盐。
3. 若含有未作用的N,N-二甲基苯胺醋酸盐,在加入氢氧化钠后,就会有难溶于水的N,N-二甲基苯胺析出,影响纯度。
4.由于产物呈碱性,温度高易变质,颜色变深。反应产物在水浴中加热时间不能太长(约5min),温度不能太高(约60℃-80℃),否则颜色变深(为什么)。
5.由于产物晶体较细,抽滤时,应防止将滤纸抽破(布氏滤斗不必塞得太紧)。用乙醇、乙醚洗涤的目的是使其迅速干燥。湿的甲基橙受日光照射,亦会颜色变淡,通常在55-78℃烘干。所得产品是一种钠盐,无固定熔点,不必测定。
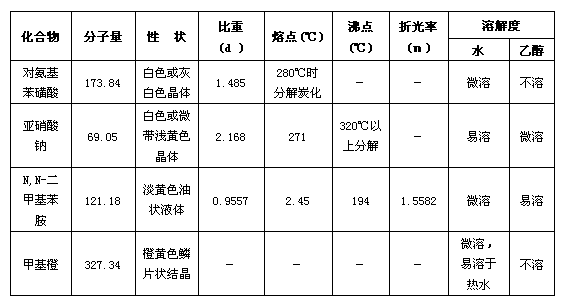
八. 实验相关內容:
物理常数
九. 思考题:
1. 在本实验中,制备重氮盐时为什么要把对氨基苯磺酸变成钠盐?
2. 试解释甲基橙在酸碱介质中的变色原因,并用反应式表示。
4.在重氮盐制备前为什么还要加入氢氧化钠?如果直接将对氨基苯磺酸与盐酸混合后,再加入亚硝酸钠溶液进行重氮化操作行吗?为什么?
答:因为对氨基苯磺酸是酸性内盐,用碱把内盐转化为芳香伯胺才能与NaNO2/HCl形成重氮盐,不行。因对氨基苯磺酸与盐酸混合仍得到对氨基苯磺酸内盐而不能产生芳香伯胺,不能制备重氮盐。
5.制备重氮盐为什么要维持0-5℃的低温,温度高有何不良影响?
6.重氮化为什么要在强酸条件下进行?偶合反应为什么要在弱酸条件下进行?
7.何谓重氮化反应?为什么此反应必须在低温、强酸性条件下进行?
8.本实验中,制备重氮盐时,为什么要把对氨基苯磺酸变成钠盐?本实验若改成下列操作步骤,先将对氨基苯磺酸与盐酸混合,再加亚硝酸钠溶液进行重氮化反应,可以吗?为什么?
9.什么叫做偶联反应?结合本实验讨论一下偶联反应的条件。
10.试解释甲基橙在酸碱介质中变色的原因,并用反应式表示。
1反应介质对反应是否有影响?重氮盐与酚类和芳胺偶合时,应在什么介质中更有利?为什么?
2.制备重氮盐时(如制备氯化重氮苯),为什么要在强酸介质中进行,且酸要适当过量?
3.重氮化反应为什么是在低温下进行?
4.在进行重氮反应时,为什么加亚硝酸钠溶液(直接法重氮化)或加盐酸溶液(倒转法重氮化)时要慢?
5.制备甲基橙时,难溶于酸的对氨基苯磺酸大多采用倒转法重氮化,在缓慢加入盐酸溶液的同时,为什么要不断地搅拌?
6.在甲基橙制备试验中,制备重氮盐时,为什么要把对氨基苯磺酸变成钠盐后,再加亚硝酸钠及浓盐酸?如改成先将对氨基苯磺酸与浓盐酸混合,再加亚硝酸钠溶液进行重氮化反应,行不行?为什么?
8.制备甲基橙时,在重氮化过程中,HNO2过量是否可以?如何检验其过量?又如何销毁过量的HNO2?
9.粗甲基橙为什么要加热溶解后,再加入固体NaCl进行重结晶?
10.粗甲基橙进行重结晶时,依次用少量水、乙醇和乙醚洗涤,目的何在?
11.甲基橙在酸碱溶液中分别呈何颜色?说明其变色原因。
12.把冷的重氮盐溶液慢慢倒入低温新制备的氯化亚铜的盐酸溶液中,将会发生什么反应?写出产物的名称。
第二篇:实验五 甲基橙的制备
0实验五 甲基橙的制备(4)
一、实验目的
1、通过甲基橙的制备学习重氮化反应和偶合反应的实验操作。
2、巩固盐析和重结晶的原理和操作。
二、实验原理
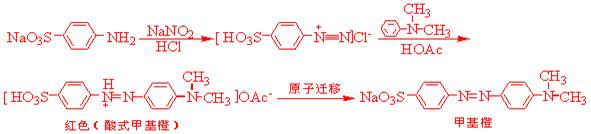
甲基橙是指示剂,它是由对氨基苯磺重氮盐与N,N-二甲基苯胺的醋酸盐,在弱酸介质中偶合得到的。偶合先得到的是红色的酸性甲基橙,称为酸性黄,在碱性中酸性黄转变为甲基橙的钠盐,即甲基橙。
1、重氮化反应

2、偶合反应
三、仪器和药品
仪器:烧杯、温度计、表面皿、玻璃棒、滴管、小试管、电热套、台秤、吸滤瓶、布氏漏斗、循环水真空泵。
药品:对氨基苯磺酸、10%氢氧化钠、亚硝酸钠、浓盐酸、冰醋酸、 N,N-二甲基苯胺、乙醇、乙醚、淀粉-碘化钾试纸、饱和氯化钠、冰。
四、实验操作
(一)方法一
1、重氮盐的制备
(1) 50mL烧杯中,加1g(0.005mol)对氨基苯磺酸,5mL 5%NaOH溶液,热水浴中温热使之溶解。
(2) 冷至室温后(最好用冰水浴冷却至5℃以下),加0.4g(0.005mol)亚硝酸钠,溶解。
(3) 搅拌下将混合物分批滴入装有6.5mL冰冷的水和1.3mL浓盐酸的烧杯中,使温度保持在5℃以下(重氮盐为细粒状白色沉淀)。
(4) 在冰浴中放置15min,使重氮化反应完全。
2、偶合反应
(1) 在另一烧杯中0.6g(0.7mL,0.005mol) N,N-二甲基苯胺溶于0.5mL冰醋酸中,不断搅拌下将此溶液慢慢加到上述重氮盐溶液中,继续搅拌10min,使反应完全。
(2) 慢慢加入8mL 10%氢氧化钠溶液(此时反应液为碱性),反应物呈橙色甲基橙粒状沉淀析出。
(3) 将反应物在沸水浴上加热5min,沉淀溶解,稍冷,置冰浴中冷却,抽滤,用饱和NaCl冲洗烧杯两次,每次5mL,并用此冲洗液洗涤产品,抽干。
(4)重结晶。粗产品用30ml热水重结晶。待结晶析出完全,抽滤,用少量乙醚洗涤,压紧抽干,得片状结晶。
(5)产品干燥(烘箱中烘干,温度调到70℃),称重(产量约1g),计算产率。
3、检验
溶解少许产品,加几滴稀HCl(变红),然后用稀NaOH中和(变黄),观察颜色变化。
(二)方法二
1、重氮盐的制备
在50mL烧杯中、加入1g对氨基苯磺酸结晶和5mL 5%氢氧化钠溶液,温热使结晶溶解,用冰水浴冷却至5℃以下。另在一试管中配制0.4g亚硝酸钠和3mL水的溶液。将此配制液也加入烧杯中。维持温度0-5℃,在搅拌下,慢慢用滴管滴入1.5mL浓盐酸和5mL水溶液,直至用淀粉-碘化钾试纸检测呈现蓝色为止,继续在冰盐浴中放置15分钟,使反应完全,这时有白色细小晶体析出。
2、偶合反应
在试管中加入0.7mL N,N-二甲基苯胺和0.5mL 冰醋酸,并混匀。在搅拌下将此混合液缓慢加到上述冷却的重氮盐溶液中,加完后继续搅拌10min。缓缓加入约8mL 10%氢氧化钠溶液,直至反应物变为橙色(此时反应液为碱性)。甲基橙粗品呈细粒状沉淀析出。
将反应物置沸水浴中加热5分钟,冷却后,再放置冰浴中冷却,使甲基橙晶体析出完全。抽滤,用10mL饱和氯化钠溶液洗涤两次,压紧抽干。干燥后得粗品约1.5g。
粗产品用1%氢氧化钠进行重结晶。待结晶析出完全,抽滤,依次用少量水、乙醇和乙醚洗涤,压紧抽干,得片状结晶。产量约1g。
3.检验
将少许甲基橙溶于水中,加几滴稀盐酸,然后再用稀碱中和,观察颜色变化。
五、注意事项
1、对氨基苯磺酸为两性化合物,酸性强于碱性,它能与碱作用成盐而不能与酸作用成盐。因此进行重氮化时,首先将对氨基苯磺酸与碱作用变成水溶性较大的钠盐。
2、重氮化过程中,要搅拌使重氮化完全
3、应严格控制温度,反应温度若高于5℃,生成的重氨盐易水解为酚,降低产率,导致失败。
4、重结晶操作要迅速,否则由于产物呈碱性,在温度高时易变质,颜色变深。
5、用乙醇和乙醚洗涤的目的是使其迅速干燥,湿的甲基橙受日光照射,会使颜色变深,通常在65-75℃烘干。
6、方法二中,若试纸不显色,需补充亚硝酸钠溶液。
六、思考题
1、在重氮盐制备前为什么还要加入氢氧化钠?如果直接将对氨基苯磺酸与盐酸混合后,再加入亚硝酸钠溶液进行重氮化操作行吗?为什么?
2、制备重氮盐为什么要维持0-5℃的低温,温度高有何不良影响?
3、重氮化为什么要在强酸条件下进行?偶合反应为什么要在弱酸条件下进行?
4、甲基橙在酸碱中介质中变色的原因,并用反应式表示之。
5、N,N-二甲基苯胺与重氮盐偶合为什么总是在氨基的对位上发生?
实验六 Diels-Alder反应(4)
一、实验目的
1、通过环戊二烯和马来酸酐的加成(Diels-Alder反应)验证环加成反应。
2、熟练掌握处理固体产物操作。
二、反应原理
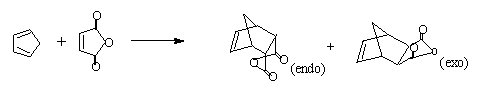
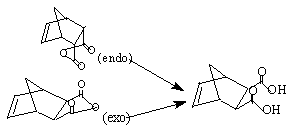
环戊二烯和马来酸酐在室温下聚合主要生成内型-降冰片烯-顺5,6-二酸酐,接着水解后得到相应的二元酸。
三、仪器和药品
仪器:烧杯、温度计、三角烧瓶、玻璃棒、电热套、台秤、吸滤瓶、布氏漏斗、循环水真空泵。
药品:马来酸酐、乙酸乙酯、石油醚、新蒸馏的环戊二烯、高锰酸钾。
四、实验步骤
1.在125mL干燥的三角烧瓶中加入2g马来酸酐,用7mL乙酸乙酯在水浴上加热溶解,再加入7mL石油醚(沸程60-90℃)。
2.稍冷后(不得析出结晶),往此溶液中加入2mL新蒸馏的环戊二烯,振荡反应瓶,直到放热反应完全。加成物为一白色固体。
3.抽滤(不能用水洗)、干燥、称重,计算产率(产量约3g,产率72%)。m.p.为164-165℃。
4.转变成二元酸。取1g上述产物于125mL三角烧瓶中,加7mL蒸馏水,加热至沸腾,振荡直至油状物全部溶解,放冷,磨擦瓶壁促使结晶,结晶完全后,抽滤、晾干、
5.称重,计算产率。产品mp为180-182℃。
6.检验。取加成产物少许溶解后加高锰酸钾溶液,现象:褪色。
五、注意事项
1.环戊二烯在室温下易二聚,使用前要蒸馏,收集40-45℃的馏分。马来酸酐如放置过久,需重结晶。
2.环戊二烯与马来酸酐的加成反应要在无水条件下进行,否则产物内型-降冰片烯-顺-5,6-二酸酐容易水解为内型的顺二羧酸,因此所用仪器和试剂必须干燥。
3.经抽滤分出的固体产物往往要在真空干燥器内进一步干燥,因为产物在空气中吸收水分发生部分水解,同时对熔点的测定也造成了困难。
六、思考题
写出下列反应的产物:

实验九 多步合成乙酰苯胺、对硝基乙酰苯胺及对硝基苯胺的制备(10)(设计)
一、实验目的
1、 通过多步合成掌握苯胺乙酰化、对硝基乙酰苯胺、对硝基苯胺反应的原理和方法。
2、 进一步熟悉相关的基本操作。
二、实验原理
1、乙酰苯胺的制备:胺的酰化在有机合成中有着重要的作用。作为一种保护措施,一级和二级芳胺在合成中通常被转化为它们的乙酰基衍生物以降低胺对氧化降解的敏感性,使其不被反应试剂破坏;同时氨基酰化后降低了氨基在亲电取代反应(特别是卤化)中的活化能力,使其由很强的第Ⅰ类定位基变为中等强度的第Ⅰ类定位基,使反应由多元取代变为有用的一元取代,由于乙酰基的空间位阻,往往选择性的生成对位取代物。
芳胺可用酰氯、酸酐或与冰醋酸加热来进行酰化,使用冰醋酸试剂易得,价格便宜,但需要较长的反应时间,适合于规模较大的制备。酸酐一般来说是比酰氯更好的酰化试剂。用游离胺与纯乙酸酐进行酰化时,常伴有二乙酰胺[ArN(COCH3)2]副产物的生成。但如果在醋酸-醋酸钠的缓冲溶液中进行酰化,由于酸酐的水解速度比酰化速度慢得多,可以得到高纯度的产物。但这一方法不适合于硝基苯和其它碱性很弱的芳胺的酰化。

2、对硝基乙酰苯胺的制备:芳香族硝基化合物一般由芳香族化合物直接硝化制得的。根据被硝化物的活性,可以利用稀硝酸、浓硝酸或浓硝酸与浓硫酸的混合酸来进行硝化。芳香化合物的硝化是亲电取代反应,反应是放热反应。加入硫酸的目的是为了硝酰正离子的产生,提高反应的产率。乙酰苯胺上带有强的活化基团,因此反应活性很大,反应要控制较低的反应温度,否则会产生多取代的副产物。
主反应:
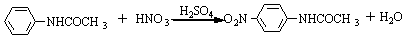
副反应:
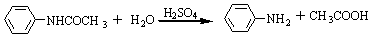
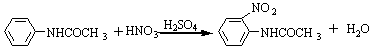
3、对硝基苯胺的制备:

三、仪器和药品
仪器:烧杯、50mL圆底烧瓶、抽滤瓶、电热套、温度计、分馏柱、循环水真空泵、抽滤瓶、布氏漏斗、电子台秤、锥形瓶、具支试管
药品:苯胺、冰醋酸、浓硫酸、浓硝酸、95%乙醇、20%氢氧化钠溶液、冰、pH试纸。
四、实验步骤
1. 乙酰苯胺的制备
在50mL圆底烧瓶中,加入10mL新蒸馏的苯胺[1]、15mL冰醋酸及少许锌粉[ 3](约0.1克)。装上一分馏柱[ 3],其上端装温度计。将圆底烧瓶在电热套上加热,使反应物保持微沸约15min。逐渐升高温度,当温度计读数达到100℃左右时,支管即有液体流出。维持温度在105℃反应1h,生成的水及大部分醋酸已被蒸出,此时温度计读数下降,表示反应已经完成。在搅拌下趁热[ 4]将反应物倒入250mL冷水中,冷却后抽滤,用冷水洗涤粗产品。粗产品用约200-300mL水重结晶[ 5],烘干,称重(产量约9-10g),计算产率。
纯乙酰苯胺为无色有闪光的小叶片状晶体,mp为114.3℃,bp为305℃。
2. 对硝基乙酰苯胺的制备
在100mL锥形瓶内,放入5g乙酰苯胺(0.037mol)和5mL冰醋酸[ 6]。用冷水冷却,一边摇动锥形瓶,一边慢慢地加入10mL浓硫酸。乙酰苯胺逐渐溶解。将所得溶液放在冰浴中冷却到0~2℃。
在冰浴中用2.2mL浓硝酸(0.032mol)和1.4mL浓硫酸配制混酸。一边摇动锥形瓶(加塞[7]),一边用吸管慢慢地滴加此混酸,保持反应温度不超过5℃[8]。从冰浴中取出锥形瓶,在室温下放置30min,间歇摇荡之。在搅拌下把反应混合物以细流慢慢地倒入20mL水和20g碎冰的混合物中[9],对硝基乙酰苯胺立刻成固体析出。放置约10 min,减压过滤,尽量挤压掉粗产物中的酸液[10],用冰水洗涤三次,每次用10mL。将粗产物放入一个盛20 mL水的烧杯中,在不断搅拌下分次加入碳酸钠粉未,直到混合液对酚酞试纸显碱性(pH=10左右)。将反应混合物加热至沸腾,这时对硝基乙酰苯胺不水解,而邻硝基乙酰苯胺则水解为邻硝基苯胺。混合物冷却到50℃时,迅速减压过滤,尽量挤压掉溶于碱液中的邻硝基苯胺,再用水洗涤并挤压去水份,将得到的对硝基乙酰苯胺放在空气中晾干[11]。称重(产量约4g),计算产率。
对硝基乙酰苯胺纯品为白色柱状晶体。mp.为215℃。
3. 对硝基苯胺的制备
在50mL圆底烧瓶中放入4g对硝基乙酰苯胺和20mL70%硫酸[12],投入沸石,装上回流冷凝管,加热回流10~20 min[13]。将透明的热溶液倒入100mL冷水中。加入过量的20%氢氧化钠溶液(pH=8左右)[14],使对硝基苯胺沉淀下来。冷却后减压过滤。滤饼用冷水洗去碱液后,在水中进行重结晶[15]。烘干,称重(产量约2.5g),计算产率。
纯对硝基苯胺[16]为黄色针状晶体,熔点为147.5℃。
五、注释
[1]苯胺最好用新蒸馏的。
[2]锌粉的作用是访止苯胺在反应过程中氧化,但不能加过多,否则在后处理过程中会出现不溶于水的氢氧化锌。(也可不加,因苯胺是新蒸馏的。)
[3]本实验必须使用分馏装置,并维持反应温度在100-110℃之间。
[4]反应物冷却后,固体产物立即析出,粘在瓶壁不易处理。故须趁热在搅动下倒入冷水中,以除去醋酸及未作用的苯胺。
[5]乙酰苯胺在100mL水中的溶解度是:25℃,0.563g;80℃,3.5 g;100℃,5.5 g。本实验重结晶的用量,最好使溶液在80℃左右为饱和状态。
[6]乙酰苯胺可以在低温下溶解于浓硫酸里,但速度较慢,加入冰醋酸可加速其溶解。醋酸的作用一是作溶剂,二是防止乙酰苯胺或对硝基乙酰苯水解。
[7]塞住瓶口的目的是防止硝酸挥发或吸收空气中水汽而降低浓度。
[8] 硝化反应是一放热的反应,因此温度的控制对该反应至关重要,反应的温度控制不好,副反应明显,产生大量的有色气体。滴加混酸的速度太快,此反应的温度超过5℃。乙酰苯胺与混酸在5℃下作用,主要产物是对硝基乙酰苯胺;在40℃则生成约25%的邻硝基乙酰苯胺。
[9]反应混合物要倒入冰水混合物中,目的在于防止副反应的发生。但不加搅拌或者倒入速度太快,使得析出的固体结块,导致产品不纯。
[10]抽滤得到粗品后要用冷水洗涤两次,而且要彻底压干,以彻底除去反应体系的混酸。否则对后续的碱化反应产生影响。
[11]还可利用邻硝基乙酰苯胺和对硝基乙酰苯胺在乙醇中溶解度的不同,在乙醇中进行重结晶,可除去溶解度较大的邻硝基乙酰苯胺。
[12]70%硫酸的配制方法:在搅拌下把4份(体积)浓硫酸小心地以细流加到3份(体积)冷水中。酸不仅是催化剂,同时也是反应试剂,它与水解所产生的胺形成铵盐溶于水溶液中,所以酸的量至少与酰胺等摩尔。通常为了迅速、完全水解,要投入6-7倍的酸量。
[13]可取1mL反应液加到2~3mL水中,如溶液仍清澈透明,表示水解反应已完全。
[14]原先的固体是硫酸的铵盐,中和后析出的晶体是对硝基苯胺,它在碱性条件下才能析出完全。
[15]重结晶的溶剂用量为:1g/50mL。
[16]对硝基苯胺有毒,且可透过皮肤被吸收,所以在操作时应十分注意勿触及皮肤。如不慎触及皮肤,应立即用少量乙醇擦洗,再用肥皂及温水洗涤。如不慎溅到实验台上,应用热水洗去。
六、思考题
1.用苯胺做原料进行苯环上的一些取代反应时,为什么常常首先要进行酰化?
2.苯胺乙酰化反应时为什么控制温度在105℃左右?
3.本实验采取哪些措施来提高乙酰苯胺产量的?
4.对硝基苯胺是否可以用苯胺直接硝化来制备?为什么?
七、说明
1.本实验为考试实验,希望同学们一定要按实验内容进行预习,设计好实验方案,时间为两周,每组在一周内完成,仍为原来的实验时间。
2. 本实验为多步合成,以苯胺为原料进行第一步合成,然后都是用自己合成的产品进行下一步的合成。
3.讲义中对硝基乙酰苯胺和对硝基苯胺制备的所有试剂用量只是参考量,每位同学的用量都不尽相同,要根据自己合成出来的产品,计算好下一个实验的试剂用量。
4.实验中出现的问题尽可能自己解决,教师只提供仪器、试剂的服务。
-
甲基橙的制备实验报告(4)沈杰
有机化学实验报告实验名称:甲基橙的制备学院:化学工程学院专业:化学工程与工艺班级:化工11-4班姓名:##学号指导教师:日期:20…
-
甲基橙的制备实验报告
实验学专班姓指导日机化学实验报告名称院化学工程学院业化学工程与工艺级化工xx班名xxx学号xxx教师期有一实验目的1通过甲基橙的制…
-
甲基橙的制备 有机化学实验报告
实验学专班姓指导日机化学实验报告名称甲基橙的制备业化学工程与工艺级名学号教师房江华李颖期有一实验目的1通过甲基橙的制备学习重氮化反…
- 甲基橙实验报告
-
甲基橙实验报告
有机化学实验报告实验名称学院专业班级姓名学号指导教师日期实验目的1通过甲基橙的制备学习重氮化反应和偶合反应的实验操作2巩固盐析和重…
-
甲基橙的制备 有机化学实验报告
实验学专班姓指导日机化学实验报告名称甲基橙的制备业化学工程与工艺级名学号教师房江华李颖期有一实验目的1通过甲基橙的制备学习重氮化反…
-
甲基橙的制备实验报告
实验学专班姓指导日机化学实验报告名称院化学工程学院业化学工程与工艺级化工xx班名xxx学号xxx教师期有一实验目的1通过甲基橙的制…
-
甲基橙的制备实验报告(4)沈杰
有机化学实验报告实验名称:甲基橙的制备学院:化学工程学院专业:化学工程与工艺班级:化工11-4班姓名:##学号指导教师:日期:20…
-
10银纳米粒子制备实验报告
开放实验总结报告学生姓名班级学号所在院系专业开放实验室名称218218221实验室日期一实验项目概况二实验项目技术报告23456三…
- 甲基橙实验报告