实验三、HCl标准溶液的配制与标定
实验三、HCl标准溶液的配制与标定
一、实验目的:
1、学会酸的配制方法; 2、掌握酸的标定方法; 二、实验原理:
先用间接法配制好HCl溶液;标定HCl标准溶液的浓度可选用基准物无水Na2CO3 或硼砂;以甲基橙作为指示剂。
Na2CO3 + 2 HCl ==== 2NaCl + H2O + CO2
三、仪器和试剂
仪器:50ml酸式滴定、三角瓶、小烧杯、25ml移液管、玻璃棒、250ml
容量瓶、胶头滴管、10ml量筒、洗瓶、废液缸。 试剂:浓HCl(密度为1.19g/ml 、百分含量为36.5%)、无水Na2CO3、
甲基橙指示剂 四、实验步骤:
1、配制250ml 0.1mol / L HCl溶液
准备:洗涤所用仪器
1) 计算:所需浓HCl的体积。 2) 量取:用量筒量取浓HCl。
3) 溶解:加约30 ml 的水进行溶解,直到冷却。 4) 转移:借助玻璃棒转移到容量瓶中。 5) 洗涤:所洗溶液也全部转移到容量瓶中。 6) 定容:加水至刻度。 7) 摇匀:把溶液摇均匀。 8)贴上标签。
2、0.1mol / L HCl溶液的标定
准备:洗涤所用仪器
1)在电子天平上准确称取3份无水Na2CO3 0.1~0.2g,分别置于已编号的三角瓶中。2)用量筒各加入25ml蒸馏水溶解并摇匀。 3)分别加入2滴甲基橙指示剂。
4)准备好酸式滴定管(装入已配好的HCl溶液)。 5)用HCl溶液滴定至橙色,30秒不褪色为滴定终点。 6)准确记录消耗HCl溶液的体积。 7)做一空白试验。
8)计算出HCl溶液的准确浓度。
3、记录:
m1 = m2 = m3 =
V1 = V2 = V3 = V0 = 4、计算:
m平均值= V平均值 =
C HCl =2 m Na2CO3
M Na2CO3 × VHCl /1000
实验二、NaOH标准溶液的配制与标定
一、实验目的:
1、学会碱的配制方法; 2、掌握碱的标定方法; 二、实验原理:
先用间接法配制好NaOH溶液;标定NaOH标准溶液的浓度可选用
8)计算出NaOH溶液的准确浓度。
3、记录:
m1 = m2 = m3 =
V1 = V2 = V3 = V0 = 基准物KHP(固体)或草酸 ;以0.1%酚酞作为指示剂。
KHP + NaOH === KNaP + H2O
三、仪器和试剂
仪器:25ml碱式滴定、三角瓶、小烧杯、25ml移液管、玻璃棒、250ml容量瓶、胶头滴管、托盘天平、洗瓶、废液缸。 试剂:NaOH(固体)、KHP(固体)、0.1%酚酞指示剂 四、实验步骤:
1、配制250ml 0.1mol / L NaOH溶液
准备:洗涤所用仪器 1) 计算:所需NaOH的质量 2) 称量:托盘天平称取NaOH固体
3) 溶解:加约30 ml 的水进行溶解,直到冷却。 4) 转移:借助玻璃棒转移到容量瓶中。 5) 洗涤:所洗溶液也全部转移到容量瓶中。 6) 定容:加水至刻度。 7) 摇匀:把溶液摇均匀。
8) 最后转移到塑料瓶,并贴上标签。
2、0.1mol / L NaOH溶液的标定(KHP标定NaOH溶液) 准备:洗涤所用仪器
1)在电子天平上准确称取3份邻苯二甲酸氢钾0.4~0.6g,分别置于已编号的三角瓶中。 2)用量筒各加入25ml蒸馏水溶解。 3)分别加入2滴 0.1% 酚酞指示剂。
4)准备好碱式滴定管(装入已配好的NaOH溶液)。 5)用NaOH溶液滴定至粉红色,30秒不褪色为终点。 6)准确记录消耗NaOH溶液的体积。 7)做一空白试验。
4、计算:
m平均值= V
CNaOH =
平均值 = WKHP × 1000 MKHP × VNaOH
实验四、酸碱标准溶液的标定
一、实验目的:
1、学会称量的技术。
2、掌握容量仪器的使用方法,滴定操作技术和标准溶液的标定方法。
二、实验原理:
先用间接法配制好NaOH溶液和HCl溶液;然后用KHP标定NaOH溶液的浓度,再用已知浓度的NaOH溶液标定HCl溶液的准确浓度;接着用无水Na2CO3 标定HCl溶液的浓度,再用已知浓度的HCl溶液标定NaOH溶液的准确浓度。
KHP + NaOH === KNaP + H2O
Na2CO3 + 2 HCl ==== 2NaCl + H2O + CO2 NaOH + HCl === NaCl + H2O
为了训练滴定分析基本操作,现选用酚酞和甲基橙为指示剂指示终点,应注意判断好终点,准确记录所消耗NaOH溶液和HCl溶液的体积。 三、仪器和试剂
仪器:25ml酸式滴定、25ml碱式滴定、三角瓶、小烧杯、25ml移液管、玻璃棒、250ml
容量瓶、胶头滴管、50ml(25ml)量筒、塑料瓶、洗瓶、托盘天平。
试剂:NaOH(固体)、浓HCl(液体)、KHP(固体)、无水Na2CO3(固体)
0.1%酚酞指示剂、甲基橙指示剂
四、实验步骤:
1、0.1mol / L NaOH溶液的标定(KHP标定NaOH溶液) 准备:洗涤所用仪器
1)在电子天平上准确称取3份邻苯二甲酸氢钾(KHP)0.4~0.6g,分别置于已编号的三角瓶中。2)用量筒各加入25ml蒸馏水溶解摇匀。3)分别加入2滴 0.1% 酚酞指示剂。4)准备好碱式滴定管(装入已配好的NaOH溶液)。5)用NaOH溶液滴定至粉红色,30秒不褪色为终点。6)准确记录消耗NaOH溶液的体积。7)计算出NaOH溶液的准确浓度。
CNaOH = WKHP × 1000 M
KHP × VNaOH
2、用已知准确浓度的NaOH溶液标定0.1mol / LHCl溶液。 准备:洗涤所用仪器
1)用移液管分别移取25ml HCl溶液置于三角瓶中。 2)分别加入2滴 0.1% 酚酞指示剂。4)准备好碱式滴定管(装入已知准确浓度的NaOH溶液)。3)用NaOH溶液滴定至粉红色,30秒不褪色为终点。4)准确记录消耗NaOH溶液的体积。5)计算出HCl溶液的准确浓度。
CHCl ×VHCl = CNaOH ×VNaOH CHCl =CNaOH ×VNaOH
VHCl
3、0.1mol / L HCl溶液的标定(无水Na2CO3标定HCl溶液) 准备:洗涤所用仪器
1)在电子天平上准确称取3份无水Na2CO3 0.1~0.2g,分别置于已编号的三角瓶中。2)用量筒各加入25ml蒸馏水溶解。 3)分别加入约3滴甲基橙指示剂。4)准备好酸式滴定管(装入已配好的HCl溶液)。 5)用HCl溶液滴定至橙色, 30秒不褪色为滴定终点。 6)准确记录消耗HCl溶液的体积。7)计算出HCl溶液的准确浓度。
C NaHCl =2 m 2CO3
M Na2CO3 × VHCl /1000
4、用已知准确浓度的HCl溶液标定0.1mol / LNaOH溶液。 准备:洗涤所用仪器
1)用移液管分别移取25ml NaOH溶液置于三角瓶中。2)分别加入约3滴甲基
橙指示剂。4)准备好酸式滴定管(装入已知准确浓度的HCl溶液)。3)用NaOH
溶液滴定至橙色,30秒不褪色为终点。 4)准确记录消耗溶液HCl的体积。5)计算出NaOH溶液的准确浓度。
CNaOH ×VNaOH = CHCl ×VHCl
CCHCL?VHCL
NaOH?
V
NaOH
实验五、食醋总酸量的测定
一、实验目的:
1、掌握食醋中总酸量的测定方法。
2、掌握容量瓶、移液管及滴定管的准备和使用方法。 二、实验原理:
先用间接法配制好NaOH溶液;可选用基准物KHP(固体),以0.1%酚酞作为指示剂进行标定NaOH标准溶液的浓度。
KHP + NaOH === KNaP + H2O
食醋的主要成分是醋酸,此外还含有少量其它的弱酸等,以0.1%酚酞作指示剂,用NaOH标准溶液滴定,可测出酸的总量,其反应为:
HAc + NaOH=== NaAc + H2O
食醋与碱的反应,近似地认为醋酸与碱的反应。 三、仪器和试剂 仪器:
试剂:
四、实验步骤:
1、配制250ml 0.1mol / L NaOH溶液
2、0.1mol / L NaOH溶液的标定(KHP标定NaOH溶液)
记录:
m1 = m2 = mV1 = V2 = V计算:
CNaOH =
3、食醋总酸量的测定
记录:
V1 = V2 = VCMHAc
计算: HAc%(w/v)?
NaOHVNaOH?
?100
10?
25250
3 = 3 =
3 =
第二篇:实验内容 用Na2CO3为基准物标定HCl标准溶液
一、实验内容 用Na2CO3为基准物标定HCl标准溶液。 二、准备工作 1. 准备40只称量瓶,内装干燥的基准试剂Na2CO3 1.5g。 2. 0.1%甲基橙指示剂:1g甲基橙溶解于1000ml热水中。 三、提问内容 1. 用Na2CO3标定HCl,应采用什么指示剂?为什么? 2. Na2CO3应该如何预先处理?为什么? 3. 溶解基准物Na2CO3所加蒸馏水的容积是否要准确?为什么? 4. 如何计算Na2CO3的称取量? 四、讲解要点 1. 为什么用Na2CO3标定HCl? (l)Na2CO3作为基准物,具有纯净,不吸湿,化学性质稳定等优点,且分子量大,可减小称量误差。 (2)由于所标定的HCl标准溶液将用来测定混合碱,即Na2CO3与NaOH的混合物,因此标定与测定条件一致,可减小测定误差。 2. 如何计算Na2CO3的称取量? (1)由于滴定管读数误差每次±0.01ml,读两次为±0.02ml。 以20ml计,滴定管读数引起的相对误差= ×100%=±0.1% 刚符合定量分析相对误差≤1‰的要求。 以40ml计,相对误差= ×100%=±0.05% 所以,标准溶液以消耗20~40ml为宜。 (2)HCl消耗量以20ml计,Na2CO3的称取量m1为 ×1000=0.25×20 所以m1=0.26g HCl消耗量以40ml计,Na2CO3的称取量m2为 ×1000=0.25×40 所以m2=0.52g 所以Na2CO3称取量以0.26~0.52g为宜。 3. 实验中应注意的问题 (1)溶解Na2CO3基准物要注意: a. 称取的Na2CO3分别装于已编号的三个锥形瓶中。 b. 溶解Na2CO3时,不能用玻璃棒伸进去搅拌。 c. 要等Na2CO3完全溶解后再加甲基橙指示剂。 (2)滴定一个样品加一个指示剂,不允许几个锥形瓶一起加指示剂。 (3)溶液由黄色变为橙色即为终点。 (4)精密度≤2‰。 4. HCl浓度的计算 CHCl= 将所得HCl浓度填写在试剂瓶的标签纸上。 五、评分标准: ≤2‰,及格。 >2‰,不及格
实验六 盐酸标准溶液的配制与标定
1、实验原理
市售盐酸为无色透明的HCl水溶液,HCl含量为36%~38%(W/W),相对密度约为1.18。由于浓盐酸易挥发出HCl气体,若直接配制准确度差,因此配制盐酸标准溶液时需用间接配制法。
标定盐酸的基准物质常用碳酸钠和硼砂等,本实验采用无水碳酸钠为基准物质,以甲基红-溴甲酚绿混合指示剂指示终点,终点褪色又绿变暗紫色。
用Na2CO3标定时反应为:
2HCl + Na2CO3 → 2NaCl + H2O + CO2 ↑
反应本身由于产生H2CO3会使滴定突跃不明显,致使指示剂颜色变化不够敏锐,因此,接近滴定终点之前,最好把溶液加热煮沸,并摇动以赶走CO2,冷却后再滴定。
2、实验步骤
(1)0.1mol·L-1盐酸溶液的配制
用小量筒取浓盐酸3.6ml,加水稀释至400ml混匀即得。
(2)标定
取在270~300℃干燥至恒重的基准无水碳酸钠约0.12~0.14g,精密称定3份,分别置于250ml锥形瓶中,加50ml蒸馏水溶解后,加甲基红-溴甲酚绿混合指示剂10滴,用盐酸溶液(0.1mol·L-1)滴定至溶液又绿变紫红色,煮沸约2min。冷却至室温(或旋摇2min)继续滴定至暗紫色,记下所消耗的标准溶液的体积。
3、实验结果
(1)数据记录
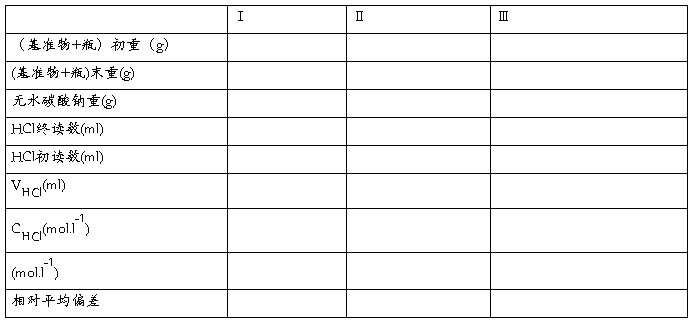
(2)结果计算
CHCl =
M = 105.99
4、注意事项
(1)无水碳酸钠经过高温烘烤后,极易吸水,故称量瓶一定要盖严;称量时,动作要快些,以免无水碳酸钠吸水。
(2)实验中所用锥形瓶不需要烘干,加入蒸馏水的量不需要准确。
(3)Na2CO3在270~300℃加热干燥,目的是除去其中的水分及少量NaHCO3。但若温度超过300℃则部分Na2CO3分解为NaO和CO2。加热过程中(可在沙浴中进行),要翻动几次,使受热均匀。
(4)近终点时,由于形成H2CO3-NaHCO3缓冲溶液,pH变化不大,终点不敏锐,故需要加热或煮沸溶液。
5、思考题
(1)为什么不能用直接法配制盐酸标准溶液?
(2)实验中所用锥形瓶是否需要烘干?加入蒸馏水的量是否需要准确?
二、
-
实验报告_酸碱标准溶液的配制和标定
大学化学实验实验一酸碱标准溶液的配制和标定实验目的1掌握标准溶液的配制方法2掌握滴定法定量测定溶液浓度的原理熟悉滴定管移液管的准备…
-
化学实验报告 实验__氢氧化钠标准溶液的配制与标定1
实验报告姓名班级同组人自评成绩项目氢氧化钠标准溶液的配制与标定课程学号一实验目的1掌握氢氧化钠溶液的配制和标定方法2熟悉滴定操作和…
-
EDTA标准溶液的配制与标定实验报告
EDTA标准溶液的配制与标定EDTA标准溶液的配制与标定一实验目的1掌握EDTA标准溶液的配制与标定方法2掌握铬黑T指示剂的应用条…
-
实验5 盐酸标准溶液的配制和标定
实验五盐酸标准溶液的配制和标定一实验目的1掌握减量法准确称取基准物的方法2掌握滴定操作并学会正确判断滴定终点的方法3学会配制和标定…
-
EDTA标准溶液的标定和水的硬度测定(实验报告)
EDTA标准溶液的标定和水的硬度测定四川农业大学生命科学与理学院625014应用化学092王雨20xx6824摘要本实验利用络合滴…
-
实验报告_酸碱标准溶液的配制和标定
大学化学实验实验一酸碱标准溶液的配制和标定实验目的1掌握标准溶液的配制方法2掌握滴定法定量测定溶液浓度的原理熟悉滴定管移液管的准备…
-
化学实验报告——盐酸溶液的标定
化学实验报告无机及分析化学题目盐酸溶液的标定学院班级姓名学号指导老师年月日制时间盐酸浓度的标定一实验目的1练习酸碱标准溶液的标定方…
-
实验二 酸碱标准溶液的配制和浓度比较
实验二酸碱标准溶液的配制和浓度比较一实验目的1巩固滴定管的使用学习移液管的使用方法2掌握NaOHHCI标准溶液的配制浓度的比较滴定…
-
实验三 酸碱标准溶液的配制和标定
基础化学实验教案一授课计划1基础化学实验教案二课时教学内容2基础化学实验教案3基础化学实验教案4基础化学实验教案5基础化学实验教案…
-
实验 酸碱标准溶液的配制和标定
酸碱标准溶液的配制和标定20xx1213化学化工系11化工与制药2班蒋晓濛手机号150xxxxxxxx一实验目的1掌握NaOHHC…
-
EDTA标准溶液的标定和水的硬度测定(实验报告)
EDTA标准溶液的标定和水的硬度测定四川农业大学生命科学与理学院625014应用化学092王雨20xx6824摘要本实验利用络合滴…