实验3 氢氧化钠标准溶液的标定(总结)
实验3 氢氧化钠标准溶液的标定(总结报告)
1. 实验目的
①用基准邻苯二甲酸氢钾标定NaOH标准溶液;
②熟练掌握煤气灯、洗瓶、容量瓶及移液管的使用,溶液的转移和定容,分析天平的使用及减量法称量操作。
2. 实验原理
①可以用基准邻苯二甲酸,氢钾或基准草酸标定NaOH标准溶液,邻苯二甲酸氢钾的摩尔质量大于草酸称量的相对误差较小,被更多的使用; ②减量法的称量方法:先将供试品放于称量瓶中,置于天平盘上,称得重量。然后取出所需的供试品量,再称得剩余供试品和称量瓶,两次称量之差,即为供试品的重量。
3. 实验步骤
①基准邻苯二甲酸氢钾的称量及溶液的配制:用分析天平准确称取2~3g基准邻苯二甲酸氢钾(准至0.0001,下同),置于150mL小烧杯,加约50mL蒸馏水,小火加热,冷却后转移至250mL容量瓶,定容;
②NaOH标准溶液的标定:用移液管移取上述邻苯二甲酸氢钾溶液50mL至250mL锥形瓶,加1~2滴酚酞指示剂,用0.1mol/L NaOH标准溶液滴定。平行实验3~4次,直至消耗的NaOH标准溶液体积的偏差小于0.02mL;
③计算NaOH标准溶液浓度。
4. 实验数据及结果记录(见附表) 5. 实验总结及误差分析
①移液管使用不规范:将移液管直立,接受器倾斜,管下端紧靠接受器内壁,放开食指,让溶液沿接受器内壁流下,管内溶液流完后,保持放液状态15s,将移液管尖端在接受器靠点处靠壁前后小距离滑动几下;②试剂瓶中溶液未摇匀。
第二篇:实验三_氢氧化钠浓度标准溶液的配制和标定(发给学生)
实验三氢氧化钠标准溶液的配制和标定
实验日期20##、9、20
一、实验目的:
1、学习碱式滴定管的使用;
2、掌握滴定操作并学会正确判断终点;
3、学会配制和标定碱标准溶液的方法。
二、实验原理:
思考:
1.为什么氢氧化钠不能直接配成标准溶液?
2.如何配制氢氧化钠标准溶液?
3.有哪些标准物质可以标定氢氧化钠溶液的浓度?
1)邻苯二甲酸氢钾,反应式如下:KHC8H4O4+NaOH=KNaC8H4O4+H2O
2)草酸,反应式为: H2C2O4+2NaOH=Na2C2O4+2H2O
指示剂:酚酞(pH值为突跃范围为7.7~10)
3) 已知准确浓度的HCl,计量点时溶液呈中性,突跃范围:4~10,MO、MR
4 .如何计算氢氧化钠标准溶液的浓度?
三、实验步骤
1、0.1 mol?L-1 NaOH溶液的配制:
用台秤迅速称取约1.25g NaOH(为什么?) 于100mL小烧杯中,加约30mL无CO2的去离子水溶解,然后转移至试剂瓶中,用去离子水稀释至300mL,摇匀后,用橡皮塞塞紧。贴好标签,备用。
讨论:怎样称量氢氧化钠固体?
(1)NaOH应放在表面皿或小烧杯中进行,不能在称量纸上称。
(2)NaOH在烧杯内溶解,充分搅拌,溶解完全后,转移至试剂瓶内,稀释至所要体积。塞上橡皮塞,充分摇匀。
思考:如何配制不含CO32-的NaOH溶液?
方法(1).用小烧杯于台秤上称取较理论计算量稍多的NaOH,用不含CO2蒸馏水迅速冲洗两次,溶解并定溶。
(2).制备饱和NaOH(50%, Na2CO3基本不溶)待Na2CO3下沉后,取上层清液用不含CO2的蒸馏水稀释.
(3).于NaOH溶液中,加少量Ba(OH)2或BaCI2,取上层清液用不含CO2的蒸馏水稀释.
2、0.1 mol?L-1 NaOH 溶液的标定(平行三份):
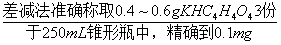 →→
→→ →→
→→ →→
→→ →→
→→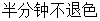 →→
→→ 。
。
四、注意事项:
1、KHC8H4O4溶解较慢,要溶解完全后,才能滴定。
2、近终点要慢滴多摇,要求加半滴到微红色并保持半分钟不褪色
基本操作:碱式滴定管的使用
3、体积读数要读至小数点后两位
仔细看录像中的以下内容:
(1)碱管下端乳胶管和玻璃珠部分的配合,如何洗涤。
(2)如何检查乳胶管内有否气泡。
(3)乳胶管内和未端玻璃管内气泡的排除。
(4)在滴定过程中,如何避免末端带入气泡?
(5)如何挤压玻璃珠,以及挤压的部位。
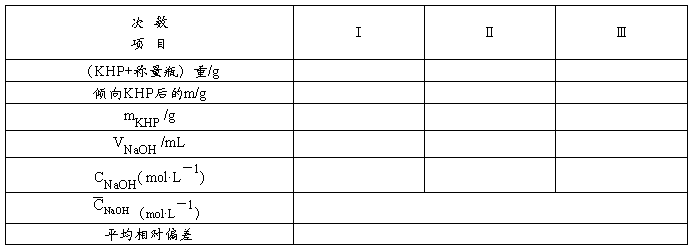
五、数据处理NaOH溶液的标定
六、思考题
1、称取NaOH及邻苯二甲酸氢钾各用什么天平?为什么?
答:称取NaOH用台秤.因为是粗配NaOH;称取邻苯二甲酸氢钾用分析天平,因为需要准确称量, 且称样量小。
2、HCI和NaOH溶液能直接配制准确浓度吗?为什么?
答:不能,因浓HCI易挥发,浓度不确定; NaOH易吸收空气中的CO2和水分。
3、在滴定分析实验中,滴定管和移液管为何需用滴定剂和待移取的溶液润洗几次?锥形瓶是否也要用滴定剂润洗?
答:(1) 防止待移取的溶液浓度被稀释;
(2) 不能,相当于多加了滴定剂,在滴定之前,这部分滴定剂已和待测物质发生了反应,影响分析结果的准确度。
4、HCI和NaOH溶液定量反应完全后,生成NaCI和水,为什么用HCI滴定NaOH时,采用甲基橙指示剂,而用NaOH滴定HCI时,使用酚酞或其它合适的指示剂?
答:因为用HCI NaOH 指示剂:甲基橙 黄
NaOH 指示剂:甲基橙 黄 橙
橙
突跃范围PH=4..3-9.7 PH=4.4 4.0
摇动锥形瓶中的NaOH时, CO2影响大(PH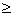 5时),用甲基橙可有效消除 CO2的影响.用酚酞指示剂,会多消耗NaOH,产生较大误差。
5时),用甲基橙可有效消除 CO2的影响.用酚酞指示剂,会多消耗NaOH,产生较大误差。
用NaOH  HCI, CO2影响小(滴定管液面与空气接触少),指示剂:酚酞由无色
HCI, CO2影响小(滴定管液面与空气接触少),指示剂:酚酞由无色 红色,易观察;而甲基橙,由红色
红色,易观察;而甲基橙,由红色 黄色,难观察。
黄色,难观察。
5、溶解基准物质时加入20~30ml水,是用量筒量取,还是用移液管移取?为什么?
答:因为这时所加的水只是溶解基准物质,而不会影响基准物质的量,因此加入的水不需要非常准确,所以可以用量筒量取。
-
化学实验报告 实验__氢氧化钠标准溶液的配制与标定1
实验报告姓名班级同组人自评成绩项目氢氧化钠标准溶液的配制与标定课程学号一实验目的1掌握氢氧化钠溶液的配制和标定方法2熟悉滴定操作和…
-
氢氧化钠溶液浓度的标定 实验报告
实验报告姓名班级同组人项目氢氧化钠溶液浓度的标定课程分析化学学号一实验目的1学会称量瓶电子天平滴定管等常用滴定仪器的准备和使用方法…
-
实验 氢氧化钠标准溶液的配制与标定
实验氢氧化钠标准溶液的配制与标定一实验目的1掌握氢氧化钠滴定液的配制和标定方法2巩固用递减法称量固体物质3熟悉滴定操作并掌握滴定终…
-
实验3 氢氧化钠标准溶液的标定(总结)
实验3氢氧化钠标准溶液的标定总结报告1实验目的用基准邻苯二甲酸氢钾标定NaOH标准溶液熟练掌握煤气灯洗瓶容量瓶及移液管的使用溶液的…
-
盐酸和氢氧化钠标准溶液浓度的标定实验报告
盐酸和氢氧化钠标准溶液浓度的标定实验报告一实验目的1掌握NaOH标准溶液的标定方法2了解基准物质邻苯二甲酸氢钾的性质及应用3进一步…
-
实验报告_酸碱标准溶液的配制和标定
大学化学实验实验一酸碱标准溶液的配制和标定实验目的1掌握标准溶液的配制方法2掌握滴定法定量测定溶液浓度的原理熟悉滴定管移液管的准备…
-
化学实验报告 实验__氢氧化钠标准溶液的配制与标定1
实验报告姓名班级同组人自评成绩项目氢氧化钠标准溶液的配制与标定课程学号一实验目的1掌握氢氧化钠溶液的配制和标定方法2熟悉滴定操作和…
-
硫代硫酸钠标准溶液的配制与标定实验
实验八硫代硫酸钠标准溶液的配制与标定一试验目的1掌握硫代硫酸钠标准溶液的配制与标定方法2掌握碘量法的原理及测定条件二原理硫代硫酸钠…
-
氢氧化钠溶液浓度的标定 实验报告
实验报告姓名班级同组人项目氢氧化钠溶液浓度的标定课程分析化学学号一实验目的1学会称量瓶电子天平滴定管等常用滴定仪器的准备和使用方法…
-
盐酸和氢氧化钠标准溶液浓度的标定实验报告
盐酸和氢氧化钠标准溶液浓度的标定实验报告一实验目的1掌握NaOH标准溶液的标定方法2了解基准物质邻苯二甲酸氢钾的性质及应用3进一步…