酪蛋白的制备----生化实验
酪蛋白的制备
一、目的
1、学习从牛奶中制备酪蛋白的原理和方法。
2、掌握等电点沉淀法提取蛋白质的方法。
二、原理
牛乳中的主要的蛋白质是酪蛋白,含量约为35g/L。酪蛋白是一些含磷蛋白质的混合物,等电点为4.7。利用等电点时溶解度最低的原理,将牛乳的pH调至4.7时,酪蛋白就沉淀出来。用乙醇洗涤沉淀物,除去脂类杂质后便可得到纯酪蛋白。
三、材料、试剂与器具
(一)材料
新鲜牛奶
(一)试剂
1、95%乙醇 1 200mL
2、无水乙醚 1 200mL 3、0.2mol/L pH4.7醋酸——醋酸钠缓冲液 300ml 先配A液与B液
A液:0.2mol/L醋酸钠溶液 称NaAC·3H2O 54.44g,定容至2000ml。 B液:0.2mol/L醋酸溶液,称优 纯醋酸(含量大于99.8%)12.0g定容至1000ml。
取A液1770ml,B液1230ml混合即得Ph4.7的醋酸——醋酸钠缓冲液3000ml。
4、乙醇——乙醚混合液
乙醇:乙醚=1 :1(V/V)
(二)器具
1、离心机 2、抽滤装置
3、精密pH试纸或酸度计 4、 电炉
5、烧杯 6、温度计
四、操作步骤
(一)酪蛋白的粗提
100mL牛奶加热至40℃。在搅拌下慢慢加入预热至40℃、pH4.7的醋酸缓冲液100mL.用精密pH试纸或酸度计调pH至4.7。
将上述悬浮液冷却至室温。离心15分钟(3000 r /min)。弃去清液,得酪蛋白粗制品。
(二)酪蛋白的纯化
1、用水洗涤沉淀 3次,离心10分钟(3 000r/min),弃去上清液。
2、在沉淀中加入30mL乙醇,搅拌片刻,将全部悬浊液转移至布氏漏斗中抽滤。用乙醇—乙醚混合液洗沉淀2次。最后用乙醚洗沉淀2次,抽干。
3、将沉淀摊开在表面 上,风干;得酪蛋白纯品。
(三)准确称重,计算含量和得率。
含量:酪蛋白g/100 mL牛乳(g%)
式中理论含量为3.5g/100mL牛乳。
五、注意事项
1、由于本法是应用等电点沉淀法来制备蛋白质,故调节牛奶液的等电点一定要准确。最好用酸度计测定。
2、精制过程用乙醚是挥发性、有毒的有机溶剂,最好在通风橱内操作。
3、目前市面上出售的牛奶是经加工的奶制品,不是纯净牛奶,所以计算时应按产品的相应指标计算。
六、实验报告
1、根据实际操作,以流程图形式总结酪蛋的制备方法。
2、合理分析实验所得率
七、思考题
1、制备高产率纯酪蛋白的关键是什么?
2、试设计另一种提取酪蛋白的方法?
第二篇:生化实验

小牛肠碱性磷酸酶的提取及酶活测定
考马斯亮蓝法测定蛋白质含量
SDS-聚丙烯酰胺凝胶电泳测定蛋白质相对分子质量
郭彦斌
化工与环境生命学部高分子材料与工程1101班
摘要 碱性磷酸酶是一种非特异性的水解酶,广泛存在于动物各脏器、微生物和植物中。本实验主要介绍小牛肠来源的AKP的分离和活性测定方法。小牛肠碱性磷酸酶相对分子质量为145000,等电点5.7。在体外可催化底物对硝基苯磷酸二钠生成对硝基苯酚,后者在405nm光波下有最大吸收,通过测定吸光值的变化率,即可测定碱性磷酸酶的活力。酶活定义:在37度条件下,以每分钟催化水解1umol底物的酶量为一个酶活力单位。
考马斯亮蓝G-250测定蛋白质含量属于燃料结合法的一种。考马斯亮蓝G-250在酸性溶液中的游离状态呈红褐色,当它与蛋白质结合后变为蓝色。蛋白质-色素结合物在595nm波长下的光吸收与蛋白质含量成正比,故可用于蛋白质的定量分析。蛋白质和考马斯亮蓝G-2502结合2min左右达到平衡,完全反应十分迅速,其结合物在室温下1h内保持稳定。该反应非常灵敏,可测微克级蛋白质含量,所以是一种常用的蛋白质快速微量测定法。
电泳可用于分离复杂的蛋白质混合物。在聚丙烯酰胺凝胶电泳中,凝胶的孔径,蛋白质的电荷、大小、性质等因素共同决定了蛋白质的电泳移率。如果加入某种试剂使电荷因素消除,则电泳迁移率就取决于分子的大小,就可以用电泳技术测定蛋白质的相对分子质量。SDS-聚丙烯酰胺凝胶电泳大多在不连续系统中进行,其电泳漕缓冲液的pH与离子强度不同于配胶缓冲液。该胶包括浓缩胶和分离胶两部分。
关键词 小牛肠碱性磷酸酶、酶活力、考马斯亮蓝G-250、蛋白质微量测定、电泳。
本实验共包括3个实验,从新鲜的小牛肠内提取小牛肠碱性磷酸酶,用紫外分光光度计进行酶活分析并通过考马斯亮蓝法测定蛋白质含量,以及利用SDS-聚丙烯酰胺凝胶电泳测定出蛋白质样品以及marker样品的电泳图样,参考用低分子量标准蛋白质所做的标准曲线、低分子量标准蛋白的组成表来确定未知蛋白质样品的相对分子质量。
1 实验部分
1.1 试剂与仪器
1.1.1小牛肠碱性磷酸酶的提取及酶活测定
①试剂
正丁醇、丙酮(置-20℃冰箱保存)。
1mol/L醋酸(HAc),1mol/L NaOH,硫酸铵。
平衡缓冲液:0.01mol/L Tris-HCl,pH 8.0,(含1.0×mol/L Mg和1.0×mol/L Zn)。
底物缓冲液:1mol/L二乙醇胺-盐酸缓冲液(pH 9.8,含0.5×mol/L Mg)。
酶的底物溶液:用底物缓冲液配制15×mol/L 对硝基苯磷酸二钠溶液。(已加入到底物缓冲液中)。 ②仪器
匀浆机、冷冻离心机、恒温水浴、紫外可见分光光度计。离心管、剪刀、载玻片、不锈钢盘、搪瓷盘、滤布、分液漏斗、量筒、烧杯、移液枪、比色皿。
1.1.2 考马斯亮蓝法测定蛋白质含量
①试剂
实验1中提取出的酶液、考马斯亮蓝。
②仪器
分光光度计、分析天平、玻璃比色皿、试管及试管架、移液管(0.1ml及0.5ml)。
1.1.3 SDS-聚丙烯酰胺凝胶电泳测定蛋白质相对分子质量
①试剂
30%丙烯酰胺(Acr)置棕色瓶。
分离胶缓冲液:1.5 mol/L Tris-HCl缓冲液,pH 8.8,已加入10%SDS。
浓缩胶缓冲液:0.5 mol/L Tris-HCl缓冲液,pH 6.8,已加入10%SDS。
0%过硫酸铵(AP): 提供驱动丙烯酰胺和双丙烯酰胺的聚合所必需的自由基,须新鲜配置。 TEMED(四甲基乙二胺): 通过催化过硫酸铵形成自由基而加速丙烯酰胺和双丙烯酰胺的聚合。 上样缓冲:称100mgSDS、2mg溴酚蓝、2g甘油,加0.1ml巯基乙醇、2ml 0.05 mol/L pH 8.0 Tris-HCl, 加纯水定容至10ml。
染色液:配置含0.1%考马斯亮蓝R250,40%(体积分数)甲醇和10%(体积分数)冰醋酸的染色液500ml,过滤后备用。
脱色液:500ml 10%(体积分数)甲醇和10%(体积分数)冰醋酸的脱色液1000ml。
电泳缓冲液(含0.1%SDS,0.05 mol/L Tris,0.384 mol/L 甘氨酸 pH 8.3)。
②仪器
电泳仪、电泳槽、制胶板、摇床、移液枪。
1.2 实验过程
1.2.1 小牛肠碱性磷酸酶的提取及酶活测定
酶的提取
1) 取新鲜小牛肠,用剪刀纵向剖开,用载玻片刮取小肠内粘膜,放到盘子一角。
2) 统一将小肠粘膜液集中倒入匀浆机中,加1.5倍体积冰冷蒸馏水,告诉匀浆15s,重复20次。
3) 缓慢加入1体积的冰冷正丁醇,高速匀浆15s,重复20次。
4) 每组领取60mL的匀浆液,放入离心管中,用另一离心管用水配平,在4℃条件下,1000rpm,离心15min。
5) 用滤布过滤去除杂质,倒入分液漏斗中,静置分层,取水相,用1mol/LHAc调pH到4.9。4℃,1000rpm,离心15min。
6) 得到上清33.5mL,放入离心管中,调pH至6.5,称取1.6815g硫酸铵,加到离心管中溶解,再加15.7mL冰冷丙酮,混匀,4℃,静置30min以上。
7) 4℃,1000rpm,离心10min。
8) 上清液48.0mL中加入51.0mL冰冷丙酮,4℃,静置30min以上。
9) 4℃,1000rpm,离心10min。
10) 取沉淀溶于1.4mL平衡缓冲液至全部溶解。至冰箱保存待用。
底物处理
底物(对硝基苯磷酸二钠已溶于平衡缓冲液中)37℃水浴5min。
酶活检测
1) 将酶稀释10倍
2) 设置紫外分光光度计检测条件:405nm波长,测定时间60s,记录范围0.0-1.5。
3) 取2个2mL比色皿(0.5cm光程),加入1.5mL上述加热的底物缓冲液,校对归零。
4) 将稀释10倍的酶液20μL加到一个比色皿中,用手堵住皿口。快速上下倒两次,放回分光光度计中,测定酶动力学曲线。
1.2.2 考马斯亮蓝法测定蛋白质含量
1) 玻璃管中加入5mL考马斯亮蓝
2) 在1.5mL离心管中,配置稀释50、100、200倍的酶溶液。
3) 取100μL稀释后的酶液加入到5mL考马斯亮蓝试管中,混匀,反应5min以上。
4) 设置紫外光分光分度计检测条件:595nm波长
5) 取2个2mL比色皿(1cm光程),加入考马斯亮蓝,校对归零。
6) 将样品放入外侧比色皿中,读吸光值
7) 根据蛋白浓度标准曲线,计算酶蛋白浓度。
1.2.3 SDS-聚丙烯酰胺凝胶电泳测定蛋白质相对分子质量
1) 装板:将垂直板型电泳的玻璃片洗净、晾干:放好胶条(棱朝上,平铺),用夹子夹好玻璃板,上面插上梳子,垂直放置在水平台面上备用。
2) 制备分离胶:在小烧杯中配制所需浓度的分离胶。
分离胶制备(浓度10%,制备量10 mL)
试剂 用量
H2O 4.1 mL
3.4 mL 30% 丙烯酰胺
2.4 mL 1.5 mol/L Tris-HCl缓冲液pH 8.8
100 μL 10% 过硫酸铵
TEMED 10 μL
注意:最后加入TEMED,应快速摇匀分离胶,向玻璃板间隙,沿着长玻璃板的内侧缓缓注胶,然后再用移液枪贴壁慢慢移动注入乙醇200uL,以防止氧气进入胶内。10-15min后,分离胶和乙醇之间出现分界线,表明分离胶凝固,倒出乙醇。
3) 制备浓缩胶:在小烧杯中配制所需浓度的浓缩胶。
分离胶制备(浓度10%,制备量10 mL)
试剂 用量
H2O 4.1 mL
3.4 mL 30% 丙烯酰胺
2.4 mL 1.5 mol/L Tris-HCl缓冲液pH 8.8
100 μL 10% 过硫酸铵
TEMED 10 μL
注意:一旦加入TEMED,应快速摇匀浓缩胶,在已凝固的分离胶层上加浓缩胶,立即将梳子插入胶液顶部,避免进入气泡,放置约20min,待浓缩胶凝固。
4) 蛋白样品处理:在1.5mL离心管中按1:1体积比例,加样品和上样缓冲液,100度加热3min使蛋白变性。
5) 浓缩胶完全聚合后,去掉夹子和胶条,拔去梳子,将凝胶玻璃板固定于电泳装置内槽上,加入
电泳缓冲液(内、外槽,查漏),缓冲液高过玻璃板凹面。
6) 用移液枪依次在泳道加样(两侧分别上样20和40uL)。(注意:将marker置于中间泳道)
7) 电泳:链接正、负极,打开电源,开始时,电流控制在40A,样品进入分离胶后,缓慢升高电压至140V或电流50-60A。保持电压或电流强度不变。待溴酚兰指示剂迁移至下沿处,停止电泳,需1.5h左右。
8) 剥胶染色:电泳结束后,取出凝胶玻璃板,用水冲洗,用金属片从玻璃两侧轻轻撬开,使板内进入空气,同时用水冲洗,取出凝胶板。将剥离下来的凝胶用水漂洗,转入染色缸中,加染色液,置摇床染色15min。
9) 脱色:染色完毕,回收染色液,用水漂洗,加入脱色液,置摇床脱色,30min换1次脱色液,脱色至背景清晰。
10) 观察测定蛋白的迁移率及条带,对照标准样品,分析蛋白样品的分子量及纯度。
11) 拍照电泳结果,用于完成实验报告。
2 结果与讨论
2.1 实验结果
2.1.1 考马斯亮蓝法测定蛋白质含量
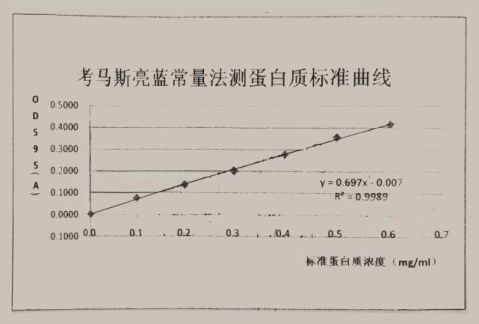
图1.考马斯亮蓝常量法测蛋白质标准曲线
根据考马斯亮蓝常量法测蛋白质标准曲线,其方程为:y=0.697x-0.007。
蛋白质稀释50倍的情况下测得吸光值为0.2115A,根据方程,稀释50倍时蛋白质浓度C=0.3135mg/ml,则原蛋白质浓度C=15.675 mg/ml。
2.1.2 酶活力的测定

图2.酶动力学曲线
酶活力(u/mg)=?A/min?VR?D E405?VE?C?L
由实验测得碱性磷酸酶的酶动力曲线如图2所示,在图上线性部分任取两点得:
ΔA/min=(0.475-0.175)×60/(45-15)=0.600
另外有VR=1.5ml; D=10; E405=18.3L/(mol*cm) VE=0.02ml C=15.675 mg/ml. L=0.5cm; 所以比活力(U/mg)=3.451U/mg;
2.1.3 SDS-聚丙烯酰胺凝胶电泳测定蛋白质相对分子质量
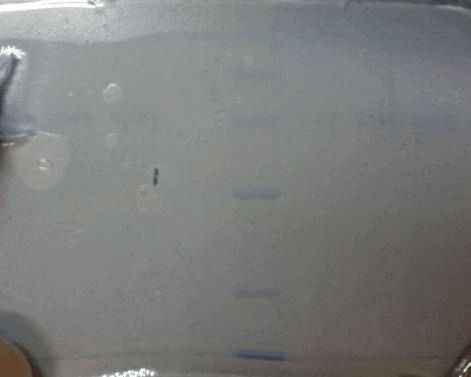
图3 电泳结果

图4.低分子量标准蛋白组成及迁移率
分析知,mark中出现了五条蛋白质标记线,根据其间距及参考文献中给出的mark泳道各条蛋白质标记线间距,可判定由上到下mark泳道中的六条蛋白质标记线分别是兔磷酸化酶B、牛血清白蛋白、兔肌动蛋白、牛碳酸酐酶、胰蛋白酶抑制剂。样品蛋白质标记线与牛血清白蛋白迁移率相近,所以样品的分子量与牛血清白蛋白分子量相近,所以样品的分子量大致为66200 g/mol。同时左侧上40uL样品的带宽要宽于右侧20ul的带宽。
2.2 实验讨论
2.2.1 关于小牛肠碱性磷酸酶的提纯及酶活测定实验中问题的讨论
测定底物浓度对酶反应速度的影响时,需要对酶反应的条件加以控制。在实验中要选去合适的底物和最适底物浓度;理想的缓冲液种类和最适离子强度;合适的pH和温度;测定时间。本实验酶浓度为在原来酶浓度的基础上稀释10倍、pH 8.0、温度为37℃、测定时间60 s。
在本实验中能以平均速度表示反应的瞬时速度。因为酶催化的反应速率与底物浓度有关,本实验中底物远远过量,所以可以以平均速度表示反应的瞬时速度。
2.2.2 考马斯亮蓝法测定蛋白质含量一些问题的讨论
考马斯亮蓝G-250在酸性溶液中的游离状态呈红褐色,最大吸收波长为465 nm, 与蛋白质结合后变成蓝色最大吸收波长为595 nm,且光吸收与蛋白质量成正比,故可用于蛋白质含量的定量分析。
2.2.3 SDS-PAGE电泳法测定蛋白质相对分子质量一些问题的讨论
用SDS-聚丙烯酰胺凝胶电泳法测定蛋白质相对分子质量时使用巯基乙醇是为了保持蛋白质的二级结构。蛋白中如果有二硫键存在的话,会容易被氧化断开,有了巯基乙醇(还原性的物质)就可以免除这一隐患。
在SDS-聚丙烯酰胺凝胶电泳中,加入一定量的十二烷基硫酸钠(SDS),形成蛋白质-SDS复合物,使蛋白质丧失了原有的电荷状态,形成了仅保持原有分子大小为特征的负离子团块,从而降低或消除了各种蛋白质分子之间的天然的电荷差异,此时,蛋白质分子的电泳迁移率主要取决于蛋白质的分子量大小,而其它因素对电泳迁移率的影响几乎可以忽略不计。根据标准样品在该系统电泳中所作出的标准曲线,推算出被测蛋白样品分子量的近似值。
实验心得:
这是我第一次做生化试验,也有可能是本科四年的唯一一次。和以往所做的化学实验不同,这个实验不用写预习报告稿,而且是由四人小组配合完成的,这就要求小组成员之间要分工明确,配合默契。同时,在实验过程中有可能有小组成员实验操作慢,不精确,这就要求我们要相互体谅,分享方法。
通过三个实验的学习,我了解了如何从新鲜的小牛肠中提取碱性磷酸酶、如何将紫外分光光度计应用于生化实验、考马斯亮蓝法是如何测定蛋白质含量的、SDS-聚丙烯酰胺凝胶电泳的原理又是什么以及其实如何测定蛋白质相对分子质量的。实验还需要注意时间的合理分配。电泳需要大概1.5小时,在电泳时可以进行其他实验,使实验进度加快。
总之,这是一次很有趣的经历,收获良多。在这里也要谢谢老师在实验中对于我们的指导,从而使得我们可以顺利地完成实验。
参考文献
[1]《生物化学》 修志龙 主编;化学工业出版社
[2]栾雨时, 包永明等 生物工程实验技术手册[M].化学工业出版社.2005
[3]许文涛等.SDS-聚丙烯酰胺凝胶电泳快速染脱色方法的比较研究.食品科学[J]. 2004,Vol.25.No.增
[4]孙士青等.考马斯亮蓝法快速测定乳品中蛋白质含量.山东科学[J].2011.24(6)
The calf intestinal alkaline phosphatase of extraction and determination of
enzyme activity
Coomassie brilliant blue method to determine protein content
SDS - polyacrylamide gel electrophoresis to determine protein relative
molecular mass Yanbin Guo
1101,Polymer materials and Engineering,Faculty of Chemical,Environmental and Biology Science and Technology
Abstract Alkaline phosphatase is a non-specific hydrolase, widely exists in animals each viscera, microorganisms and plants. This experiment mainly introduced the calf intestinal source separation of AKP and active method. The calf intestinal alkaline phosphatase relative molecular mass of 145000, isoelectric point 5.7. In vitro catalytic substrate p-nitrophenyl sodium dihydrogen phosphate generated on the nitro phenol, which have the largest absorption under 405 nm light waves, by measuring the rate of change of absorbance values, determining of alkaline phosphatase activity. Enzyme activity definition: under the condition of 37 degrees, per minute amount of enzyme catalytic hydrolysis of 1 umol substrates for one unit of enzyme activity.
Determination of coomassie brilliant blue G - 250 protein is a kind of combination with fuel. Coomassie brilliant blue G - 250 reddish brown in the free state of acid solution, when it is combined with protein into blue. Protein - pigment combination under 595 nm wavelength of light absorption is proportional to the protein content, so it can be used for quantitative analysis of protein. Protein and coomassie brilliant blue G - 2502 in combination with about 2 min to balance, completely responded very quickly, the combination is stable within 1 h at room temperature. The reaction is very sensitive, measurable micrograms of protein content, so it is a kind of commonly used protein rapid determination of trace method.
Electrophoresis can be used for the separation of complex protein mixture. In polyacrylamide gel electrophoresis, gel pore size, charge, size and nature of the protein and other factors determine the protein electrophoresis mobility. If join factors to eliminate some reagents to charge, the electrophoretic mobility is depends on the size of the molecule, can use to determine the relative molecular mass of protein
electrophoresis technology. SDS - polyacrylamide gel electrophoresis in discrete system mostly, its pH and ionic strength of the electrophoresis tank buffer is different from the rubber buffer. The plastic including plastic and the separation of glue.
Keywords The calf intestinal alkaline phosphatase, the determination of enzyme activity and coomassie brilliant blue G - 250, trace determination of protein, electrophoresis.
-
酪蛋白的制备英文实验报告
PreparationofcaseinIThepurposeandrequirements1Mastertousethecentrifuge2Mast…
-
酪蛋白的制备----生化实验
酪蛋白的制备一目的1学习从牛奶中制备酪蛋白的原理和方法2掌握等电点沉淀法提取蛋白质的方法二原理牛乳中的主要的蛋白质是酪蛋白含量约为…
-
实验报告-从牛奶中分离酪蛋白
实验报告一实验名称从牛奶中分离酪蛋白二实验目的1学习从胶体中提取某一类物质的方法2学习蛋白质的各种颜色反应及其原理三实验原理1蛋白…
-
实验 酪蛋白的制备
实验四酪蛋白的制备一实验目的1学习从牛奶中制备酪蛋白的原理和方法2掌握等电点沉淀法提取蛋白质的方法二实验原理牛乳中的主要的蛋白质是…
-
实验七 牛乳中酪蛋白的制备
实验七牛乳中酪蛋白的制备目的要求学习从牛乳中分离纯化酪蛋白的原理和方法实验原理牛乳中主要含有酪蛋白和乳清蛋白两种蛋白质其中酪蛋白占…
-
蛋白质的定量测定实验报告
显问题其次回顾全部过程的原理我们猜测可能存在的造成结果低的情况为在室温冷却后实验室没有空余的分光光度计排队时间应该是全部小组中最长…
-
蛋白酶的发酵及酶活力测定实验报告
蛋白酶的发酵及酶活力测定实验报告学院生物科学与工程学院专业生物技术班级1班姓名学号摘要蛋白酶是一类重要的工业用酶广泛应用于食品医药…
-
生化综合实验报告--测定蛋白质含量的三种方法及其比较
本科学生综合性实验报告学号姓名学院专业班级实验课程名称测定蛋白质含量的三种方法及其比较教师及职称开课学期月云南师范大学教务处编印一…
-
酪蛋白的制备英文实验报告
PreparationofcaseinIThepurposeandrequirements1Mastertousethecentrifuge2Mast…
-
实验报告-从牛奶中分离酪蛋白
实验报告一实验名称从牛奶中分离酪蛋白二实验目的1学习从胶体中提取某一类物质的方法2学习蛋白质的各种颜色反应及其原理三实验原理1蛋白…