光催化降解甲基橙实验报告
光催化降解染料甲基橙
一、目的要求
1、 掌握确定反应级数的原理和方法;
2、 测定甲基橙光催化降解反应速率常数和半衰期;
3、 了解可见光分光光度计的构造、工作原理、掌握分光光度计的使用方法。
二、实验原理
光催化始于1972年,Fujishima和Honda发现光照的TiO2单晶电极能分解水,引起人们对光诱导氧化还原反应的兴趣,由此推动了有机物和无机物光氧化还原反应的研究。
1976年,Cary等报道,在近紫外光照射下,曝气悬浮液,浓度为50μg/L 的多氯联苯经半小时的光反应,多氯联苯脱氯,这个特性引起了环境研究工作者的极大兴趣,光催化消除污染物的亚牛日趋活跃。国内外大量研究表明,光催化法能有效地将烃类、卤代有机物、表面活性剂、染料、农药、酚类、芳烃类等有机污染物降解,最终无机化为CO2 H2O,而污染物中含有的卤原子、硫原子、磷原子和氮原子等则分别转化为X-,SO42-,PO43-,PO43-,NH4+,NO3-等离子。因此,光催化技术具有在常温常压下进行,彻底消除有机污染物,无二次污染等优点。
光催化技术的研究涉及到原子物理、凝聚态物理、胶体化学、化学反应动力学、催化材料、光化学和环境化学等多个学科,因此多相光催化科技是集这些学科于一体的多种学科交叉汇合而成的一门新兴的科学。
光催化以半导体如TiO2,ZnO,CdS,Fe2O3,WO3,SnO2,ZnS,SrTiO3,CdSe,CdTe,In2O3,FeS2,GaAs,GaP,SiC,MoS2等作催化剂,其中TiO2具有价廉无毒、化学及物理稳定性好、耐光腐蚀、催化活性好等优点,帮TiO2是目前广泛研究、效果较好的光催化剂。
半导体之所以能作为催化剂,是由其自身的光电特性所决定的。半导体粒子含有能带结构,通常情况下是由一个充满电子的低能价带和一个空的高能导带构成,它们之前由禁带分开。研究证明,当pH=1时锐钛矿型TiO2的禁带宽度为3.2eV,半导体的光吸收阈值λg与禁带宽度Eg的关系为
λg(nm)=1240/Eg(eV)
当用能量等于或大于禁带宽度的光(λ<388nm的近紫外光)照射半导体光催化剂时,半导体价带上的电子吸收光能被激发到导带上,因而在导带上产生带负电的高活性光生电子(e-),在价带上产生带正电的光生空穴(h+),形成光生电子-空穴对。空穴的能量(TiO2)为7.5 eV,具有强氧化性;电子则具有强还原性。
当光生电子和空穴到达表面时,可发生两类反应。第一类是简单的复合,如果光生电子与空穴没有被利用,则会重新复合,使光能以热能的形式散发掉
e - + h+ →N + energy (hv’< hv or heat)
第二类是发生一系列光催化氧化还原反应,还原和氧化吸附在光催化剂表面上物质。
TiO2 →e- + h+
OH- + h+ →·OH
H2O + h+ →·OH+H+
A + h+→·A
另一方面,光生电子可以和溶液中溶解的氧分子反应生成超氧自由基,它与H+离子结合形成.OOH自由基:
O2 + e- + H+→·O2-+H+→·OOH
2HOO·→ O2 + H2O2
H2O2 +·O2→ OH + OH-+O2
·O2- + 2H+ → H2O2
此外·OH,·OOH和H2O2之间可以相互转化
H2O2 +·OH→·OOH + H2O2
利用高度活性的羟基自由基.OH无选择性地将氧化包括生物难以降解的各种有机物并使之完全无机化。有机物在光催化体系中的反应属于自由基反应。
四基橙染料是一种常见的有机污染物,无挥发性,且具有相当高的抗直接光分解和氧化的能力;其浓度可采用分光光度法测定,方法简便,常被用做光催化反应的模型反应物。四基橙的分子式如图1所示:


从结构上看,它属于偶氮染料,这类染料是染料各类中最多的一种,约占全部染料的50%左右。根据已有实验分析,甲基橙是较难降解的有机物,因而以它作为研究对象有一定的代表性。
三、仪器试剂
722型分光光度计1台;125W高压汞灯1支;反应器1个;充气泵1个;恒温水浴1套;磁力搅拌器1台;离心机1台;台秤1台;秒表1块;10mL移液管1支;20mL移液管1支;500 mL量筒1支;吸耳球;离心管7支。
甲基橙贮备液(1000mg/L);纳米TiO2(P25)。
四、实验步骤
1、 了解可见光分光光度计的原理与使用方法,参阅有关教材及文献资料。
2、 调整分光光度计零点
打开722型分光光度计电源开关,预热至稳定。调节分光光度计的波长旋钮至462nm。打开比色槽盖,即在光路断开时,调节“0”旋钮,使透光率值为0.取一只1cm比色皿,加入参比溶液蒸馏水,擦干外表面(光学玻璃面应用擦镜纸擦拭),放入比色槽中,确保放蒸馏水的比色皿在光路上,将比色槽盖合上,即光路通时,调节“100”旋钮使透光率值为100%。
3、 四基橙光催化降解
进行光催化反应实验时,首先向反应器内加入10mL的1000 mg/L的甲基橙贮备液,并加480mL水稀释,配成500mL的20 mg/L的甲基橙溶液,然后加入0.2g纳米TiO2催化剂,磁力搅拌使之悬浮。避光充空气搅拌30min,使甲基橙在催化剂的表面达到吸附/脱附平衡,移取10mL溶液于离心管内。然后开通冷却水,并开启淘汰进行光催化反应25min,每隔5min移取10mL反应液,经离心分离后,取上清液进行可见分光光度法分析。采用722型可见分光光度计,通过反应液的吸光度A测定来监测甲基橙的光催化脱色和分解效果。在0—20 mg/L范围内,甲基橙溶液浓度与其462nm处的吸收什呈极显著的正相关(相关系数达0.999以上)。
五、数据处理
1、 设计实验数据表,记录温度。A0,A 等数据;
实验温度:29.2℃

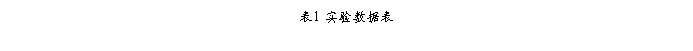
2、 采用积分法中的作图法由实验数据确定反应级数。
根据本实验的原理部分知道,该反应是一个表面催化反应,而一般表面催化反应更多的是零级反应;不妨设纳米Ti02光催化降解甲基橙的反应是一级反应:即ln(1/A)= k1t +常数
显然,以浓度ln(1/A)对时间t作图


据图2可知,在0—25min中时ln(1/A)~t关系成一直线,因此符合假设,即纳米Ti02光催化降解甲基橙的反应是一级反应。
3、 由所得直线的斜率求出反应的速率常数k1
根据图2可知:反应的速率常数k1=0.1071min-1 。
4、 计算甲基橙光催化降解的半衰期t1/2。
甲基橙光催化降解的半衰期t1/2=ln2/k1=6.47min
5、 甲基橙降解率计算:η=(c0-c)/c0,其中c0为光照前降解液浓度,c为降解后的浓度。由于甲基橙溶液浓度和它的吸光度呈线性关系,所以降解脱色率又可以由吸光度计算,即η=(A0-A)/A0,其中A0为光照前降解液吸光度,A为降解后吸光度。
甲基橙的降解率,如表1所示,η~t的 关系如图3所示。


六、讨论与分析
1、600mL 40 mg/L的甲基橙溶液,0.2克纳米TiO2为催化剂,在高压汞灯光照条件下,30min中内可以最大降解率约98.16%。
2、该实验中采用积分法中的作图法由实验数据确定反应级数时,舍去了30min的数据,是因为数据偏差较大,可能是因为离心后依然有部分TiO2悬浮在溶液中,而最后一组的吸光度应该很低,所以微量TiO2也会影响测定的准确性。最后得到ln(1/A)~t的线性相关度为99.29%,线性相关度好;说明纳米Ti02在前30分钟搅拌充分,甲基橙在催化剂达到吸附/脱附平衡,且光照反应、取样、离心等操作到位,数据相关性较好。
3、由η~t图可知30min中内可以最大降解率约98.16%,且降解数度在约10分钟前降解率和时间几乎呈现线性关系,在之后的反应中降解率的变化变慢,降解速率下降,渐渐趋向平缓,越接近100%速率越低。
七、思考题
1、 实验中,为什么用蒸馏水作参比溶液来调节分光光度计的透光率值为100%?一般选择参比溶液的原则是什么?
答:用蒸馏水作参比溶液来调节分光光度计的透光率值为100%,以消除溶液中的水对光的吸收反射或散射造成的误差。
一般选择参比溶液的原则:当试样溶液、显色剂及所用的其它试剂在测定波长处均无吸收时,可选用蒸馏水作参比液;若有显色剂或其它试剂对入射光有吸收,应选用试剂空白为参比;若试样中其它组分有吸收,而显色剂无吸收且不与其它组分作用,应选用不加显色剂的试样溶液作参比液。
2、 甲基橙溶液需要准确配制吗?
答:不需要;根据实验结论可知,甲基橙浓度可以通过分光光度计测量;因此整个实验中甲基橙溶液是不需要准确配制的。
3、 甲基橙光催化降解速率与哪些因素有关?
答:影响甲基橙光催化降解速率因素有:纳米Ti02颗粒大小、光照强度、搅拌程度、催化剂的用量、温度、溶液初始pH、溶液初始浓度等。
第二篇:TiO2光催化降解甲基橙性能的研究


- 大学化学基础实验报告
-
基础化学实验报告
基础化学实验报告实验名称班组姓名同组人实验日期一实验目的1有助于提高学生的综合实验能力而且可以提高学生对于化学实验的兴趣2掌握制备…
-
基础化学实验报告格式
院系年级专业姓名学号课程名称基础化学实验实验日期年月日实验地点指导老师测定实验例二氧化碳相对分子质量的测定实验报告院系年级专业姓名…
-
基础化学实验II实验报告模板
浙江大学基础化学实验II实验报告姓名班级实验台号实验名称实验时间一实验目的二实验原理三主要试剂及主副产物的物理常数四主要试剂用量及…
-
化学实验报告 实验__化学实验基本操作
实验报告姓名:班级:同组人:自评成绩:项目:化学实验基本操作课程:学号:一、实验目的1.熟悉实验室规则,安全守则及意外事故处理。2…
-
甲基橙的制备 有机化学实验报告
实验学专班姓指导日机化学实验报告名称甲基橙的制备业化学工程与工艺级名学号教师房江华李颖期有一实验目的1通过甲基橙的制备学习重氮化反…
-
甲基橙的制备实验报告
实验学专班姓指导日机化学实验报告名称院化学工程学院业化学工程与工艺级化工xx班名xxx学号xxx教师期有一实验目的1通过甲基橙的制…
-
甲基橙的制备实验报告(4)沈杰
有机化学实验报告实验名称:甲基橙的制备学院:化学工程学院专业:化学工程与工艺班级:化工11-4班姓名:##学号指导教师:日期:20…
-
10银纳米粒子制备实验报告
开放实验总结报告学生姓名班级学号所在院系专业开放实验室名称218218221实验室日期一实验项目概况二实验项目技术报告23456三…
- 甲基橙实验报告