摩尔气体常数的测定
摩尔气体常数的测定
一、实验目的
1.了解一种测定摩尔气体常数的方法。
2.熟悉分压定律与气体状态方程的应用。
3.练习分析天平的使用与测量气体体积的操作。
二、实验原理
气体状态方程式的表达式为:pV = nRT = 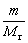 RT (1)
RT (1)
式中: p ——气体的压力或分压(Pa)
V ——气体体积(L)
n ——气体的物质的量(mol)
m ——气体的质量(g)
Mr ——气体的摩尔质量(g·mol-1)
T ——气体的温度(K);
R ——摩尔气体常数(文献值:8.31Pa·m3·K-1·mol-1或J·K-1·mol-1)
可以看出,只要测定一定温度下给定气体的体积V、压力p与气体的物质的量n或质量m,即可求得R的数值。
本实验利用金属(如Mg、A1或Zn)与稀酸置换出氢气的反应,求取R值。例如:
Mg(s)* + 2H+(aq)* = Mg2+(aq) + H2(g)* (2)
ΔrH 298=-466.85(kJ·mol-1)
298=-466.85(kJ·mol-1)
[说明] * s:表示固态(分子); aq:表示水合的离子(或分子); g:表示气态(分子)
 将已精确称量的一定量镁与过量稀酸反应,用排水集气法收集氢气。氢气的物质的量可根据式(2)由金属镁的质量求得:
将已精确称量的一定量镁与过量稀酸反应,用排水集气法收集氢气。氢气的物质的量可根据式(2)由金属镁的质量求得:
由量气管可测出在实验温度与大气压力下,反应所产生的氢气体积。
由于量气管内所收集的氢气是被水蒸气所饱和的,根据分压定律,氢气的分压 ,应是混合气体的总压p(以100Kpa计)与水蒸气分压
,应是混合气体的总压p(以100Kpa计)与水蒸气分压 之差:
之差: (3)
(3)
将所测得的各项数据代入式(1)可得:

三、实验用品

仪器:分析天平,称量纸(蜡光纸或硫酸纸),量筒(10mL),漏斗,温度计(公用),砂纸,测定摩尔气体常数的装置(量气管[1],水准瓶[2],试管,滴定管夹,铁架,铁夹,铁夹座,铁圈,橡皮塞,橡皮管,玻璃导气管),气压计(公用),烧杯(100mL、400mL)细砂纸等。
药品:硫酸H2SO4(3mo1·L-1),镁条(纯)。
四、实验内容
1. 镁条称量
取两根镁条,用砂纸擦去其表面氧化膜,然后在分析天平上分别称出其质量,并用称量纸纸包好记下质量,待用(也可由实验室老师预备)。
镁条质量以0.0300~0.0400g为宜。镁条质量若太小,会增大称量及测定的相对误差。质量若太大,则产生的氢气体积可能超过量气管的容积而无法测量。称量要求准确至±0.0001g。
2. 仪器的装置和检查
按图1装置仪器。注意应将铁圈装在滴定管夹的下方,以便可以自由移动水准瓶(漏斗)。打开量气管的橡皮塞,从水准瓶注入自来水,使量气管内液面略低于刻度“0”(若液面过低或过高,则会带来什么影响?)。上下移动水准瓶,以赶尽附着于橡皮管和量气管内壁的气泡,然后塞紧量气管的橡皮塞。

 为了准确量取反应中产生的氢气体积,整个装置不能有泄漏之处。检查漏气的方法如下:塞紧装置中连接处的橡皮管,然后将水准瓶(漏斗)向下(或向上)移动一段距离,使水准瓶内液面低于(或高于)量气管内液面。若水准瓶位置固定后,量气管内液面仍不断下降(或上升),表示装置漏气(为什么?),则应检查各连接处是否严密(注意橡皮塞及导气管间连接是否紧密)。务必使装置不再漏气,然后将水准瓶放回检漏前的位置。
为了准确量取反应中产生的氢气体积,整个装置不能有泄漏之处。检查漏气的方法如下:塞紧装置中连接处的橡皮管,然后将水准瓶(漏斗)向下(或向上)移动一段距离,使水准瓶内液面低于(或高于)量气管内液面。若水准瓶位置固定后,量气管内液面仍不断下降(或上升),表示装置漏气(为什么?),则应检查各连接处是否严密(注意橡皮塞及导气管间连接是否紧密)。务必使装置不再漏气,然后将水准瓶放回检漏前的位置。
3. 金属与稀酸反应前的准备
取下反应用试管,将4~5mL 3 mo1·L-1H2SO4溶液通过漏斗注入试管中(将漏斗移出试管时,不能让酸液沾在试管壁上!为什么?)。稍稍倾斜试管,将已称好质量(勿忘记录)的镁条按压平整后蘸少许水贴在试管壁上部,如图 2所示,确保镁条不与硫酸接触,然后小心固定试管,塞紧(旋转)橡皮塞(动作要轻缓,谨防镁条落入稀酸溶液中)。
再次检查装置是否漏气。若不漏气,可调整水准瓶位置,使其液面与量气管内液面保持在同一水平面,然后读出量气管内液面的弯月面最低点读数。要求读准至±0.01mL,并记下读数(为使液面读数尽量准确,可移动铁圈位置,设法使水准瓶与量气管位置尽量靠近)。
4. 氢气的发生、收集和体积的量度
松开铁夹,稍稍抬高试管底部,使稀硫酸与镁条接触(切勿使酸碰到橡皮塞);待镁条落入稀酸溶液中后,再将试管恢复原位。此时反应产生的氢气会使量气管内液面开始下降。为了不使量气管内因气压增大而引起漏气,在液面下降的同时应慢慢向下移动水准瓶,使水准瓶内液面随量气管内液面一齐下降,直至反应结束,量气管内液面停止下降(此时能否读数?为什么?)。
待反应试管冷却至室温(约需10多分钟),再次移动水准瓶,使其与量气管的液面处于同一水平面,读出并记录量气管内液面的位置。每隔2~3min,再读数一次,直到读数不变为止。记下最后的液面读数及此时的室温和大气压力。从附表中查出相应于室温时水的饱和蒸气压。
打开试管口的橡皮塞,弃去试管内的溶液,洗净试管,并取另一份镁条重复进行一次实验。记录实验结果。
五、数据记录与处理

分析产生误差的原因:
六、注意事项
1.将铁圈装在滴定管夹的下方,以便可以自由移动水准瓶(漏斗)。
2.橡皮塞与试管和量气管口要先试试合适后再塞紧,不能硬塞,防止管口塞烂;
3.从水准瓶注入自来水,使量气管内液面略低于刻度“0”
4.橡皮管内气泡排净标志:皮管内透明度均匀,无浅色块状部分;
5.气路通畅:试管和量气管间的橡皮管勿打折,保证通畅后再检查漏气或进行反应;
6.装H2SO4:长颈漏斗将H2SO4注入试管中,不能让酸液沾在试管壁上!
7.贴镁条:按压平整后蘸少许水贴在试管壁上部,确保镁条不与硫酸接触,然后小心固定试管,塞紧(旋转)椽皮塞,谨防镁条落入稀酸溶液中。
8.反应:检查不漏气后再反应(切勿使酸碰到橡皮塞);
9.读数:调两液面处于同一水平面,冷至室温后读数(小数点后两位,单位:mL)
七、思考题
1.本实验中置换出的氢气的体积是如何量度的?为什么读数时必须使水准瓶内液面与量气管内液面保持在同一水平面?
2.量气管内气体的体积是否等于置换出氢气的体积?量气管内气体的压力是否等于氢气的压力?为什么?
3.试分析下列情况对实验结果有何影响:
(1)量气管(包括量气管与水准瓶相连接的橡皮管)内气泡未赶尽;
(2)镁条表面的氧化膜未擦净;
(3)固定镁条时,不小心使其与稀酸溶液有了接触;
(4)反应过程中,实验装置漏气;
(5)记录液面读数时,量气管内液面与水准瓶内液面不处于同一水平面;
(6)反应过程中,因量气管压入水准瓶中的水过多,造成水由水准瓶中溢出;
(7)反应完毕,未等试管冷却到室温即进行体积读数。
[1]量气管的容量不应小于50mL,读数可估计到0.01mL或0.02mL。可用碱式滴定管代替。
[2]本实验中用短颈(或者长颈)漏斗代替水准瓶。
第二篇:实验二 置换法测定摩尔气体常数
置换法测定摩尔气体常数R
一、 目的要求:
1、掌握理想气体的状态方程和气体分压定律的应用
2、练习测量气体体积的操作和气压计的使用
3、测定摩尔气体常数R
二、 基本原理:
1、活泼金属镁与稀硫酸反应,置换出氢气
Mg+H2SO4=MgSO4+H2↑
2、准确称取一定质量(mMg)的金属镁,使其与过量的稀硫酸作用,在一定温度和压力下测定被置换出来的氢气的体积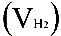 ,有理想气体状态方程式即可算出摩尔气体常数 R. R=
,有理想气体状态方程式即可算出摩尔气体常数 R. R=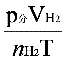 (
(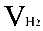 为氢气的分体积,
为氢气的分体积,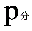 为氢气的分压强,
为氢气的分压强, 为氢气的摩尔质量,T为温度)
为氢气的摩尔质量,T为温度)
三、 数据记录及处理:
室 温 t = 23.5 ℃
大气压力 p = 101720 Pa
室温时水的饱和蒸汽压 p水= 2843 Pa
表1
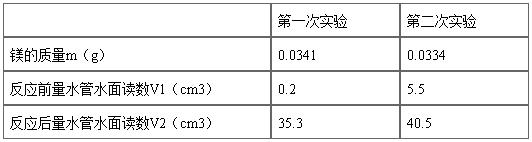
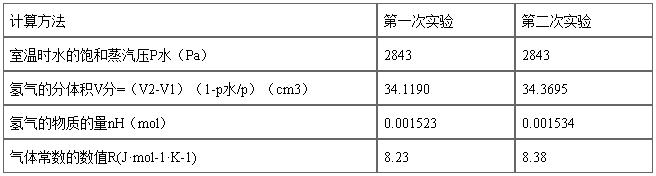
表2
百分误差= 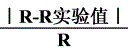
四、 结果与讨论
1、R的测量值与实际值的差距在误差允许范围内。
2、实验中测定气体体积的时候,不够精确,会有误差。
-
摩尔气体常数的测定
实验十六摩尔气体常数的测定一实验目的1了解分析天平的结构计量性能学习并掌握直接称量法2学习测量气体体积的操作装置的安装检漏量气管液…
-
摩尔气体常数的测定
摩尔气体常数的测定一实验目的1了解一种测定摩尔气体常数的方法2熟悉分压定律与气体状态方程的应用3练习分析天平的使用与测量气体体积的…
- 实验三 摩尔气体常数的测定
-
摩尔气体常数的测定
实验十六摩尔气体常数的测定一实验目的1了解分析天平的结构计量性能学习并掌握直接称量法2学习测量气体体积的操作装置的安装检漏量气管液…
-
物化实验报告_液体饱和蒸气压的测定
实验4液体饱和蒸气压的测定丛乐20xx011007生51实验日期20xx年11月24日星期六提交报告日期20xx年12月8日星期六…
-
物化实验报告_液体饱和蒸气压的测定
实验4液体饱和蒸气压的测定丛乐20xx011007生51实验日期20xx年11月24日星期六提交报告日期20xx年12月8日星期六…
-
华师物化实验报告 纯液体饱和蒸气压的测定
华南师范大学实验报告学生姓名学号专业年级班级课程名称实验项目纯液体饱和蒸气压的测定静态法实验类型验证设计综合实验时间年月日实验指导…
-
实验二 液体饱和蒸气压的测定实验报告
实验二液体饱和蒸气压的测定MeasurementofSaturatedVaporPressure王暮寒PB1020xx67中国科学…
-
物理化学实验报告纯液体饱和蒸气压的测定
华南师范大学实验报告学生姓名学号专业年级班级课程名称物理化学实验实验项目纯液体饱和蒸气压的测定静态法实验类型验证设计综合实验时间年…
-
摩尔气体常数的测定
实验十六摩尔气体常数的测定一实验目的1了解分析天平的结构计量性能学习并掌握直接称量法2学习测量气体体积的操作装置的安装检漏量气管液…